Chapitre 3
Exercices
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je me teste
Je sais
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Lorsqu'un corps pur change d'état, sa température :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Lors du changement d'état d'un mélange, on observe :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Lors du changement d'état d'un corps pur, la grandeur qui est modifiée est :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
4Lors du changement d'état d'un corps pur, une grandeur parmi celles proposées reste toujours identique :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5Changement d'état ou non ?
Parmi les mots indiqués ci-dessous, retrouve l'intrus :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6Retrouve les légendes relatives aux puces sur le schéma suivant : un thermomètre - un ballon - une plaque chauffante - un chronomètre.

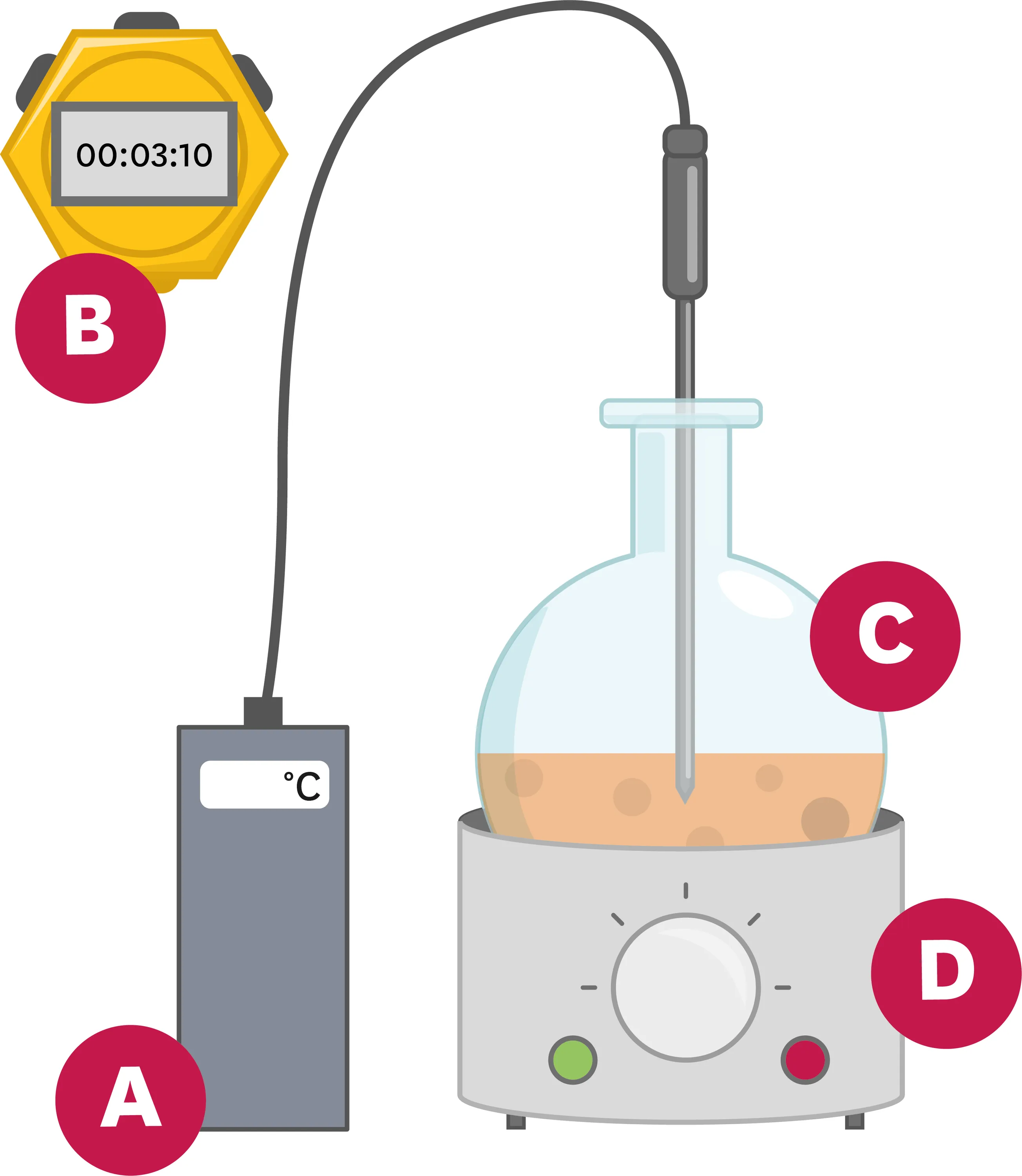
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7Complète la grille de mots-croisés. Pour écrire sur ce schéma, veuillez cliquer sur l'image et utiliser notre outil de dessin.
Horizontal :
1. Instrument de mesure de la température.
2. Passage d'une substance de l'état gazeux à l'état liquide.
1. Instrument de mesure de la température.
2. Passage d'une substance de l'état gazeux à l'état liquide.
Vertical :
3. Passage d'une substance de l'état solide à l'état liquide.
4. Stabilisation de la température lors d'un changement d'état.
3. Passage d'une substance de l'état solide à l'état liquide.
4. Stabilisation de la température lors d'un changement d'état.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je sais faire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8Pour mesurer une température, on utilise :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9Pour mesurer une pression, on utilise :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercice corrigé
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Compétence : Interpréter des résultats.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10Un graphique pour carte d'identité d'une substance.
Lors du changement d'état d'une substance, on relève sa température au cours du temps. On obtient la courbe ci-contre.
1. Indique s'il s'agit du changement d'état d'un corps pur ou d'un mélange en justifiant à l'aide de la courbe.

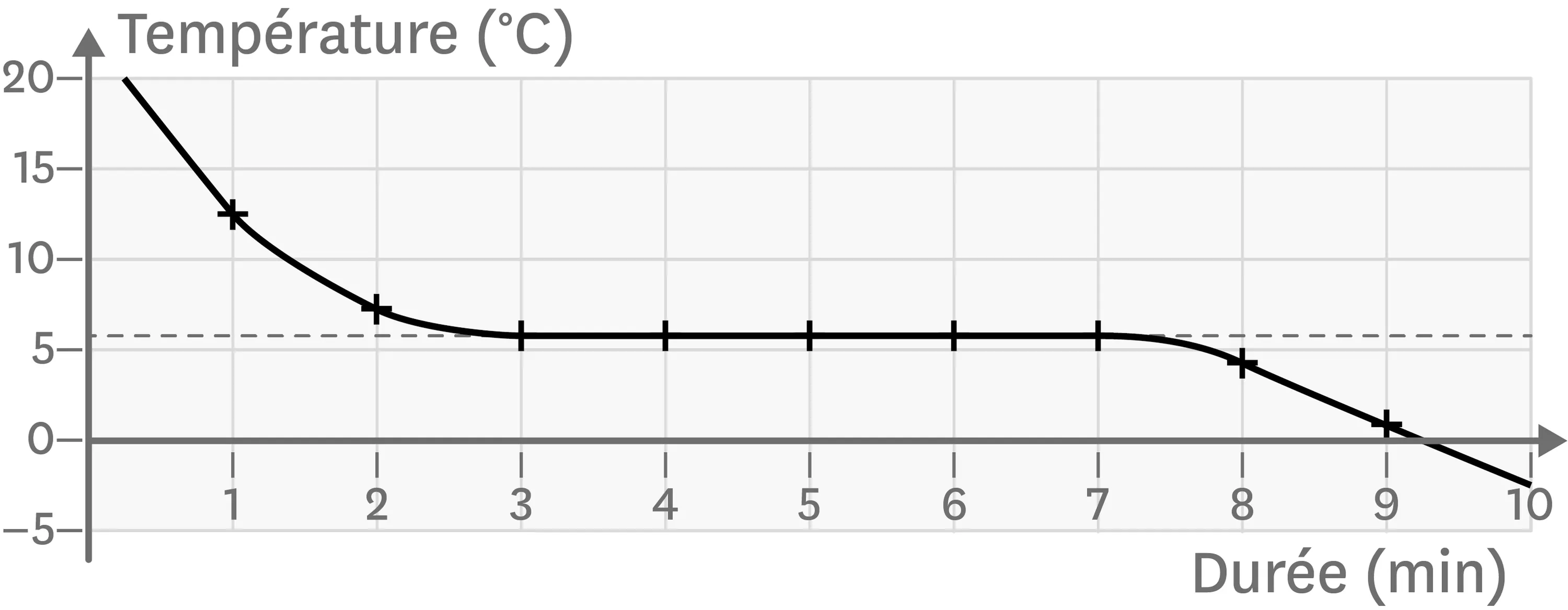
2. À l'aide du tableau ci-dessous, indique le nom de la substance qui change d'état ainsi que le nom du changement d'état qui a lieu.
| Substance | Température de fusion à la pression atmosphérique (en °C) | Température d'ébullition à la pression atmosphérique (en °C) |
|---|---|---|
| acétone | -95 | 56 |
| eau | 0 | 100 |
| cyclohexane | 6,5 | 80,7 |
| chlorure de sodium | 801 | 1 413 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Étapes de la méthode
- L'existence ou non d'un palier de température permet de savoir s'il s'agit d'un corps pur ou d'un mélange.
- À une pression donnée, la température de changement d'état d'un corps pur (température du palier) est une de ses propriétés caractéristiques. L'évolution de la température avant et après le palier permet de connaitre le changement d'état en question.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Corrigé
1. On observe un palier de température sur la courbe. La substance qui change d'état est donc un corps pur.
2. Un palier apparait à une température de 6,5 °C et la température diminue avant et après le palier. Il s'agit donc de la solidification du cyclohexane.
2. Un palier apparait à une température de 6,5 °C et la température diminue avant et après le palier. Il s'agit donc de la solidification du cyclohexane.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercice similaire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11Une deuxième identification.
Réponds aux questions de l'exercice 10 en utilisant la courbe suivante.

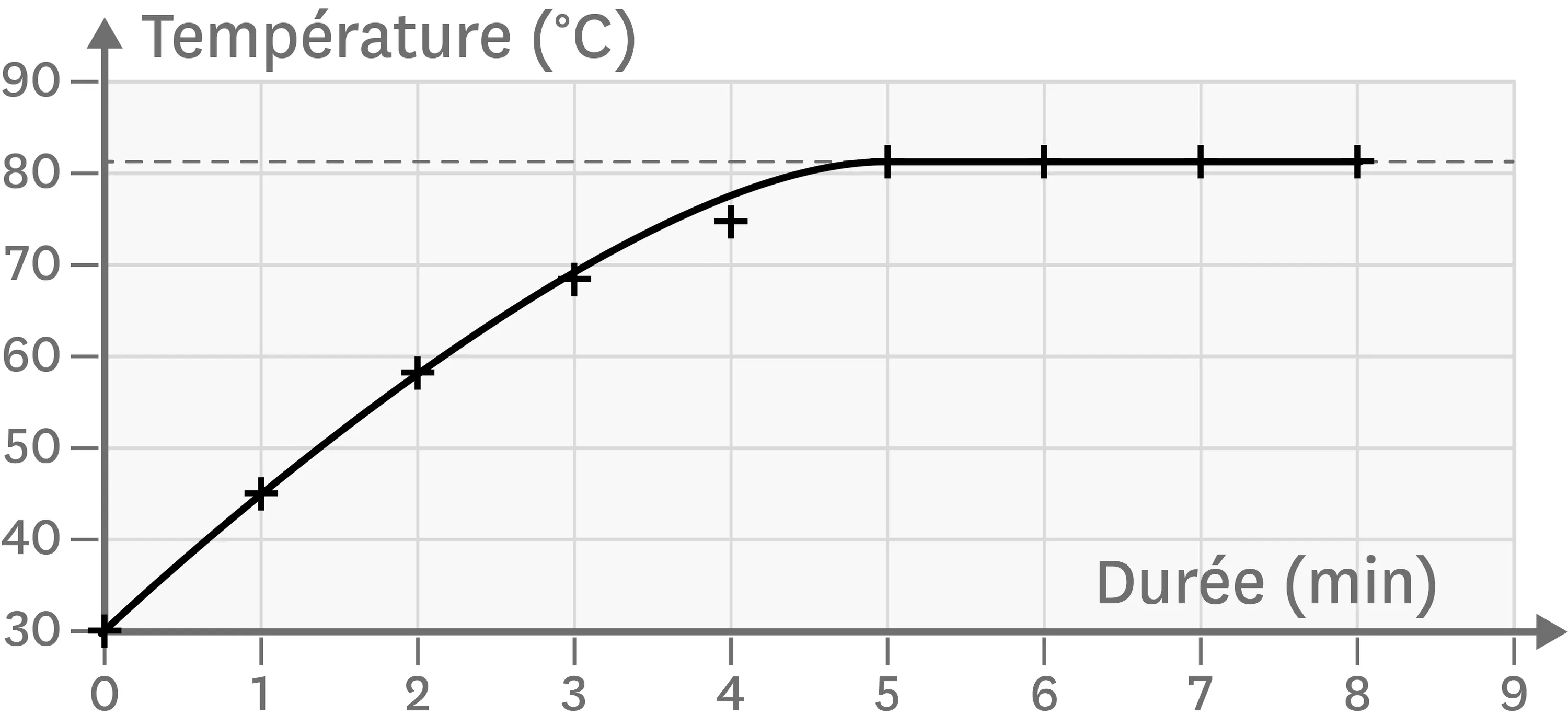
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je m'entraine
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12Une courbe donne beaucoup d'informations.
Réponds aux questions suivantes en observant la courbe de fusion de l'eau ci-contre, qu'on peut décomposer en trois parties.
1. Reproduis la courbe et indique dans quel état physique (solide, liquide ou gazeux) se trouve l'eau dans chacune des parties de la courbe. N'oublie pas qu'il est possible pour l'eau d'être présente sous deux états physiques en même temps.
2. À quelle température la fusion de l'eau se produit-elle ?
3. À quel instant la fusion débute-t-elle ?
4. À quel instant la fusion est-elle terminée ?
5. Combien de temps dure la fusion de l'eau ?

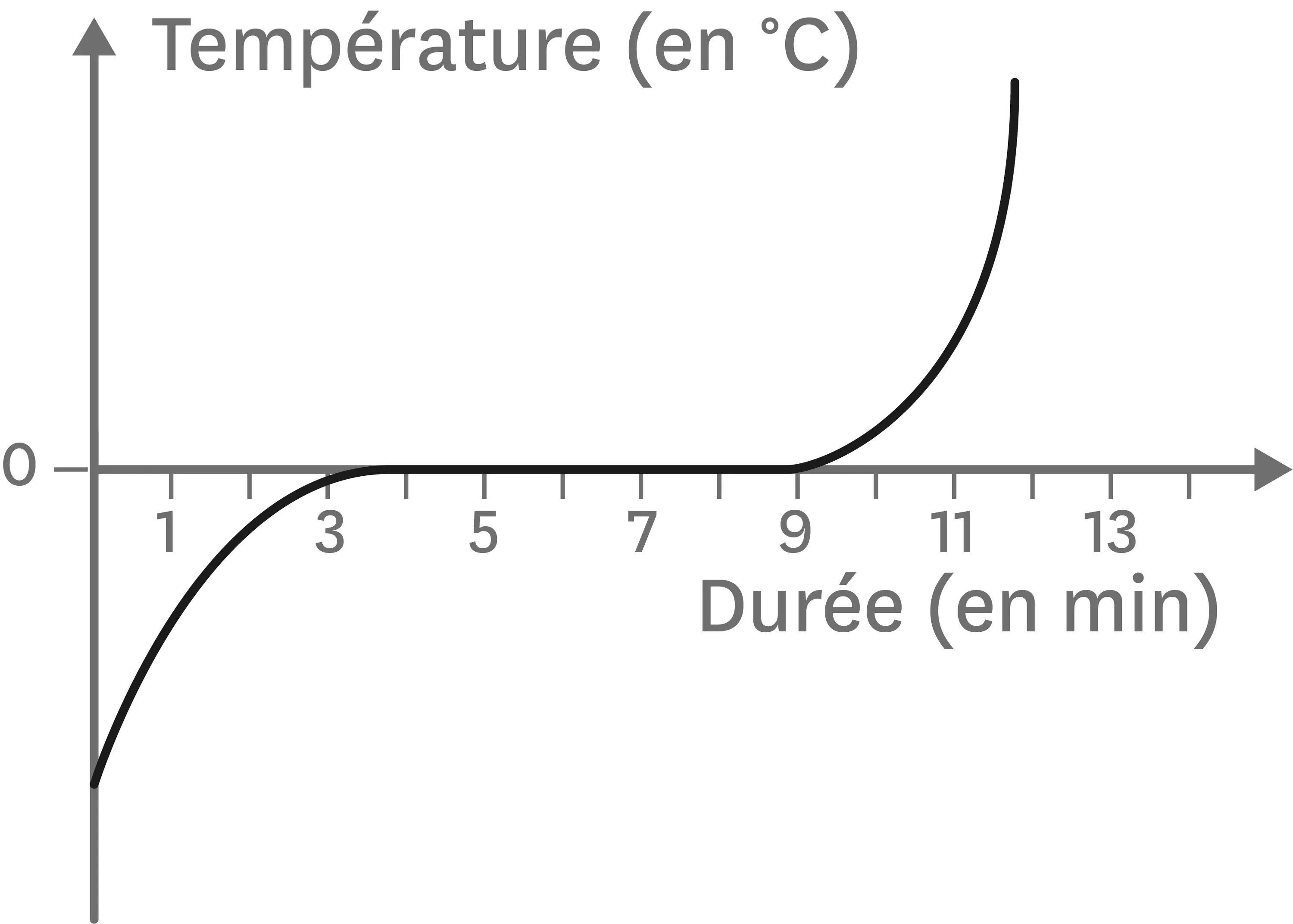
1. Reproduis la courbe et indique dans quel état physique (solide, liquide ou gazeux) se trouve l'eau dans chacune des parties de la courbe. N'oublie pas qu'il est possible pour l'eau d'être présente sous deux états physiques en même temps.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13Mesurer la température d'une substance.
Dans un bécher, on a versé une substance dont on souhaite mesurer la température.
1. Parmi les quatre schémas représentés, indique celui qui correspond à la mesure correcte de la température de la substance. Justifie ta réponse.

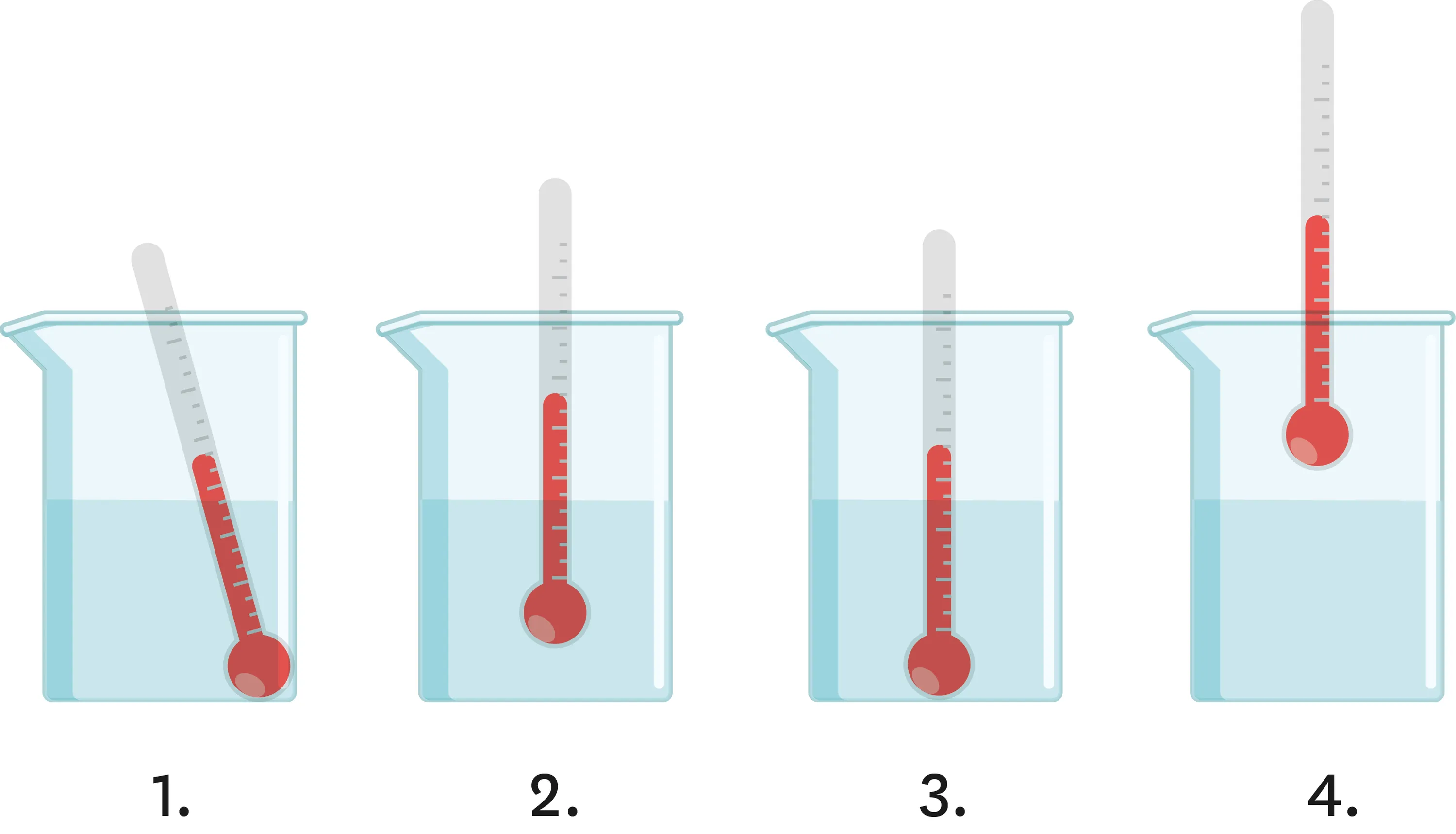
1. Parmi les quatre schémas représentés, indique celui qui correspond à la mesure correcte de la température de la substance. Justifie ta réponse.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14Un schéma à connaitre.
1. Représente par un schéma le montage permettant de mesurer la température d'un liquide lors de son chauffage.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15Savoir tracer un graphique.
Compétence
Produire et transformer des tableaux ou des documents graphiques
En étudiant l'ébullition de l'eau, on obtient les valeurs de température indiquées ci-dessous.
| Temps (en min) | 0 | 1 | 2 | 3 | 4 |
| Température (en °C) | 19,4 | 19,7 | 30,2 | 44,3 | 62,3 |
| Temps (en min) | 5 | 6 | 7 | 8 | 9 |
| Température (en °C) | 84,9 | 97,9 | 100 | 100 | 100 |
| Temps (en min) | 10 | 11 | 12 | 13 |
| Température (en °C) | 100 | 100 | 100 | 100 |
1. À l'aide du tableau, trace la courbe correspondant à l'évolution de la température en fonction du temps.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16La pression : des appareils de mesure et des unités.
1. Quel instrument de mesure utilise-t-on pour mesurer la pression exercée par l'air ambiant ?
2. On souhaite suivre l'évolution de la pression exercée par les gaz formés au sein d'un autocuiseur. Quel instrument de mesure utilise-t-on ?
3. Dans quelle unité peut-on exprimer ces mesures de pression ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Compétence : Produire et transformer des tableaux ou des documents graphiques.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17-ACorps pur ou mélange ? Tracer un graphique et l'exploiter.
1. Trace la courbe de refroidissement d'un liquide sur papier millimétré en utilisant les données suivantes. L'axe vertical correspond aux valeurs de température (échelle : 1 cm pour 5 °C). L'axe horizontal correspond aux valeurs de temps (échelle : 1 cm pour 0,5 min).
2. Un petit carreau correspond à 0,5 °C. Pour 17,6 °C tronque à 17,5 °C. Pour 17,5 °C arrondis à 17,5 °C. Fais de même pour les autres valeurs de température dont le chiffre après la virgule n'est pas égal à 5.
3. Nomme le changement d'état qui débute aux alentours d'une minute.
4. Aide-toi du cours. Comment évolue la température lors du changement d'état d'un corps pur ?
5. Aide-toi du cours. Comment évolue la température lors du changement d'état d'un mélange ?
6. Observe le graphique à partir d'une minute et déduis de tes réponses aux questions 4 et 5 si le liquide est pur ou non.
7. Ce liquide est-il de l'eau ?
| Temps (en min) | 0 | 0,5 | 1 | 1,5 | 2 | 2,5 | 3 | 3,5 |
| Température (en °C) | 14,2 | 7,7 | 5,5 | 5,5 | 5,5 | 5,5 | 4,2 | 2,8 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17-BCorps pur ou mélange ? Tracer un graphique et l'exploiter.
1. À l'aide de la fiche méthode p. 452, trace la courbe de refroidissement d'un liquide sur papier millimétré en utilisant les données et les échelles suivantes 1 cm pour 5 °C ; 1 cm pour 0,5 min.
2. La courbe obtenue n'est pas la même pour un corps pur et pour un mélange. Observe le graphique. Déduis-en si le liquide étudié est un corps pur ou un mélange.
| Temps (en min) | 0 | 0,5 | 1 | 1,5 | 2 | 2,5 | 3 |
| Température (en °C) | 16 | 11,1 | 5 | 0,4 | -3,3 | -4,0 | -4,6 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17-CCorps pur ou mélange ? Tracer un graphique et l'exploiter.
1. Trace le graphique correspondant aux données d'analyse thermique ci-dessous. Indique, à partir du graphique que tu auras tracé, si le liquide refroidi est un mélange ou un corps pur.
| Temps (en min) | 0 | 0,5 | 1 | 1,5 | 2 | 2,5 | 3 |
| Température (en °C) | 21,5 | 14,2 | 7,7 | 2,6 | 0,2 | -1,7 | -3,5 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
J'approfondis
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18Le cycle de l'eau.
Sous l'effet conjugué du soleil et des vents, une petite partie de l'eau des océans s'évapore, passant de l'état liquide à l'état gazeux.
La vapeur d'eau, en s'élevant, entre en contact avec de l'air de plus en plus froid. Une partie de la vapeur redevient liquide, des nuages se forment, contenant de la vapeur et des gouttelettes. Ils peuvent donner lieu à de la pluie.
Emportés par les vents, les nuages peuvent atteindre des zones où l'air est très froid, entrainant la transformation d'une partie des gouttelettes en eau solide. Cela peut donner lieu à des chutes de neige, par exemple.
Cette accumulation de neige et de glace, en montagne notamment, fond et diminue au printemps, pouvant provoquer des inondations dues à l'élévation du niveau des fleuves qui se jettent dans les mers et les océans.
1. Nomme le changement d'état évoqué dans chaque paragraphe du texte et repère-le dans le schéma ci-contre (A, B, C et D).
2 À l'aide du texte et du schéma, explique pourquoi on nomme l'ensemble de ces étapes le cycle de l'eau.

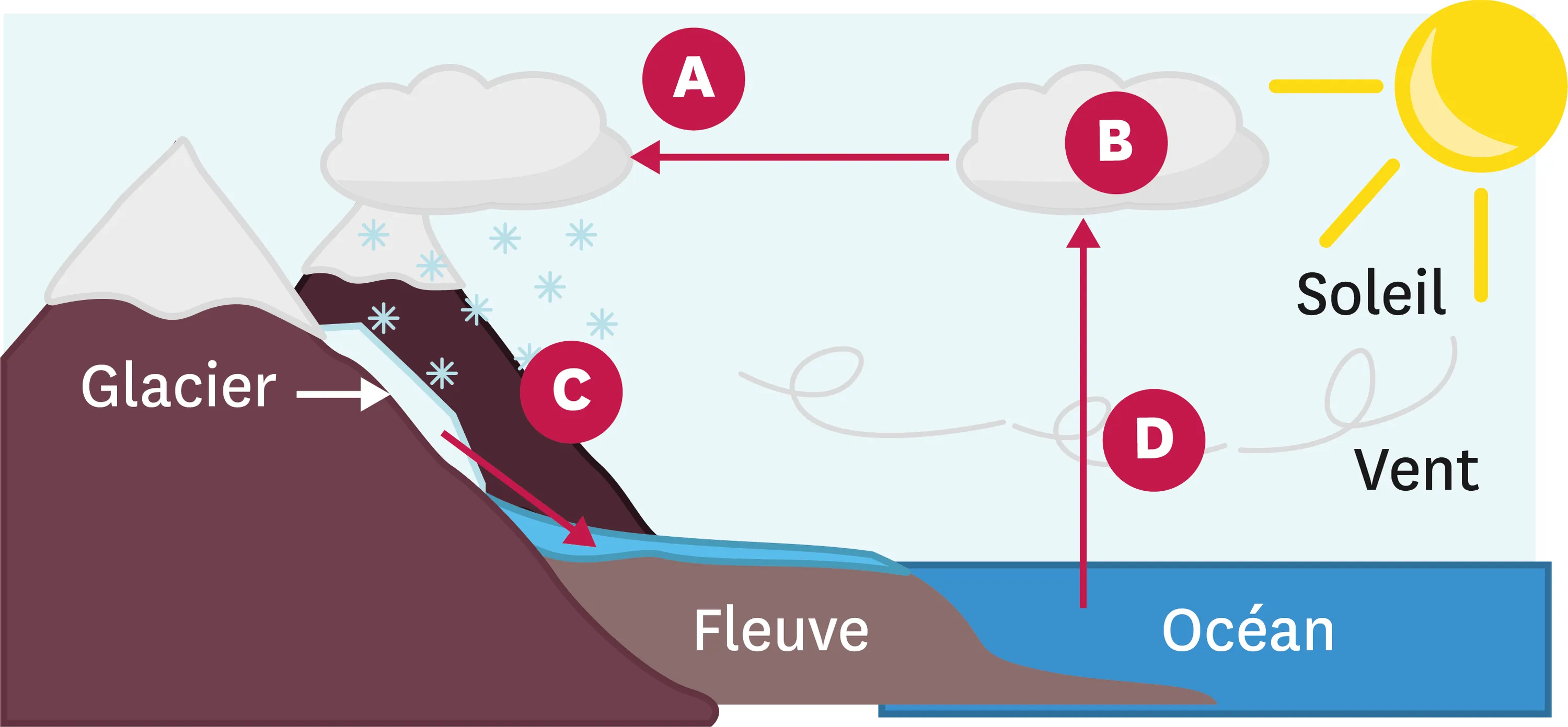
La vapeur d'eau, en s'élevant, entre en contact avec de l'air de plus en plus froid. Une partie de la vapeur redevient liquide, des nuages se forment, contenant de la vapeur et des gouttelettes. Ils peuvent donner lieu à de la pluie.
Emportés par les vents, les nuages peuvent atteindre des zones où l'air est très froid, entrainant la transformation d'une partie des gouttelettes en eau solide. Cela peut donner lieu à des chutes de neige, par exemple.
Cette accumulation de neige et de glace, en montagne notamment, fond et diminue au printemps, pouvant provoquer des inondations dues à l'élévation du niveau des fleuves qui se jettent dans les mers et les océans.
1. Nomme le changement d'état évoqué dans chaque paragraphe du texte et repère-le dans le schéma ci-contre (A, B, C et D).


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19Proposer un schéma.
Compétence
Produire et transformer des tableaux ou des documents graphiques
1. Représente par un schéma légendé le dispositif permettant de mesurer la température de glaçons placés dans un bécher lors de leur fusion.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20Comment obtient-on le sel ?
Pour récolter le sel, on fait entrer de l'eau de mer à travers des canaux dans une série de bassins, dont la profondeur est de plus en plus faible. L'eau est alors retenue et subit l'action conjuguée du soleil et du vent. Un saunier (professionnel de la récolte du sel) vient régulièrement retirer le sel des bassins pour le faire sécher dans les allées.


1. Sur quel changement d'état repose la récolte du sel ?
2. À l'aide du texte ci-dessus, quels sont les deux facteurs favorisant ce changement d'état ?
3. D'après toi, la récolte du sel peut-elle avoir lieu toute l'année ? Pourquoi ?


1. Sur quel changement d'état repose la récolte du sel ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21Reconnaitre des substances à l'aide de courbes de changement d'état.
Compétence
Produire et transformer des tableaux ou des documents graphiques
Mylène a préparé trois flacons : l'un contenant de l'eau pure, un autre de l'eau salée et un dernier du cyclohexane pur. Jérémy récupère les flacons et relève la température lors de la solidification de ces substances. Il s'aperçoit à la fin qu'il n'a pas laissé le temps à Mylène de noter le nom des substances sur les flacons.
1. Attribue chacune des courbes à la substance correspondante en justifiant.

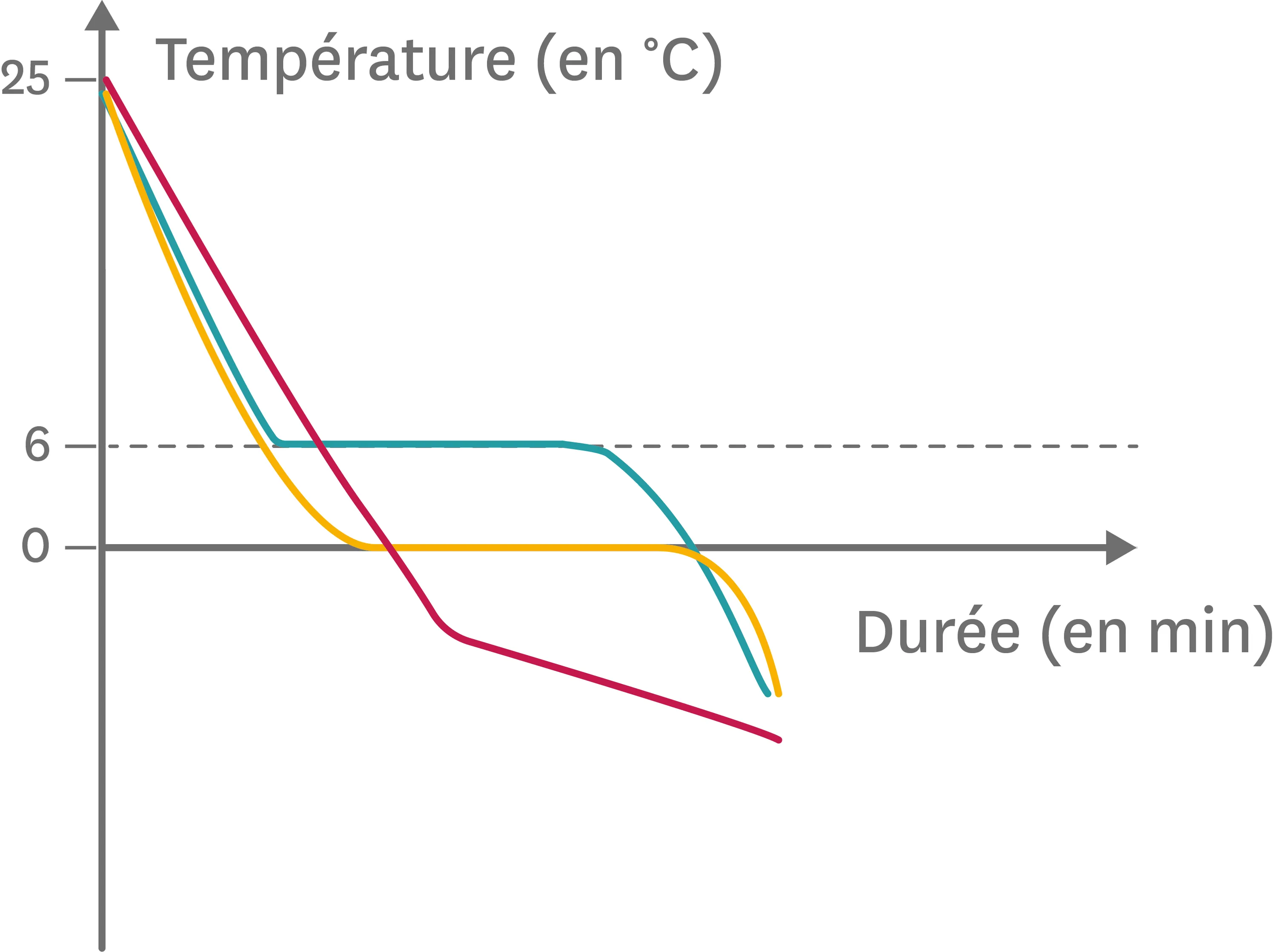
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22Températures de changements d'état.
Dans un laboratoire, un assistant a oublié de refermer une fenêtre en partant. La température de l'air descend pendant la nuit et atteint 3 °C. Le lendemain matin, il retrouve un solide dans l'un des flacons alors que l'armoire ne contenait que des liquides.
1. À l'aide du tableau, indique quelle substance a changé d'état pendant la nuit et justifie ta réponse.
2. Pour cacher son oubli, il place tous les flacons dans un bain-marie à 40 °C afin qu'ils ne soient plus aussi froids. Au bout d'un moment, l'un des liquides se met à bouillir. Lequel ?
| Substance | Température de fusion à la pression atmosphérique (en °C) | Température d'ébullition à la pression atmosphérique (en °C) |
| éther diéthylique | -116 | 35 |
| éthanol | -114 | 78 |
| acétone | -95 | 56 |
| cyclohexane | 6,5 | 80,7 |
1. À l'aide du tableau, indique quelle substance a changé d'état pendant la nuit et justifie ta réponse.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23Cuisine au bain-marie.
Lorsque l'on souhaite obtenir du chocolat liquide, il vaut mieux éviter de le faire chauffer directement dans une casserole : cela risque de le bruler. On utilise donc un bain-marie : on place le chocolat dans un récipient lui-même déposé dans une casserole contenant de l'eau que l'on chauffe.
1. Quel changement d'état va se produire pour le chocolat ?
2. Ce changement d'état du chocolat se produit entre 30 et 40 °C. Quel changement d'état de l'eau n'a donc pas lieu alors qu'elle est chauffée ?
1. Quel changement d'état va se produire pour le chocolat ?
3. Ce chauffage favorise pourtant un changement d'état de l'eau. Lequel ?
4. À quel endroit, dans l'eau du bain-marie, se produit ce changement d'état ?
5. En quoi le fait de prendre une casserole plus grande accélérera-t-il ce changement d'état de l'eau ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24Le verre à demi plein et le verre à demi vide.
On verse de l'eau dans un verre que l'on pose sur la table. La température de la pièce est aux alentours de 20 °C.
1. Que va-t-il se passer au bout de plusieurs jours ?
2. Propose deux moyens d'accélérer le phénomène observé.
1. Que va-t-il se passer au bout de plusieurs jours ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25Exploitation d'une expérience.
Les schémas suivants présentent une expérience pour étudier la solidification de l'eau et ses résultats.
1. De quel état physique à quel autre état physique passe-t-on lors de la solidification ?
2. À l'aide du schéma n°1, détermine les trois grandeurs étudiées lors de cette expérience.
3. À l'aide des schémas, précise lesquelles des grandeurs étudiées évoluent au cours de l'expérience.
1. De quel état physique à quel autre état physique passe-t-on lors de la solidification ?
4. D'après le cours, comment a évolué la troisième grandeur étudiée tout au long de l'expérience ? On pourra distinguer au moins trois moments différents.

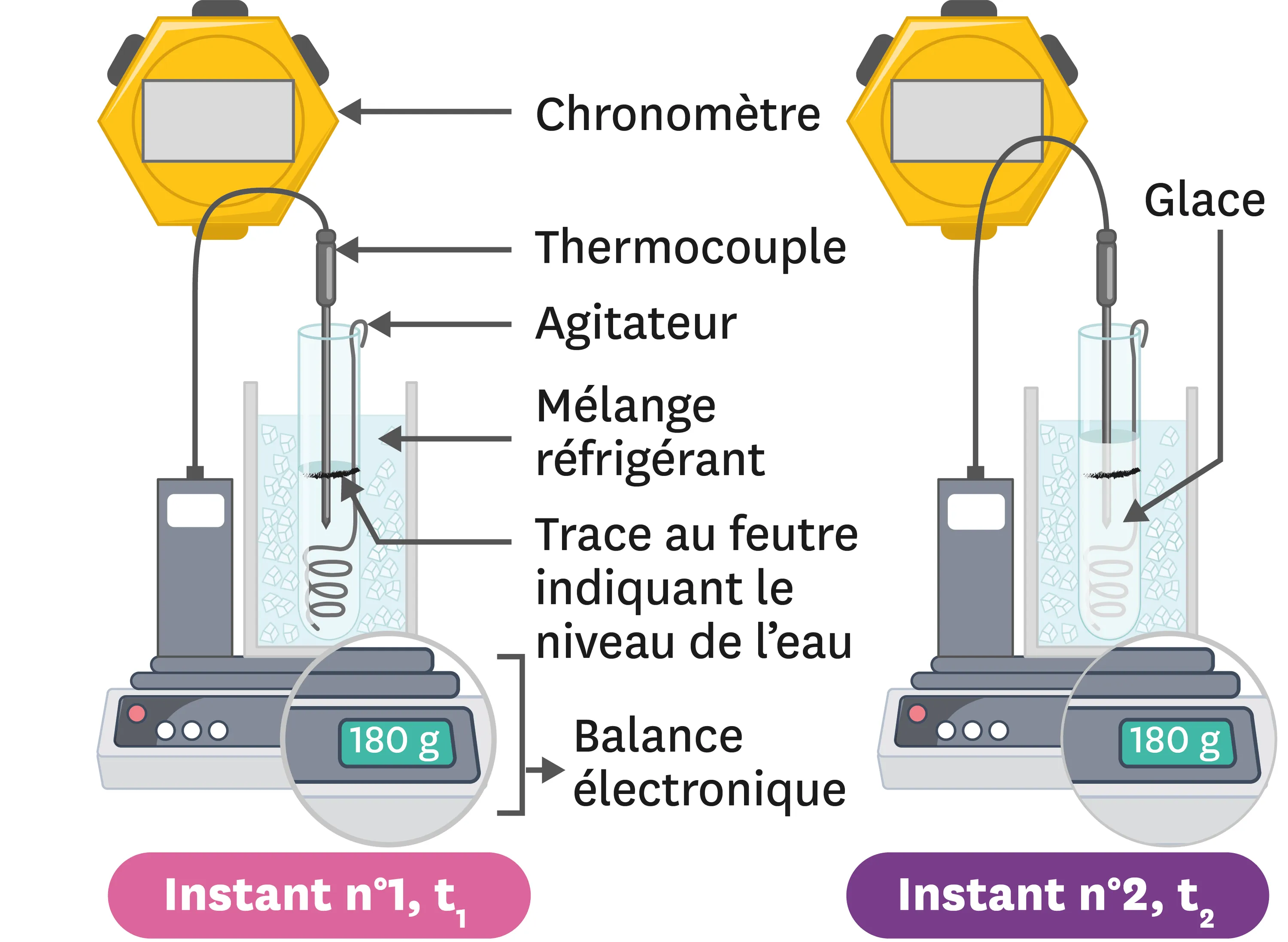


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je résous un problème
Compétence : Mettre en œuvre un raisonnement logique simple pour résoudre un problème.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
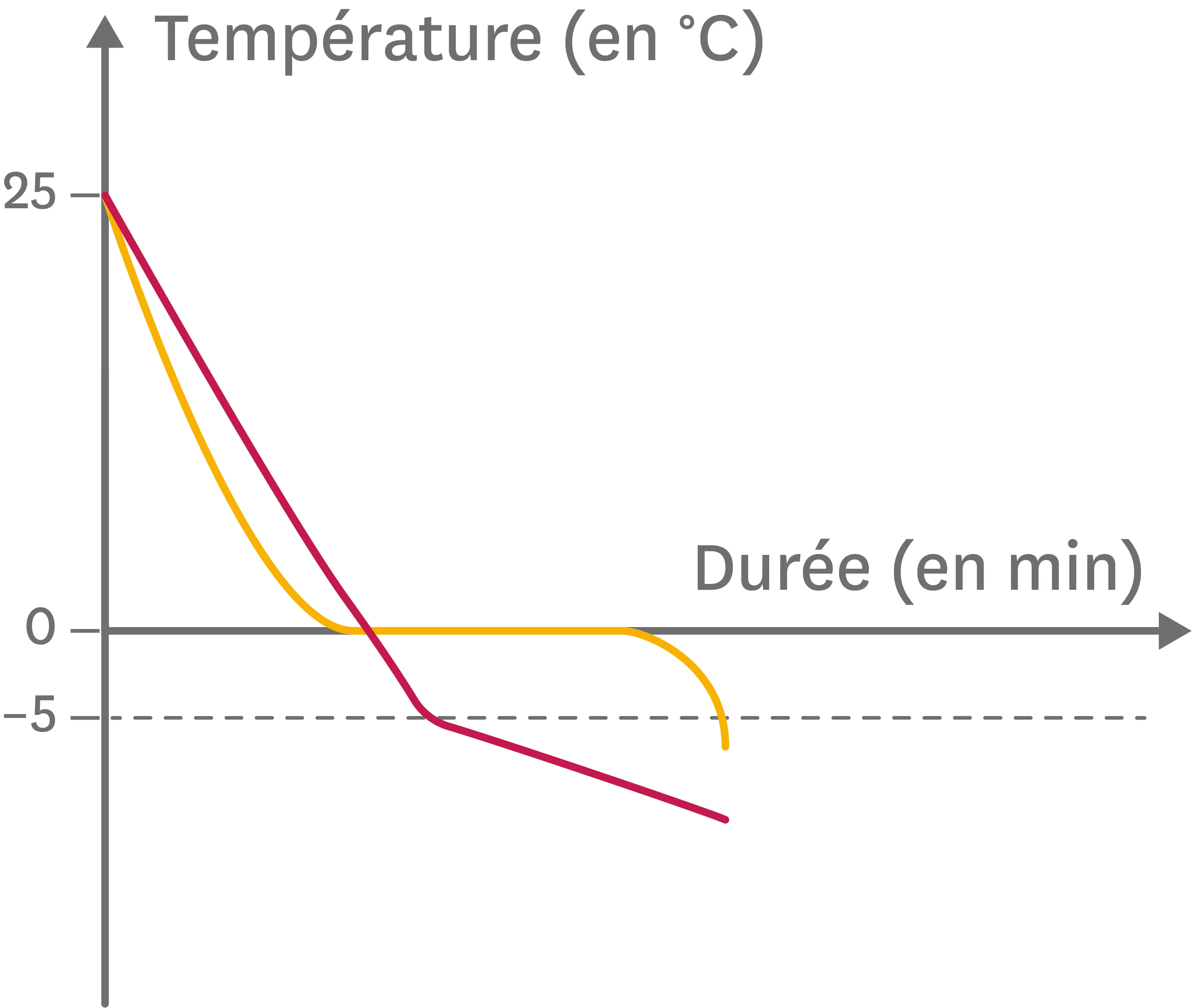
1. En hiver, lorsque la température de l'air risque d'atteindre 0 °C voire d'être négative et que les routes sont mouillées, on dépose du sel sur les routes afin d'éviter la formation de verglas.
À l'aide des courbes, explique comment le sel permet d'éviter la formation de verglas.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Salage des routes en hiver.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Courbes de solidification de l'eau pure et de l'eau salée.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercices supplémentaires
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26Impact du froid.
1. Si on refroidit une substance, au niveau microscopique, les particules :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27À chaque grandeur son unité.
1. Relis chaque grandeur à une unité correspondante.
| Une température s'exprime en... | |
| Une masse s'exprime en... | |
| Un volume s'exprime en... | |
| Une pression s'exprime en... |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
28Qu'est-ce qui change ? Qu'est-ce qui ne change pas ?
1. Écrire une phrase en utilisant les mots ci-dessous pour décrire ce qu'il se passe pour différentes grandeurs lors d'un changement d'état.
masse - température - volume - changement d'état - corps pur
masse - température - volume - changement d'état - corps pur
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
29Connaître les changements d'état.
1. Légende les flèches sur le schéma ci-dessous à l'aide des changements d'état suivants :
| Solide | ⇄ | Liquide | ⇄ | Gaz |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30Description à l'échelle des particules.
1. On fait chauffer de l'eau liquide de façon à la porter à ébullition. Décris à l'échelle des particules ce qu'il se passe au début du chauffage et lors de l'ébullition.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31Pas de graphique mais une allure.
Matthieu a étudié un corps pur, le cyclohexane, en le faisant changer d'état. Il a relevé l'évolution de la température en fonction du temps lors de sa solidification. Mais il ne retrouve plus son tableau de valeurs. En relisant le protocole, il s'aperçoit que le cyclohexane se trouvait à 20,0 °C avant de commencer l'expérience, que la solidification commençait au bout de 3 minutes à 6,5 °C et durait 4 minutes pour une expérience de 10 minutes au total et atteignant - 8,0 °C à la fin.
1. Représente l'allure du graphique correspondant à l'évolution de la température du cyclohexane en fonction du temps à l'aide des valeurs données dans l'énoncé et des échelles suivantes (1 cm ↔ 5 °C et 1 cm ↔ 1 min).
1. Représente l'allure du graphique correspondant à l'évolution de la température du cyclohexane en fonction du temps à l'aide des valeurs données dans l'énoncé et des échelles suivantes (1 cm ↔ 5 °C et 1 cm ↔ 1 min).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
32Interpréter directement un relevé de températures.
On a refroidi un liquide à l'aide d'un mélange réfrigérant tout en relevant régulièrement sa température. Justifie toutes tes réponses à l'aide du tableau de valeurs.
1. Que s'est-il passé ?
2. S'agit-il d'un corps pur ou d'un mélange ?
3. D'après le cours, quelle est la substance étudiée ?
4. À quel instant a débuté la transformation ?
5. Combien de temps a-t-elle durée ?
6. Dans quel état physique se trouve la substance au bout de quatre minutes ?
| Temps (en min) | Température (en °C) |
| 0 | 20,0 |
| 0,5 | 4,9 |
| 1 | 0,0 |
| 1,5 | 0,0 |
| 2 | 0,0 |
| 2,5 | 0,0 |
| 3 | -0,5 |
| 3,5 | -4,1 |
| 4 | -6,1 |
| 4,5 | -6,9 |
1. Que s'est-il passé ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
33Température de fusion : un critère de pureté.
En chimie, il existe plusieurs critères permettant d'établir la pureté ou non d'une substance solide. L'un d'eux est sa température de fusion. En effet, s'il s'agit d'un mélange, sa température de fusion sera plus faible que la température du corps pur attendu.Pour déterminer cette température, on utilise un banc Kofler. C'est une plaque dont la température augmente progressivement d'une de ses extrémités à l'autre. On dépose alors un peu de la poudre obtenue sur la partie la plus froide de la plaque, puis on la pousse petit à petit vers la partie plus chaude. Dès qu'il y a fusion, on repère la température correspondante à l'aide d'un curseur.On réalise la transformation d'acide maléique en acide fumarique. La température de fusion du solide obtenu à l'aide du banc Kofler est 253 °C. Températures de fusion : - Acide maléique : 130 °C ; - Acide fumarique : 286 °C.


1. Le solide obtenu correspond-il à de l'acide fumarique pur ? Justifie ta réponse.


1. Le solide obtenu correspond-il à de l'acide fumarique pur ? Justifie ta réponse.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
34Un changement d'état avantageux.
Le gaz naturel est essentiellement composé de méthane. Il joue aujourd'hui un rôle majeur en tant que ressource énergétique. Le gaz naturel est extrait de gisements. Il est ensuite transporté vers les pays consommateurs. L'un des moyens utilisés est le bateau. Ces navires figurent parmi les plus chers au monde car ils doivent permettre de transporter le méthane à l'état liquide. Sa température doit être maintenue à -162 °C pendant toute la traversée. Le méthane passe ensuite à nouveau à l'état gazeux pour être distribué et utilisé.


1. D'après le cours, quelle grandeur physique change lors d'un changement d'état ?
2. Lors de la liquéfaction du méthane, cette grandeur voit-elle sa valeur augmenter ou diminuer ?
3. En déduire l'intérêt de liquéfier le méthane pour le transporter, en prenant en compte le coût de cette transformation.


1. D'après le cours, quelle grandeur physique change lors d'un changement d'état ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
35Tout est une histoire de particules.
On dépose un glaçon dans un bécher. On place le bécher sur une plaque chauffante que l'on allume. On éteint la plaque chauffante lorsqu'il ne reste presque plus d'eau dans le bécher.
1. Que va-t-il se passer pour l'eau contenue dans le glaçon ?
2. Dessine l'allure de la courbe représentant la température de l'eau en fonction du temps obtenue lors de ce chauffage.
3. Décris ce qu'il se passe au niveau des particules pour chaque partie de la courbe.
1. Que va-t-il se passer pour l'eau contenue dans le glaçon ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
36Comment obtenir rapidement de la vapeur ?
On verse de l'eau dans une casserole que l'on dépose sur le rebord de la fenêtre. Au bout d'une journée, suivant l'ensoleillement et la présence de vent ou non, le niveau de l'eau aura baissé. Cela s'accentuera les jours suivants. L'eau va en effet s'évaporer progressivement, passant à l'état gazeux au niveau de la surface de contact entre l'eau et l'air ambiant. Donc, plus la surface de la casserole sera grande, plus l'évaporation sera rapide.Si on souhaite obtenir le même résultat plus rapidement, il suffit de faire chauffer la casserole. Au bout d'un moment, des bulles de gaz vont se former de façon régulière au sein du liquide et son niveau va baisser rapidement. Il s'agit d'une ébullition car des bulles de vapeur d'eau se forment dans l'ensemble du volume du liquide.
1. D'après le cours, quel est le nom utilisé pour désigner le changement d'état dont il est question ici regroupant ébullition et évaporation ?
1. D'après le cours, quel est le nom utilisé pour désigner le changement d'état dont il est question ici regroupant ébullition et évaporation ?
2. À l'aide du texte ci-dessus, pourquoi dit-on que l'évaporation est un phénomène surfacique et l'ébullition un phénomène volumique ?
3. Qu'est-ce que cela implique pour la vitesse relative de ces deux phénomènes ?
4. À l'aide du texte ci-dessus, cite trois paramètres qui influencent la vitesse de l'évaporation.
5. D'après toi, quel paramètre pourrait-on varier afin de changer la vitesse de l'ébullition ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
37Tout est une question de vocabulaire.
Julien décrit à Cassiopée l'expérience qu'il a réalisée : « J'ai fait chauffer de l'eau dans une casserole et j'ai mesuré sa température à l'aide d'un tempéromètre. Lorsque l'eau bullait, j'ai observé un plateau de température. J'ai ensuite placé un couvercle dessus et il y a eu immédiatement liquidation de la vapeur. »
1. Julien n'a pas encore travaillé sur les changements d'état en physique chimie. Il a fait quatre erreurs dans les mots qu'il a employés. Recopie sa description en les remplaçant par les termes appropriés.
1. Julien n'a pas encore travaillé sur les changements d'état en physique chimie. Il a fait quatre erreurs dans les mots qu'il a employés. Recopie sa description en les remplaçant par les termes appropriés.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
38Transferts d'énergie et changements d'états.
Pour qu'une substance change d'état, un transfert d'énergie doit avoir lieu.Indiquer pour chaque situation présentée le nom du changement d'état qui a lieu, de quel état physique vers quel autre état l'eau passe-t-elle et si de l'énergie est transférée à l'eau ou bien si elle transfère une partie de son énergie à l'environnement alentour.
1. On place un bac à glaçons rempli d'eau liquide au congélateur.
2. On sort des glaçons du congélateur.
3. On fait bouillir de l'eau.
4. On prend une douche. De la buée se forme sur la paroi en verre.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
39Des températures à connaître.
On réalise des changements d'état à Marseille, une ville qui se situe au niveau de la mer.
1. Quelle est la température d'ébullition de l'eau ?
2. Quelle est la température de solidification de l'eau ?
3. Quelle est la température de fusion de l'eau ?
1. Quelle est la température d'ébullition de l'eau ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
40À chaque altitude sa pression atmosphérique et sa température d'ébullition.
Matthieu relève la valeur de la pression atmosphérique à différentes altitudes. Mais il n'a pas bien pris en note ses résultats et ne sait plus quelle valeur de pression correspond à quelle altitude.
1. Complète le tableau ci-dessus en associant chaque valeur de pression atmosphérique proposée à l'altitude correspondante.
2. Quelle est la température d'ébullition de l'eau au niveau de la mer (altitude = 0 m) ?
3. Décris l'évolution de la température d'ébullition en fonction de celle de la pression atmosphérique avec l'altitude.
1. Complète le tableau ci-dessus en associant chaque valeur de pression atmosphérique proposée à l'altitude correspondante.
| Pression atmosphérique (en hPa) | 1013 | 411 | 701 |
| Altitude (en m) |
2. Quelle est la température d'ébullition de l'eau au niveau de la mer (altitude = 0 m) ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
41La lyophilisation.
Le café en poudre doit permettre d'obtenir une tasse de café par simple ajout d'eau chaude.Pour cela, on congèle du café concentré (beaucoup de café avec un peu d'eau) à - 40 °C. On place ce café congelé dans un système hermétique dans lequel on retire l'air. La pression exercée sur le café devient si faible que lorsque l'on réchauffe l'eau contenue dans le café concentré, elle passe alors directement de l'état solide à l'état gazeux à 0 °C, c'est la sublimation. Les granulés de café ne contiennent ainsi pratiquement plus d'eau, on dit qu'ils sont lyophilisés. Cette technique permet de conserver l'aspect, les propriétés gustatives et le volume du café initial.
1. Avant de placer le café concentré dans le système hermétique, quel changement d'état lui fait-on subir ?
2. Observe-t-on un palier de température lors de ce changement d'état ? Pourquoi ?
3. Nomme le changement d'état qui se produit dans le système hermétique et précise de quel état physique vers quel autre il permet le passage.
4. À quelle température l'ébullition de l'eau se produit-elle dans les conditions normales de température et de pression (25 °C et 1013 hPa) ?
5. Quel changement d'état de l'eau se produit à 0 °C dans les conditions normales de température et de pression (25 °C et 1013 hPa) ?
6. Quelle grandeur a-t-on modifié pour permettre la formation de vapeur d'eau à 0 °C ?
7. L'utilisation d'une pression beaucoup plus faible que 1013 hPa permet d'éviter à l'eau de passer par un état physique. Lequel ?
8. D'après le texte, quel est l'intérêt d'une lyophilisation ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
42Utilisation des changements d'état au laboratoire.
L'anhydride phtalique est un composé très utile en chimie. Il permet de réaliser des plastiques, des résines et des colorants entre autres.Pour l'obtenir en laboratoire, on dépose de l'acide phtalique dans un bécher. On recouvre le bécher d'un verre de montre dans lequel on dépose de la glace. On fait chauffer ensuite le bécher.L'acide phtalique se déshydrate alors. L'anhydride phtalique ainsi formé passe immédiatement de l'état solide à l'état gazeux, il s'agit d'une sublimation. La vapeur atteint le verre de montre maintenu froid grâce à la glace, et l'anhydride repasse à l'état solide sous forme de cristaux, il s'agit dans ce cas d'une condensation solide.
1. Nomme les deux changements d'état indiqués dans le texte et précise de quel état physique à quel autre état ils permettent le passage.
2. L'acide phtalique et l'anhydride phtalique existent tous les deux dans les conditions ambiantes sous forme de cristaux solides blancs. Pour pouvoir les distinguer, on utilise alors un banc Kofler qui permet un chauffage très progressif (de 2 °C en 2 °C) d'une extrémité à l'autre du banc.Quel changement d'état intervenant à 130 °C pour l'un et à 210 °C pour l'autre utilise-t-on ici pour pouvoir les reconnaître ?
1. Nomme les deux changements d'état indiqués dans le texte et précise de quel état physique à quel autre état ils permettent le passage.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Parcours de compétences
Compétence : Écrire des phrases claires, sans faute, en utilisant le vocabulaire adapté.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Lou explique : « Quand je refroidis de l'eau, elle se fige et prend du temps pour devenir solide. »
Lou utilise son propre vocabulaire ; reformule clairement ses propos avec le vocabulaire adapté.
Lou utilise son propre vocabulaire ; reformule clairement ses propos avec le vocabulaire adapté.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 1
J'utilise du vocabulaire scientifique dans mes réponses écrites.
Coup de pouce
Repère dans l'énoncé les mots de vocabulaire étudiés dans ce chapitre.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 2
J'écris des phrases complètes en utilisant du vocabulaire scientifique.
Coup de pouce
Définis par une phrase simple les mots reconnus précédemment.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 3
Je fais des phrases complètes qui respectent les règles simples de grammaire et d'orthographe, en utilisant le vocabulaire scientifique.
Coup de pouce
Reformule chaque expression approximative ou erronée de Lou en utilisant le vocabulaire du cours.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 4
Je fais des phrases précises, claires et sans fautes, en utilisant un vocabulaire scientifique adapté.
Coup de pouce
Reformule cette explication avec le vocabulaire adapté.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille


