Chapitre 2
Exercices
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je me teste
Je sais
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Un cation a :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Un cation est :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Un anion a :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
4Un anion est :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5Une solution est acide :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6Complète la grille de mots-croisés.
Vertical :
1. Ion positif.
2. Ion négatif.
3. Suspension solide issue d'un test pour identifier les ions.
4. Solution dont le pH est inférieur à 7.
1. Ion positif.
2. Ion négatif.
3. Suspension solide issue d'un test pour identifier les ions.
4. Solution dont le pH est inférieur à 7.
Horizontal :
5. Sert à indiquer l'acidité d'une solution.
6. Lorsqu'un atome gagne un électron, il devient un ion…
7. Atome ou groupe d'atomes ayant gagné ou perdu des électrons.
8. Lorsqu'un atome perd un électron, il devient un ion…
5. Sert à indiquer l'acidité d'une solution.
6. Lorsqu'un atome gagne un électron, il devient un ion…
7. Atome ou groupe d'atomes ayant gagné ou perdu des électrons.
8. Lorsqu'un atome perd un électron, il devient un ion…
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je sais faire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7Lors du test de précipitation des ions par la soude, il y a des ions cuivre si :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8Lorsque le test au nitrate d'argent donne un précipité blanc, cela prouve la présence :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9Lors du test de précipitation des ions par la soude, il y a des ions zinc si :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10Il y a une proportion élevée d'ions hydrogène si :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercice corrigé
Compétence : Interpréter des résultats.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11Composition d'un solide inconnu.
Un corps pur ionique inconnu a été dissout dans de l'eau distillée. On teste ensuite la solution obtenue. Lors de l'ajout de soude, il se forme un précipité blanc. Lors de l'ajout de nitrate d'argent, il se forme un précipité blanc.
1. Quel cation est présent dans la solution ? Combien a-t-il gagné ou perdu d'électrons ?
1. Quel cation est présent dans la solution ? Combien a-t-il gagné ou perdu d'électrons ?
2. Quel anion est présent dans la solution ? Combien a-t-il gagné ou perdu d'électrons ?
3. Quelle est la formule de la solution ionique ?
3. Quelle est la formule de la solution ionique ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Étapes de la méthode
- La couleur du précipité obtenu lors du test à la soude permet d'identifier l'ion métallique présent :
- précipité bleu : ion cuivre Cu2+ ;
- précipité vert : ion ferreux Fe2+ ;
- précipité blanc : ion zinc Zn2+ ;
- précipité rouille : ion ferrique Fe3+.
- La formule de l'ion indique, selon le signe en exposant, le nombre d'électrons gagnés ou perdus pour obtenir cet ion.
- Dans la formule d'une solution ionique, il faut autant de charges positives que de charges négatives : la somme des produits des coefficients des ions, multipliés par leurs charges, doit donner zéro.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Corrigé
1. La solution contient des ions zinc Zn2+, ils sont responsables du précipité blanc lors de l'ajout de soude. Ils proviennent de la perte de deux électrons de l'atome de zinc.
2. La solution contient des ions chlorure Cl−, ils sont responsables du précipité blanc lors de l'ajout de nitrate d'argent. Ils proviennent du gain d'un électron de l'atome de chlore.
3. La solution ionique a pour composition : (Zn2+ + 2 Cl−).
2. La solution contient des ions chlorure Cl−, ils sont responsables du précipité blanc lors de l'ajout de nitrate d'argent. Ils proviennent du gain d'un électron de l'atome de chlore.
3. La solution ionique a pour composition : (Zn2+ + 2 Cl−).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercice similaire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12On teste la solution d'un corps pur ionique de composition inconnue.
Lors de l'ajout de soude, il se forme un précipité bleu.
Lors de l'ajout de nitrate d'argent, il se forme un précipité blanc.
Lors de l'ajout de nitrate d'argent, il se forme un précipité blanc.
1. Quel cation est présent dans la solution ? Combien a-t-il gagné ou perdu d'électrons ?
2. Quel anion est présent dans la solution ? Combien a-t-il gagné ou perdu d'électrons ?
3. Quelle est la formule de la solution ionique ?
2. Quel anion est présent dans la solution ? Combien a-t-il gagné ou perdu d'électrons ?
3. Quelle est la formule de la solution ionique ?


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je m'entraine
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13La formule des ions.
1. Donne la formule des ions suivants :
- ion zinc II :
- ion chlorure :
- ion fer III :
- ion cuivre II :
- ion hydrogène :
- ion hydroxyde :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14La formation des ions.
Soient les ions suivants :
- ion cuivre Cu2+
- ion fer III Fe3+
- ion fluorure F−
- ion sulfure S2−
1. Combien d'électrons ces ions ont-ils gagné ou perdu ?
2. Écris pour chacun d'eux s'il s'agit d'un cation ou d'un anion.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15Les ions hydrogène et le pH.
On mesure le pH de différentes solutions à l'aide d'un pH-mètre.
Le pH du vinaigre est de 2,4, celui de l'eau minérale de 7,0 et enfin celle de l'eau savonneuse de 9,0.
1. Quelle est la solution la plus acide ?
2. Quelle solution possède le plus d'ions hydrogène ?
3. Quelle est la solution la plus basique ?
4. Quelle est la solution qui possède le plus d'ions hydroxyde ?
Le pH du vinaigre est de 2,4, celui de l'eau minérale de 7,0 et enfin celle de l'eau savonneuse de 9,0.
1. Quelle est la solution la plus acide ?
2. Quelle solution possède le plus d'ions hydrogène ?
3. Quelle est la solution la plus basique ?
4. Quelle est la solution qui possède le plus d'ions hydroxyde ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16Tests de précipitation.
Compétence
Interpréter des résultats.
On a versé quelques gouttes de soude dans trois tubes à essai contenant trois solutions inconnues.
1. Donne la définition d'un précipité.
2. Pour chaque tube, quel est l'ion mis en évidence ?


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Différentes solutions à classer.
Compétence
Interpréter des résultats.
Voici des produits de la vie courante. On a testé leur pH à l'aide d'un papier pH. Les couleurs obtenues ont été reportées dans le document ci-dessous :


1. Indique pour chacune des solutions si elle est acide, basique ou neutre.
2. En t'aidant des couleurs du papier pH, classe ces substances de la plus acide à la plus basique.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18Le chlore dans la piscine.
Compétence
Concevoir une expérience pour tester une hypothèse.
Le procédé MagnaPoolTM utilise des sels de chlore pour le traitement de l'eau des piscines. Sous quelle forme se trouve ce chlore ?
1. Comment testerais-tu la présence de chlore dans l'eau de la piscine ?
2. Lors de ce test, il se forme un précipité blanc. Que peux-tu déduire de cette observation ?
3. Sous quelle forme se trouve le chlore dans la piscine ?
4. Cette forme est-elle la conséquence d'une perte ou d'un gain d'électrons ?
5. Obtient-on alors des cations ou des anions ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19Acide ou basique ?
1. Trouve les mots correspondant aux lettres.

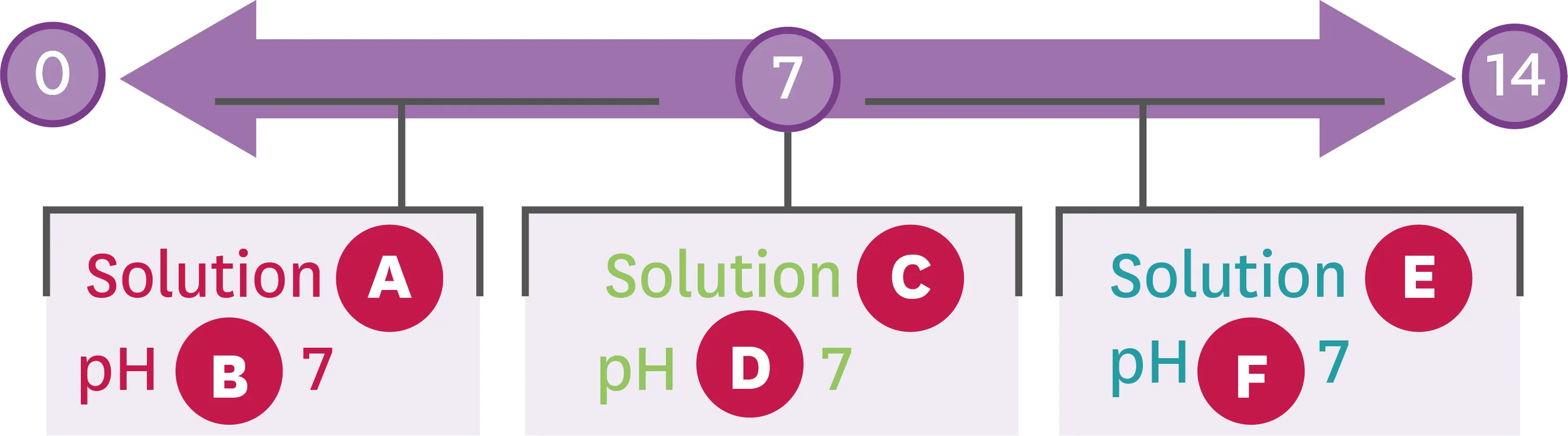


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20La solution ionique.
Le sulfate de potassium est utilisé en jardinage sous forme de granulés mais aussi en solution. La solution contient des ions potassium K+ et des ions sulfates SO42−. Le potassium permet de faciliter la photosynthèse des plantes.
1. Quel est l'ion monoatomique ?
2. Est-ce un cation ou un anion ?
3. Donne la composition atomique de l'autre ion.
4. Est-ce un cation ou un anion ?
5. Donne la formule de la solution de sulfate de potassium.
1. Quel est l'ion monoatomique ?
2. Est-ce un cation ou un anion ?
3. Donne la composition atomique de l'autre ion.
4. Est-ce un cation ou un anion ?
5. Donne la formule de la solution de sulfate de potassium.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21Variations de pH.
On s'intéresse au pH d'une vinaigrette à laquelle on ajoute une cuillère de vinaigre de citron, qui contient dix fois plus d'ions hydrogène que du vinaigre ordinaire.
1. Lorsqu'on ajoute le vinaigre de citron, la proportion d'ions hydrogène dans la vinaigrette augmente-t-elle ou diminue-t-elle
2. Le pH augmente-t-il ou diminue-t-il ?
3. On rajoute un verre d'eau. La proportion d'ions hydrogène présents va-t-elle augmenter ou diminuer ?
4. Le pH augmente-t-il ou diminue-t-il ?
1. Lorsqu'on ajoute le vinaigre de citron, la proportion d'ions hydrogène dans la vinaigrette augmente-t-elle ou diminue-t-elle
2. Le pH augmente-t-il ou diminue-t-il ?
3. On rajoute un verre d'eau. La proportion d'ions hydrogène présents va-t-elle augmenter ou diminuer ?
4. Le pH augmente-t-il ou diminue-t-il ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices Différenciation
Compétence : Interpréter des résultats.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22-AIdentification des ions. Un cristal bleu inconnu.
Pour cet exercice, tu peux te servir du tableau des résultats des tests d'ions de l'activité 2 .
On dispose d'un cristal de composition inconnue. Pour l'identifier, on le dissout dans l'eau afin de déterminer sa composition en effectuant des tests. Un précipité blanc qui noircit à la lumière apparait à l'ajout de nitrate d'argent. Un précipité bleu apparait à l'ajout de soude.
On dispose d'un cristal de composition inconnue. Pour l'identifier, on le dissout dans l'eau afin de déterminer sa composition en effectuant des tests. Un précipité blanc qui noircit à la lumière apparait à l'ajout de nitrate d'argent. Un précipité bleu apparait à l'ajout de soude.
1. Quel ion est mis en évidence par le test au nitrate d'argent ?
2. Quel ion est mis en évidence par le test à la soude ?
3. Indique d'où proviennent les ions détectés dans la solution.
2. Quel ion est mis en évidence par le test à la soude ?
3. Indique d'où proviennent les ions détectés dans la solution.
4. Donne la composition du cristal d'après tes réponses précédentes.




Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22-BIdentification des ions. Des tests de présence d'ion.
Pour cet exercice, tu peux te servir du tableau des résultats des tests d'ions de l'activité 2 .
On dispose d'une solution contenant des ions Fe2+ et des ions Cl−. On réalise un test au nitrate d'argent et un test à la soude sur cette solution.
1. Prévois le résultat du test au nitrate d'argent.
2. Prévois le résultat du test à la soude.
3. Sachant qu'un test au papier pH donne une valeur d'environ 3, indique si cette solution est basique ou acide, et déduis-en l'ion mis en évidence.
On dispose d'une solution contenant des ions Fe2+ et des ions Cl−. On réalise un test au nitrate d'argent et un test à la soude sur cette solution.
1. Prévois le résultat du test au nitrate d'argent.
2. Prévois le résultat du test à la soude.
3. Sachant qu'un test au papier pH donne une valeur d'environ 3, indique si cette solution est basique ou acide, et déduis-en l'ion mis en évidence.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22-CIdentification des ions. L'acide chlorhydrique.
Pour cet exercice, tu peux te servir du tableau des résultats des tests d'ions de l'activité 2 .
L'acide chlorhydrique est le principal constituant des acides présents dans l'estomac. Il participe à la digestion. On se propose de déterminer sa composition en effectuant des tests. Un premier test permet d'obtenir un précipité blanc qui noircit à la lumière. De plus, le papier pH indique une valeur de 1,5.
1. Donne la formule de l'acide chlorhydrique en expliquant les résultats obtenus d'après les tests.
L'acide chlorhydrique est le principal constituant des acides présents dans l'estomac. Il participe à la digestion. On se propose de déterminer sa composition en effectuant des tests. Un premier test permet d'obtenir un précipité blanc qui noircit à la lumière. De plus, le papier pH indique une valeur de 1,5.
1. Donne la formule de l'acide chlorhydrique en expliquant les résultats obtenus d'après les tests.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
J'approfondis
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23Le sulfate de cuivre anhydre.
Le sulfate de cuivre anhydre est utilisé pour détecter l'eau. En solution, il forme des ions sulfate SO42− et des ions cuivre Cu2+.
1. De quelle couleur est le sulfate de cuivre anhydre ?
2. Quelle couleur prend-il dans l'eau ?
3. Quel est l'ion responsable de cette couleur ?
4. Quel test permet de mieux mettre en évidence cet ion ?
5. De quoi est constitué l'ion sulfate ?
6. Donne la formule de la solution de sulfate de cuivre.
1. De quelle couleur est le sulfate de cuivre anhydre ?
2. Quelle couleur prend-il dans l'eau ?
3. Quel est l'ion responsable de cette couleur ?
4. Quel test permet de mieux mettre en évidence cet ion ?
5. De quoi est constitué l'ion sulfate ?
6. Donne la formule de la solution de sulfate de cuivre.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24Chez le dentiste.
Compétence
Interpréter des résultats.
Le chlorure de zinc est utilisé pour les soudures des prothèses dentaires. Après dissolution dans l'eau, il a été testé à la soude (expérience a) et au nitrate d'argent (expérience b).
1. Sur la photo de l'expérience a, qu'observes-tu ? Quel ion a été détecté ?
2. S'agit-il d'un cation ou d'un anion ?
3. Sur la photo de l'expérience b, qu'observes-tu ? Quel ion a été détecté ?
4. S'agit-il d'un cation ou d'un anion ?
5. Donne la formule d'une solution de chlorure de zinc.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25Les solutions inconnues.
Deux flacons ont perdu leur étiquette. L'un contient de l'acide sulfurique dilué et l'autre de la soude diluée.
1. Que peux-tu faire pour distinguer les deux solutions ?
1. Que peux-tu faire pour distinguer les deux solutions ?
2. Propose un protocole et schématise l'expérience.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26Quelques ions monoatomiques.
Compétence
Produire et transformer des tableaux ou des documents graphiques.
1. Complète le tableau suivant.
| Ion | Ion cuivre | Ion ferrique | Ion chlorure | Ion bromure |
| Symbole | Fe3+ | Br- | ||
| Nombre de protons | 29 | 17 | ||
| Nombre d'électrons | 36 | |||
| Charge électrique globale | Positif | |||
| Cation ou anion ? | Anion |
2. Indique pour chacun des ions du tableau s'il a été obtenu après un gain ou une perte d'électrons en précisant le nombre d'électrons concernés.
3. Indique parmi les ions du tableau ceux pour lesquels tu connais le test d'identification en décrivant ce dernier ainsi que son résultat positif.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27Le jus de citron.
Un élève presse un citron afin d'en recueillir le jus. Il prépare ainsi trois solutions dans trois béchers :
1. Classe les solutions des béchers de la plus acide à la moins acide.
2. Comment évolue le pH quand on rajoute de l'eau ?
3. Le pH pourra-t-il atteindre la valeur de 14 si on ajoute encore plus d'eau ? Explique ta réponse.
- le bécher n° 1 contient 5 mL de jus de citron ;
- le bécher n° 2 contient 5 mL de jus de citron + 10 mL d'eau ;
- le bécher n° 3 contient 5 mL de jus de citron + 100 mL d'eau.
- 2 pour le bécher n° 1 ;
- 2,5 pour le bécher n° 2 ;
- 3 pour le bécher n° 3.
1. Classe les solutions des béchers de la plus acide à la moins acide.
2. Comment évolue le pH quand on rajoute de l'eau ?
3. Le pH pourra-t-il atteindre la valeur de 14 si on ajoute encore plus d'eau ? Explique ta réponse.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
28Batterie de voiture.
Compétence
Agir de façon responsable, respecter les règles de sécurité.
Les batteries au plomb utilisent une réaction chimique avec l'acide sulfurique pour accumuler et restituer l'énergie. Les batteries doivent donc être remplies d'acide pour fonctionner. Le pictogramme suivant se trouve sur une bouteille d'acide sulfurique.

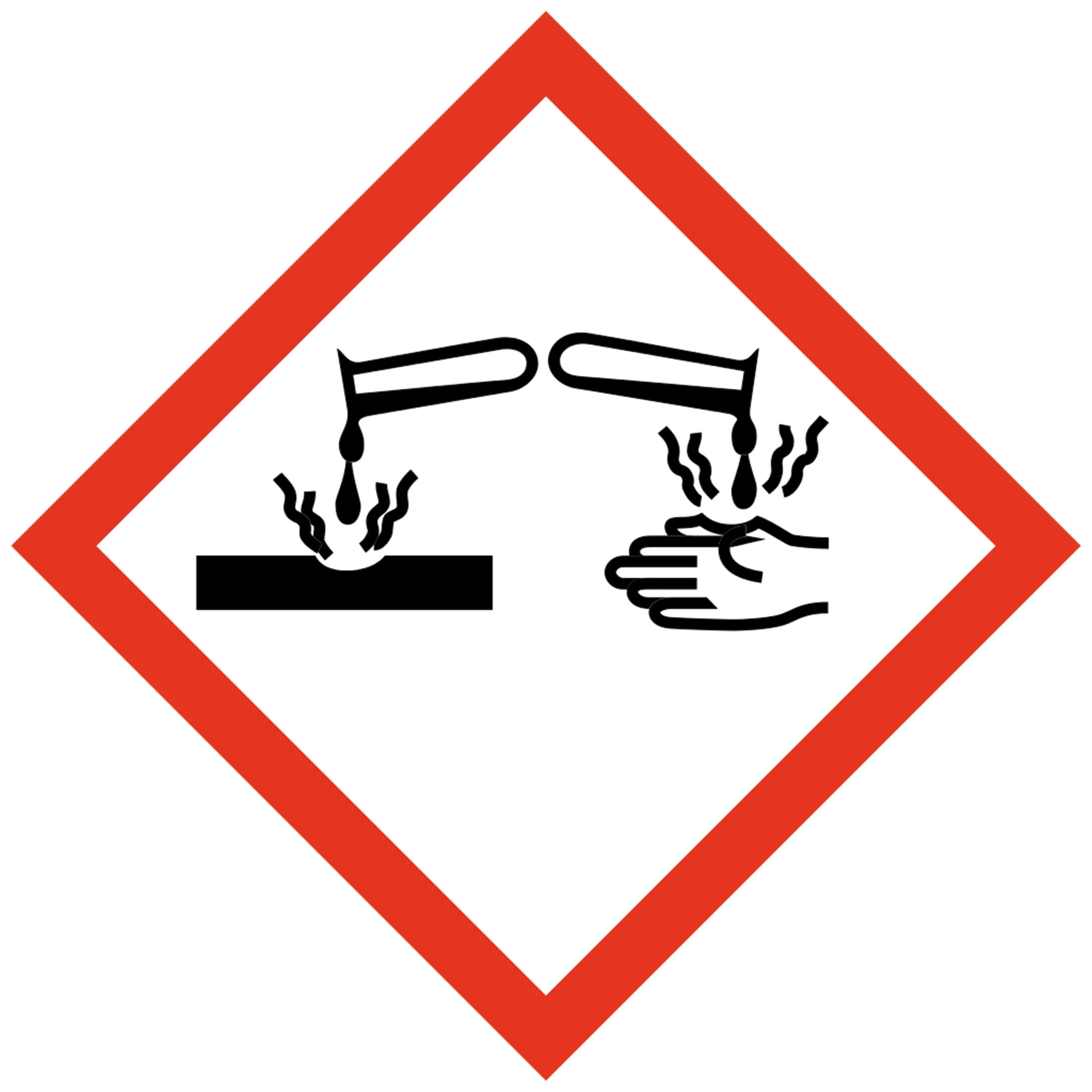
1. Que signifie le pictogramme ci-dessus ?
2. Le pH de l'acide sulfurique est-il supérieur, égal ou inférieur à 7 ?
3. Outre les ions sulfate, quel est l'ion majoritairement présent dans l'acide sulfurique ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
29L'ion sulfure.
L'atome de soufre est présent en quantité importante à proximité des volcans. Il possède 16 électrons. L'atome de soufre donne l'ion sulfure S2− qu'on étudiera ici.


1. L'ion sulfure est-il issu de la perte ou du gain d'électrons par l'atome de soufre ?
2. Combien d'électrons ont été perdus ou gagnés ?
3. Dessine l'ion sulfure selon le modèle de l'atome de soufre en précisant le nombre de protons et d'électrons.


1. L'ion sulfure est-il issu de la perte ou du gain d'électrons par l'atome de soufre ?
2. Combien d'électrons ont été perdus ou gagnés ?
3. Dessine l'ion sulfure selon le modèle de l'atome de soufre en précisant le nombre de protons et d'électrons.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30L'ion fluorure.
L'atome de fluor a 9 charges positives dans son noyau.
1. Schématise l'atome de fluor en mettant le bon nombre d'électrons.
2. L'atome de fluor est-il négatif, neutre ou positif ?
3. L'atome de fluor gagne un électron pour devenir l'ion fluorure. Cet ion est-il négatif, neutre ou positif ?
4. Est-ce un cation ou un anion ?
1. Schématise l'atome de fluor en mettant le bon nombre d'électrons.
2. L'atome de fluor est-il négatif, neutre ou positif ?
3. L'atome de fluor gagne un électron pour devenir l'ion fluorure. Cet ion est-il négatif, neutre ou positif ?
4. Est-ce un cation ou un anion ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31Les pluies acides.
L'expression « pluies acides » désigne des précipitations atmosphériques anormalement acides. Elles proviennent de la réaction de gaz qui se dissolvent dans l'eau et forment des composés acides. Par exemple, les oxydes d'azote peuvent former de l'acide nitrique HNO3.
1. Que peux-tu dire du pH de ces pluies ?
2. Quel est l'ion responsable de cette acidité dans l'acide nitrique ?
3. Déduis-en la formule de l'autre ion.
1. Que peux-tu dire du pH de ces pluies ?
2. Quel est l'ion responsable de cette acidité dans l'acide nitrique ?
3. Déduis-en la formule de l'autre ion.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
32L'antimousse.
Le sulfate de fer II est utilisé dans le jardinage comme antimousse. On se propose de le diluer dans l'eau et d'ajouter quelques gouttes de soude. Il apparait alors un précipité.
1. Donne la composition du sulfate de fer II.
2. Quelle est la couleur du précipité ?
3. Lorsqu'on laisse la solution de sulfate de fer II à l'air libre pendant plusieurs jours et qu'on refait le test de la soude, il apparait un précipité rouille. Quel ion est ainsi caractérisé ?
1. Donne la composition du sulfate de fer II.
2. Quelle est la couleur du précipité ?
3. Lorsqu'on laisse la solution de sulfate de fer II à l'air libre pendant plusieurs jours et qu'on refait le test de la soude, il apparait un précipité rouille. Quel ion est ainsi caractérisé ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
33L'alcootest.
Les cristaux contenus dans les alcootests contiennent des ions dichromate Cr2O72− de couleur jaune.
En présence d'alcool, ils se transforment en ions chromate Cr3+ de couleur verte.
1. Quelle est la composition de l'ion dichromate ? A-t-il perdu ou gagné des électrons ? Combien d'électrons a-t-il gagnés ou perdus ?
En présence d'alcool, ils se transforment en ions chromate Cr3+ de couleur verte.
1. Quelle est la composition de l'ion dichromate ? A-t-il perdu ou gagné des électrons ? Combien d'électrons a-t-il gagnés ou perdus ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je résous un problème
Compétence : Interpréter des résultats.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Quels sont les ions contenus dans l'acide sulfurique ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Quelques tests de présence d'ions.
| Test | Ion ou molécule testée(e) | Observation |
| Test au sulfate de cuivre anhydre | Eau | Le sulfate de cuivre anhydre blanc devient bleu |
| Test à l'eau de chaux | Dioxyde de carbone | Trouble de l'eau de chaux |
| Test à la flamme | Dihydrogène | Détonation |
| Test à la buchette incandescente | Dioxygène | La buchette incandescente se ré-enflamme |
| Test à la soude | Ion cuivre II (Cu2+) | Précipité bleu |
| Ion zinc II (Zn2+) | Précipité blanc | |
| Ion fer II (Fe2+) | Précipité verdâtre | |
| Ion fer III (Fe3+) | Précipité rouille | |
| Ion aluminium III (Al3+) | Précipité blanc | |
| Test au nitrate d'argent | Ion chlorure Cl- | Précipité blanc qui noircit à la lumière |
| Test au chlorure de baryum | Ion sulfate SO42- | Précipité blanc |
| Mesure du pH | Ion H+ | pH < 7 |
| Mesure du pH | Ion HO- | pH > 7 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Le lac acide de Kamtchatka, en Russie.


Un lac acide est un lac de cratère dans lequel le volcan rejette des gaz volcaniques. Ces gaz se dissolvent et forment de l'acide sulfurique en solution. Le pH de ces lacs est inférieur à 1. Le test au chlorure de baryum sur un prélèvement fait apparaitre un précipité blanc.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercices supplémentaires
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
34L'ion hydrogène.
L'ion hydrogène H+ a pour numéro atomique 1 et nombre de masse 1. Il est responsable de l'acidité d'une solution.
1. Combien a-t-il de protons ?
2. Combien a-t-il de neutrons ?
3. L'ion hydrogène a-t-il gagné ou perdu des électrons ?
4. Lorsque le pH augmente, la concentration d'ions augmente-t-elle ou diminue-t-elle ?
1. Combien a-t-il de protons ?
2. Combien a-t-il de neutrons ?
3. L'ion hydrogène a-t-il gagné ou perdu des électrons ?
4. Lorsque le pH augmente, la concentration d'ions augmente-t-elle ou diminue-t-elle ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
35Rédiger un compte rendu.
On réalise un test sur une solution ionique de composition inconnue.
Au test à la soude, il apparait un précipité vert et au test au nitrate d'argent, il apparait un précipité blanc.
1. Sous la forme suivante, tu donneras la composition de cette solution : J'observe que… Sachant que… J'en déduis que... .
Au test à la soude, il apparait un précipité vert et au test au nitrate d'argent, il apparait un précipité blanc.
1. Sous la forme suivante, tu donneras la composition de cette solution : J'observe que… Sachant que… J'en déduis que... .
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
36Le pH-mètre.
Voici le pH de différentes solutions :
- Vinaigre : 4,8 ;
- Eau distillée (pure) : 7 ;
- Eau de mer : 8 ;
- Eau de Javel : 12,5 ;
- Soude : 13,5.
1. Indique pour chaque solution si elle est acide, neutre ou basique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Parcours de compétences
Compétence : Identifier le problème à résoudre.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Éric remarque une tache humide sur le carrelage où se trouvent le déboucheur d'évier (une solution basique concentrée) et un autre détergent contenant un acide. Il veut la nettoyer avec l'acide chlorhydrique concentré qu'il utilise habituellement pour détacher les carreaux, en respectant les consignes de sécurité.
Informations : Plus une solution est concentrée en ions hydrogène H+, plus elle est acide. Plus une solution est concentrée en ions hydroxyde HO-, plus elle est basique. Il est dangereux de mélanger une solution d'acide concentrée avec une solution basique concentrée. Il y a alors des risques de projection.
Quel problème va devoir résoudre Eric s'il veut nettoyer la tache ?
Informations : Plus une solution est concentrée en ions hydrogène H+, plus elle est acide. Plus une solution est concentrée en ions hydroxyde HO-, plus elle est basique. Il est dangereux de mélanger une solution d'acide concentrée avec une solution basique concentrée. Il y a alors des risques de projection.
Quel problème va devoir résoudre Eric s'il veut nettoyer la tache ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 1
Je comprends le contexte scientifique dans la situation proposée.
Coup de pouce
Retrouve dans le texte ce que voudrait faire Éric.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 2
Dans la situation proposée, je repère des éléments qui posent problème.
Coup de pouce
Quelle partie de l'énoncé évoque un problème ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 3
J'identifie et je formule un problème scientifique pertinent.
Coup de pouce
L'acide chlorhydrique peut-il être mélangé avec d'autres liquides en toute sécurité ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 4
Je formule clairement le problème que j'ai identifié pour me permettre de le résoudre.
Coup de pouce
Formule ce problème en insistant sur l'information clé dont Éric doit avoir connaissance.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille


