Chapitre 4
Activité 4 - Activité d'exploration
Ordre de réaction
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Objectif : Identifier si l'évolution d'une concentration suit ou non une loi de vitesse d'ordre 1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
Le sucre de consommation est principalement constitué de saccharose, une
molécule susceptible de se décomposer et de former du glucose et du fructose
en quantité équimolaire.
Quelle équation peut modéliser la vitesse de réaction ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Vitesse volumique de disparition
Une réaction, dont la vitesse ne dépend que de la concentration d'un seul réactif \text{A}(\text{aq}), est dite d'ordre \alpha si la vitesse volumique de disparition de \text{A}(\text{aq}) s'écrit :
De nombreuses réactions de décomposition sont d'ordre 1 (\alpha =1 et k en s-1). La vitesse volumique de disparition de \text{A}(\text{aq}) est alors proportionnelle à sa concentration [\text{A}].
v_A = k \cdot [\text{A}]^\alpha
k : constante de vitesse (SI)
[\text{A}] : concentration en réactif \text{A}(\text{aq}) (mol·L-1)
\alpha : ordre de la réaction
[\text{A}] : concentration en réactif \text{A}(\text{aq}) (mol·L-1)
\alpha : ordre de la réaction
De nombreuses réactions de décomposition sont d'ordre 1 (\alpha =1 et k en s-1). La vitesse volumique de disparition de \text{A}(\text{aq}) est alors proportionnelle à sa concentration [\text{A}].
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
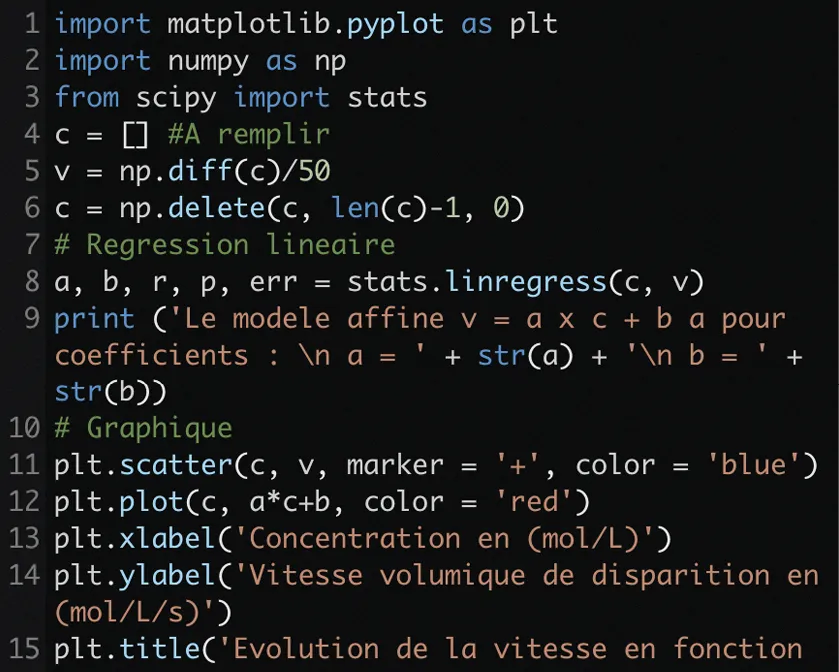
Doc. 3Extrait d'un code Python

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Données expérimentales
Ce tableau présente l'évolution au cours du temps de la concentration en saccharose [\text{C}_{12}\ \text{H}_{22}\ \text{O}_{11}] à 370 K.
La vitesse instantanée v_{\text{i}} de disparition du saccharose peut être calculée pour tous les instants t_{\text{i}} (hormis la dernière) à partir de :
| Temps \bm t (s) | Concentration [\textbf{C}_\bold{12}\ \textbf{H}_\bold{22}\ \textbf{O}_\bold{11}] (mol·L-1) |
|---|---|
| 0 | 5,00 |
| 50 | 4,52 |
| 100 | 4,08 |
| 150 | 3,68 |
| 200 | 3,33 |
| 250 | 3,00 |
| 300 | 2,71 |
| 350 | 2,45 |
| 400 | 2,21 |
| 450 | 2,00 |
| 500 | 1,81 |
La vitesse instantanée v_{\text{i}} de disparition du saccharose peut être calculée pour tous les instants t_{\text{i}} (hormis la dernière) à partir de :
v_\text{i} = - \dfrac{[\text{C}_{12}\ \text{H}_{22} \ \text{O}_{11}]_{\text{i}+1} - [\text{C}_{12}\ \text{H}_{22}\ \text{O}_{11}]_\text{i}}{t_{\text{i}+1} - t_\text{i}}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Cliquer ici pour télécharger et au format .csv, .odt et .xls.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
REA/MATH : Utiliser un langage de programmation
1. Préciser le type de courbe représentant la vitesse de disparition en fonction de la concentration en réactif dans le cas d'une réaction d'ordre 1.
2. Identifier la raison pour laquelle on ne peut pas calculer la dernière vitesse volumique de disparition du saccharose.
3. Expliquer le rôle des lignes 5 et 6 dans le code Python fourni.
4. Compléter le code Python et conclure quant à l'ordre de la réaction étudiée.
import matplotlib.pyplot as plt
import numpy as np
from scipy import stats
c = [] #A remplir
v = np.diff(c)/50
c = np.delete(c, len(c)-1, 0)
# Regression lineaire
a, b, r, p, err = stats.linregress(c, v)
print ('Le modele affine v = a x c + b a pour coefficients : \n a = ' + str(a) + '\n b = ' + str(b))
# Graphique
plt.scatter(c, v, marker = '+', color = 'blue')
plt.plot(c, a*c+b, color = 'red')
plt.xlabel('Concentration en (mol/L)')
plt.ylabel('Vitesse volumique de disparition en (mol/L/s)')
plt.title('Evolution de la vitesse en fonction de la concentration d\'un reactif')
plt.show()
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
Résumer la méthode permettant de déterminer si une réaction est d'ordre 1.
Fermer
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
