Chapitre 4
Bilan
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Compétence : Travailler en autonomie.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Les atomes
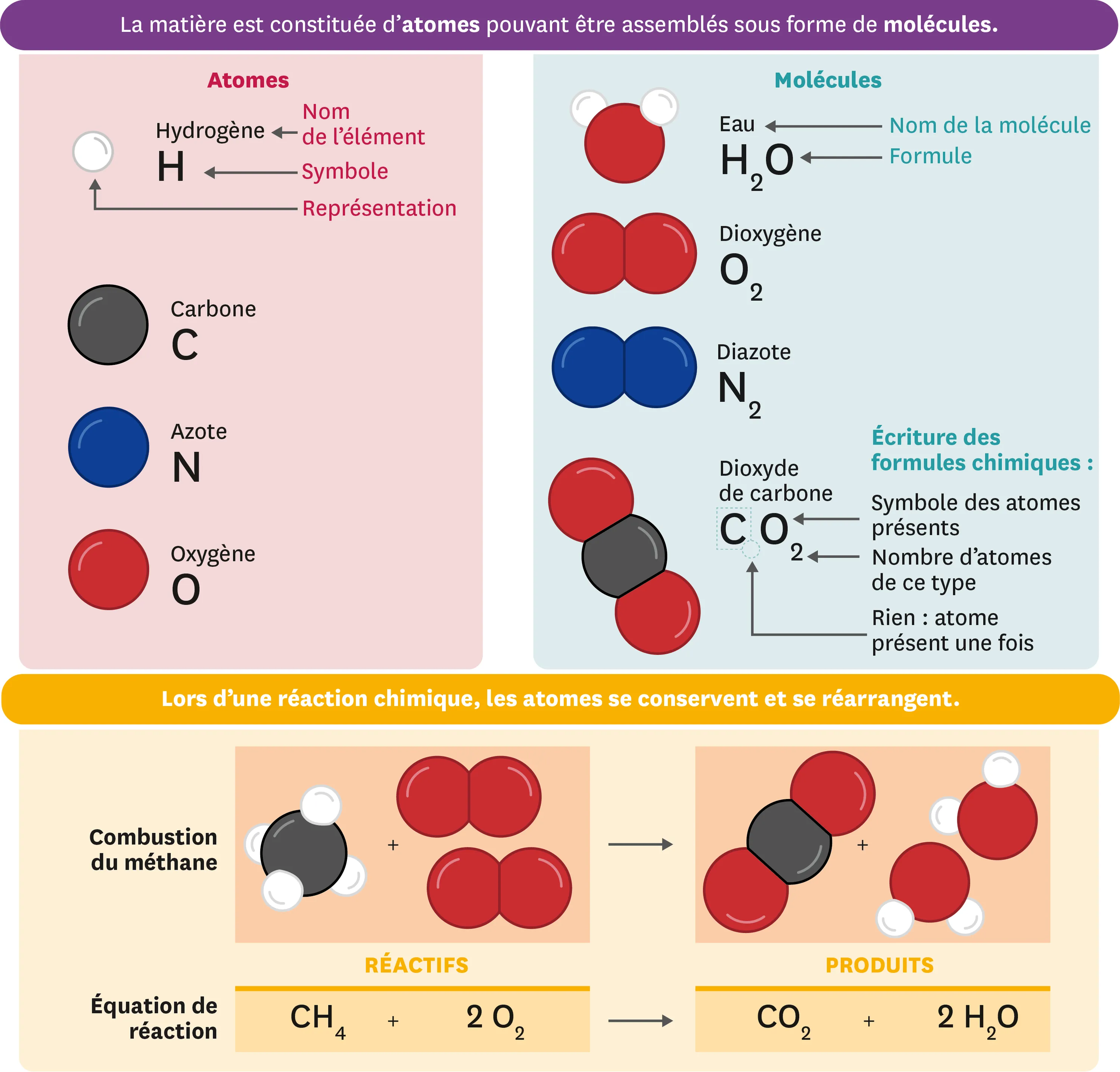
- Les atomes sont les constituants de base des molécules.
- À chaque type d'atome, on associe un symbole chimique : une lettre majuscule éventuellement suivie d'une lettre minuscule.
- Les 118 types d'atomes connus sont rassemblés dans un tableau.
- Décrits de manière simplifiée, les atomes sont de très petites sphères. On utilise souvent des sphères en plastique ou dessinées pour les représenter.
Le saviez-vous ?
Les particules de matière les plus simples s'appellent des atomes et s'assemblent pour former des molécules. Chaque atome possède un nom et un symbole.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Les représentations des molécules
Le saviez-vous ?
La formule chimique d'une molécule indique les atomes dont elle est composée. Les éventuels nombres en indice précisent combien de fois les atomes concernés sont présents.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Interpréter les transformations chimiques
- Au cours d'une transformation chimique, les atomes composant les molécules des réactifs se réarrangent pour former les molécules des produits. Les molécules de réactifs sont donc détruites mais pas leurs atomes.
- Une transformation chimique est modélisée par une réaction chimique, qui ne détaille que l'état initial et l'état final.
- L'équation de la réaction est un bilan dans lequel les molécules sont notées avec leur formule chimique.
Le saviez-vous ?
Une transformation chimique est un réarrangement d'atomes qui entraine la disparition des réactifs en même temps que l'apparition des produits. On symbolise ce processus avec une équation de réaction. Par ex. : C + O2 -> CO2
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
4La conservation des atomes
- Au cours d'une transformation chimique, aucun atome n'est créé ni détruit. On dit qu'il y a conservation des atomes.
- Une équation de réaction équilibrée exprime la conservation des atomes : il y a le même nombre d'atomes dans les réactifs et les produits.
- Dans une équation de réaction équilibrée, on a ajusté le nombre des molécules (réactifs et/ou produits) concernées par la réaction, sans modifier leur formule.
Le saviez-vous ?
Une équation de réaction est équilibrée si elle montre que les atomes sont conservés au cours de la transformation chimique.
Par ex. : CH4 + 2 02 -> CO2 + 2 H20
Par ex. : CH4 + 2 02 -> CO2 + 2 H20
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Un atome : activité 1.
- Une équation de réaction : activité 3 et 4.
- Une équation équilibrée : activité 4.
- Une molécule : activité 1 et 2.
- Une réaction chimique : activité 3.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je retiens par l'image

Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille


