Chapitre 2
Bilan
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Compétence : Travailler en autonomie.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
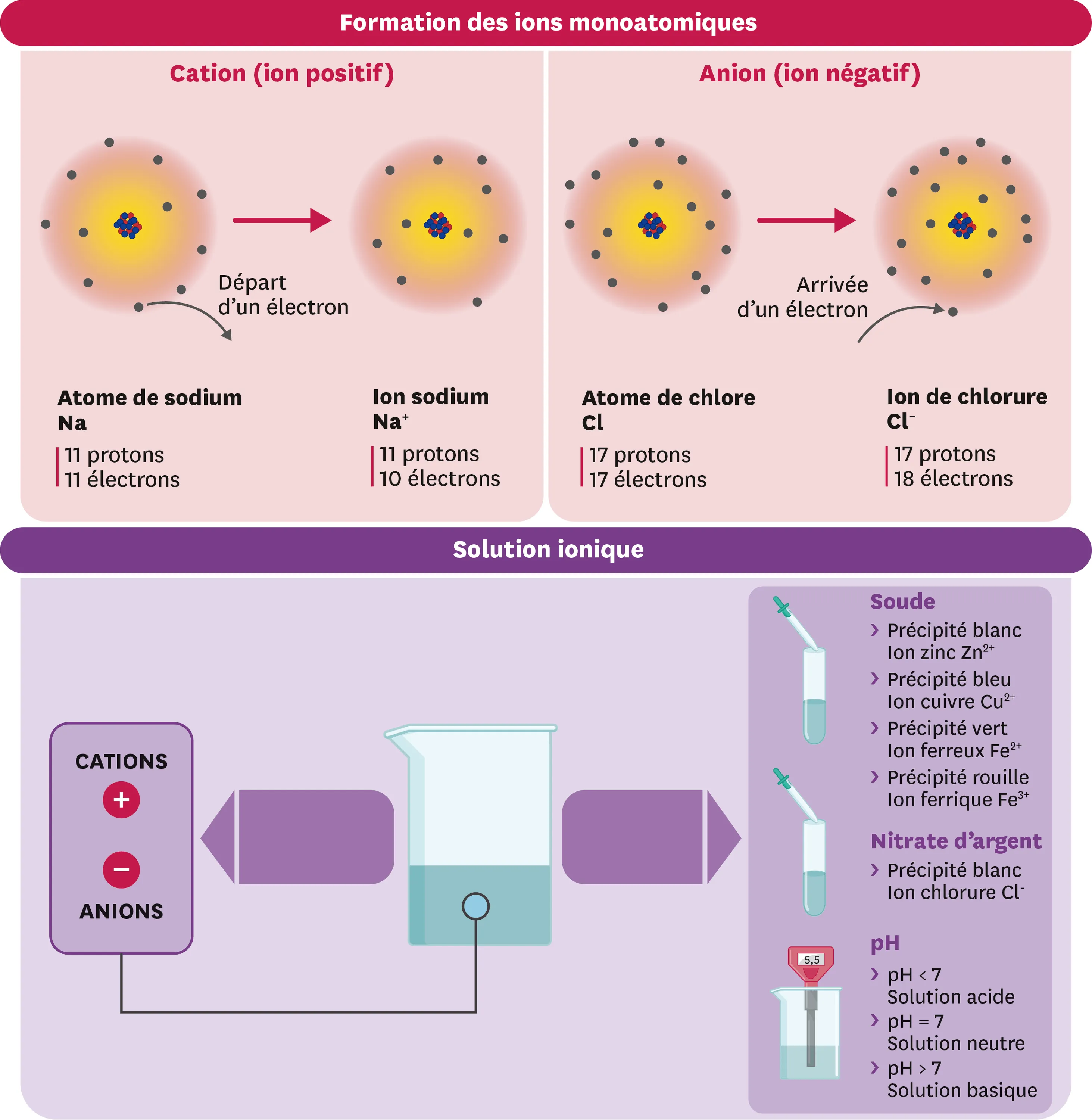
1Nature des ions
- Un ion est un atome ou une molécule qui a perdu ou gagné un ou plusieurs électrons.
- Le gain d'un ou plusieurs électrons donne un ion négatif : un anion. Par exemple, l'atome de chlore Cl gagne un électron pour devenir l'ion chlorure Cl−.
- La perte d'un ou plusieurs électrons donne un ion positif : un cation. Par exemple, l'atome de cuivre Cu perd deux électrons pour devenir l'ion cuivre Cu2+.
Le saviez-vous ?
Les ions sont les espèces chimiques obtenues après le gain ou la perte d'au moins un électron par une molécule ou un atome.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Détection des ions
- La présence d'ions peut être établie à l'aide de tests par précipitation. Un précipité apparait lorsque le test est positif ; la couleur du précipité permet d'identifier l'ion concerné.
- Les solutions d'hydroxyde de sodium (soude) permettent de tester la présence de plusieurs ions monoatomiques métalliques.
- Les solutions de nitrate d'argent permettent de tester la présence des ions chlorure.
Le saviez-vous ?
Une des méthodes d'identification d'un ion dans une solution consiste à former un précipité en ajoutant un réactif test : un autre ion en solution.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Solides et solutions ioniques
- Un solide ionique est un assemblage régulier d'anions et de cations.
- Une solution ionique est une solution de cations et d'anions, le plus souvent aqueuse. Sa formule s'écrit entre parenthèses avec les formules des ions qu'elle contient. Ex. : (Fe3+ + 3 Cl-).
- Les proportions en anions et en cations rendent les solides et solutions ioniques électriquement neutres.
Le saviez-vous ?
La proportion d'anions et de cations dans un composé ionique dépend de leur charge électrique respective. Le solide formé ou la solution obtenue sont nécessairement neutres.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
4pH et ions
- Le pH varie entre 0 et 14, et se mesure avec un pH-mètre ou du papier pH.
- Le pH vaut 7 lorsqu'il y a autant d'ions hydrogène H+ que d'ions hydroxyde HO-. La solution est alors neutre d'un point de vue acido-basique.
- Plus le pH est inférieur à 7, plus la solution est acide et contient d'ions hydrogène H+.
- Plus le pH est supérieur à 7, plus la solution est basique et contient d'ions hydroxyde HO-.
Le saviez-vous ?
Le pH d'une solution indique si celle-ci est acide, basique ou neutre. Cela dépend des proportions d'ions hydrogène et hydroxyde.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Un anion : activité 3.
- Un cation : activité 3.
- Un précipité : activité 2.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je retiens par l'image

Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

