Chapitre 4
La Physique-Chimie autrement
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Histoire des sciences
Pourquoi la masse volumique varie-t-elle ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1La structure cristalline cubique simple.

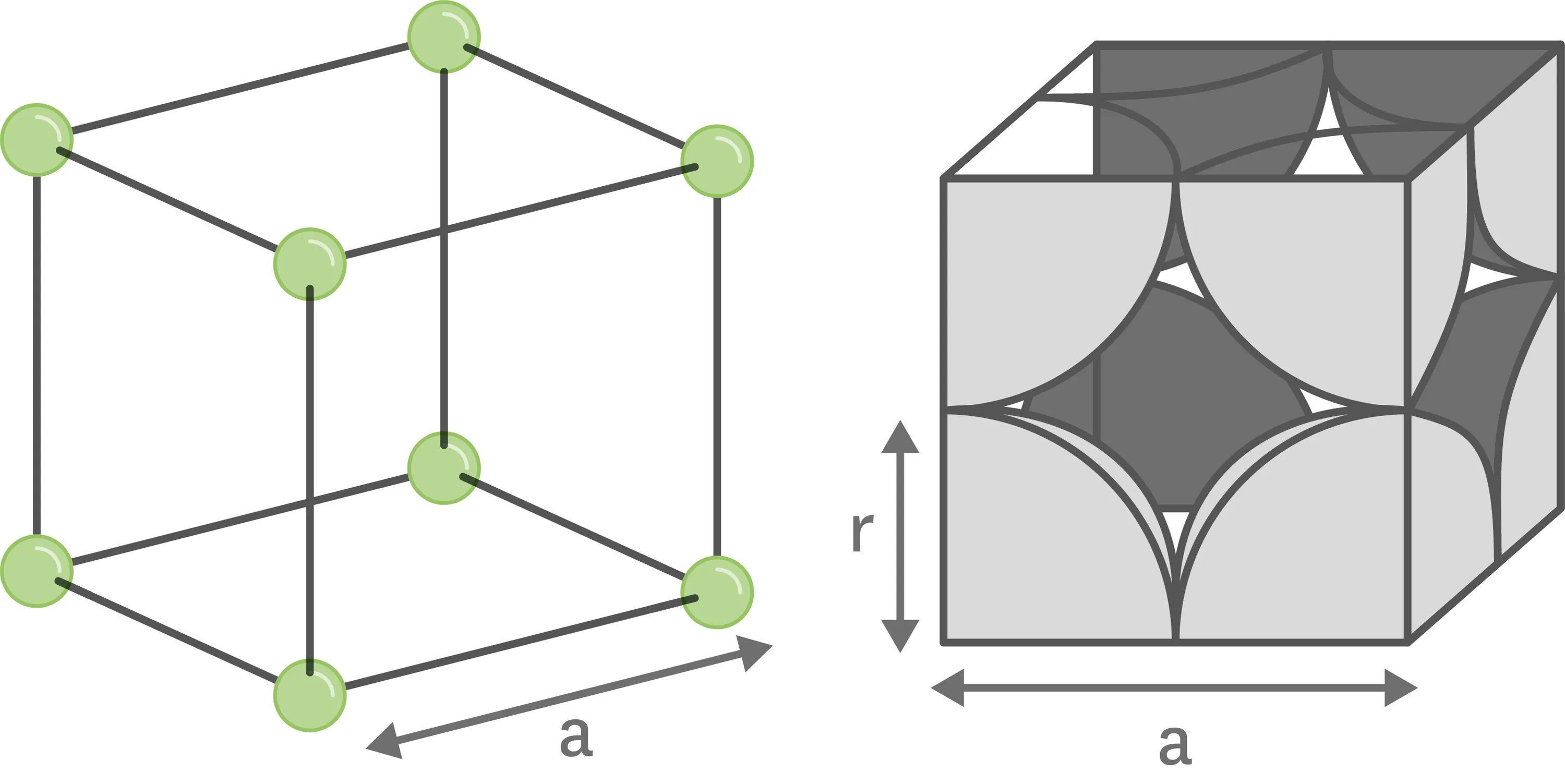
À gauche : disposition schématique des atomes dans le motif cubique.
À droite‑: occupation réelle des atomes dans le motif cubique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Taches obtenues après projection d'un faisceau de rayons X sur un cristal de béryl.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Lien entre la structure cristalline et la masse volumique.
Avec l'amélioration des techniques de microscopie, on parvient à observer précisément l'organisation des atomes, et notamment le fait qu'ils sont disposés selon des motifs très réguliers. Chaque métal a une organisation différente : motif plus ou moins grand, atome plus ou moins lourd, etc. Tout cela influe sur la masse volumique !
Le motif le plus simple est appelé « cubique simple ». C'est celui que l'on étudie ici.
La masse volumique du métal est égale au rapport de la masse m d'un cube motif par son volume V = a3. Il faut donc connaitre le nombre d'atomes entiers d'un motif.
Le motif le plus simple est appelé « cubique simple ». C'est celui que l'on étudie ici.
La masse volumique du métal est égale au rapport de la masse m d'un cube motif par son volume V = a3. Il faut donc connaitre le nombre d'atomes entiers d'un motif.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
En 1848, l'observation méthodique des cristaux amène Auguste Bravais à faire l'hypothèse que la matière est organisée symétriquement à très petite échelle. En 1912, les rayons X (découverts en 1895 par Wilhelm Röntgen), permettent à Max Von Laue de valider cette hypothèse, grâce à l'étrange image ci-dessous.
1. Doc. 1 Combien de huitièmes d'atome contient le motif cubique ? À quel nombre entier d'atome(s) cela correspond-il ?
2. Quel est le volume du cube ?
2. Quel est le volume du cube ?
3. Quelle est l'expression de la masse volumique en fonction de m et a ? La masse volumique dépend-elle de l'organisation microscopique du solide ?
4. Peux-tu imaginer d'autres manières de répartir les atomes dans le cube ?
4. Peux-tu imaginer d'autres manières de répartir les atomes dans le cube ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Objet d'étude
Un téléphone portable à 15 € ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Caractéristiques techniques de certains matériaux.
| Matériau | Prix (en € par kg) | Masse volumique | Conducteur | Dureté |
| Fer | 0,1 | 7,9 g/cm3 | Moyen | 4 |
| Aluminium | 2 | 2,7 g/cm3 | Bon | 1,5 |
| Or | 30 000 | 19 g/cm3 | Très bon | 2,5 |
| Verre | 250 | 4 g/cm3 | Non | X |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Contraintes imposées par le constructeur pour les différentes parties du téléphone.
| Circuit | Coque | Écran | |
| Conducteur | Très bon | Éventuellement | Non |
| Résistant | Non | Très | Oui |
| Volume nécessaire | 10 mm3 | 30 cm3 | 8 cm3 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Tous les constructeurs de téléphones portables ont le même objectif : construire un téléphone performant, léger et le moins cher possible. Pour y parvenir, le choix des matériaux est crucial !
1. On veut fabriquer un téléphone performant pesant moins de 270 g. Quels matériaux choisir pour chacun des composants ?
2. Quel est alors le prix du téléphone ? Pourquoi ce prix est-il beaucoup plus faible que le prix de vente final ?
1. On veut fabriquer un téléphone performant pesant moins de 270 g. Quels matériaux choisir pour chacun des composants ?
2. Quel est alors le prix du téléphone ? Pourquoi ce prix est-il beaucoup plus faible que le prix de vente final ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
La Physique-Chimie au quotidienEsprit scientifique
Quels sont les métaux utilisés dans nos petites pièces de monnaie ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
| Pièces (centimes) | 1 centime | 2 centimes | 5 centimes |
| Métaux présents | Fer, Cuivre | Fer, Cuivre | Fer, Cuivre |
| Métal | Fer | Cuivre |
| Masse volumique du métal pur, à 20°C | 7,87 g/mL | 8,96 g/mL |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Un aimant.
- 22 pièces de 2 centimes d'euros.
- Une balance de cuisine précise au gramme.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Étapes de la fabrication :
Observe si ces pièces sont attirées par l'aimant. Les 22 pièces de 2 centimes ont un volume total d'environ 10 mL. Pèse-les.Des questions à se poser :
1. Quel est le métal à la surface des pièces de 5 centimes d'euros ?
2. Ces pièces contiennent-elles du fer ?
2. Ces pièces contiennent-elles du fer ?
3. Que vaut la masse volumique des pièces de 2 centimes d'euros en g/mL ?
4. Ces pièces ne contiennent-elles que du fer et du cuivre ?
4. Ces pièces ne contiennent-elles que du fer et du cuivre ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Le métal rouge à la surface des pièces est le cuivre. Ces pièces sont attirées par l'aimant, preuve qu'elles contiennent du fer. Cependant, leur masse volumique est de 65 g pour 10 mL soit 6,5 g/mL : c'est plus faible que les masses volumiques du cuivre et du fer. Un troisième composant les rend moins denses : le carbone. Ces pièces de 2 centimes sont en acier (alliage fer-carbone) recouvertes de cuivre.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Il n'y a pas que le fer qui est attiré par l'aimant, mais c'est bien lui qui est présent dans les pièces de 5 centimes.
- Le métal de couleur rouge est le cuivre !
- La masse volumique d'une pièce est plus faible que celle du fer et du cuivre : il y a un troisième composant.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

