Dossier Brevet
Sujet 1 - Sujet commun : Physique-Chimie
Les conséquences des pluies acides
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Introduction
Les pluies acides désignent toute forme de précipitations dont le pH est plus acide que la normale. C'est un phénomène d'origine non naturelle. Bien que l'on soit loin du scénario catastrophe évoqué dans certains films, les pluies acides sont néanmoins à l'origine de désastres écologiques et sanitaires.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Partie 1 Formation des pluies acides
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Dépérissement forestier dû aux pluies acides.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3 Réaction de dissolution du dioxyde de carbone dans l'eau.
Réaction de dissolution du dioxyde de carbone dans l'eau :
\text{H}_2\text{0} + \text{CO}_2 \rightarrow \text{H}_2\text{CO}_3
Réaction de dissociation de l'acide carbonique dans l'eau :
\text{H}_2\text{CO}_3 \rightarrow 2\ \text{H}^+ + \text{CO}_3^{2-}
\text{H}_2\text{0} + \text{CO}_2 \rightarrow \text{H}_2\text{CO}_3
Réaction de dissociation de l'acide carbonique dans l'eau :
\text{H}_2\text{CO}_3 \rightarrow 2\ \text{H}^+ + \text{CO}_3^{2-}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Évolution de la quantité de dioxyde de carbone dans l'atmosphère.

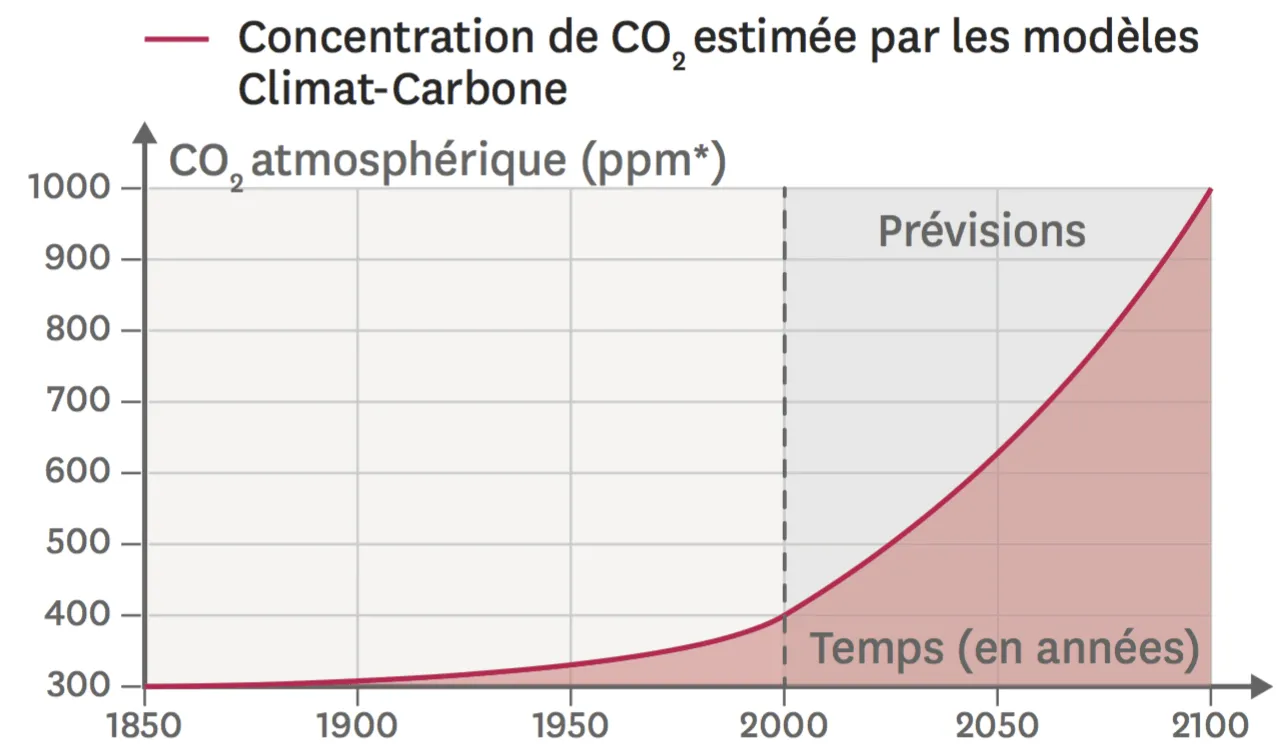
Les émissions de dioxyde de carbone, qui est un gaz à effet de serre, sont responsables du réchauffement climatique mais aussi des pluies acides.
*La concentration en dioxyde de carbone est ici exprimée en ppm (partie par million). 1 ppm correspond à une molécule de dioxyde de carbone pour un million de molécules dans l'air.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Question
L'eau de pluie est une eau légèrement acide naturellement : son pH est d'environ 5,6. La dissolution du dioxyde de carbone de l'air dans les gouttes d'eau forme de l'acide carbonique, responsable de cette acidité. L'industrie et les transports augmentent la quantité de dioxyde de carbone dans l'atmosphère.
1. À l'aide des documents, explique pourquoi l'acidité de l'eau de pluie ne cesse d'augmenter.
1. À l'aide des documents, explique pourquoi l'acidité de l'eau de pluie ne cesse d'augmenter.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Partie 2
Impact des pluies acides sur les poissons
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4 Des poissons intoxiqués par des pluies acides.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
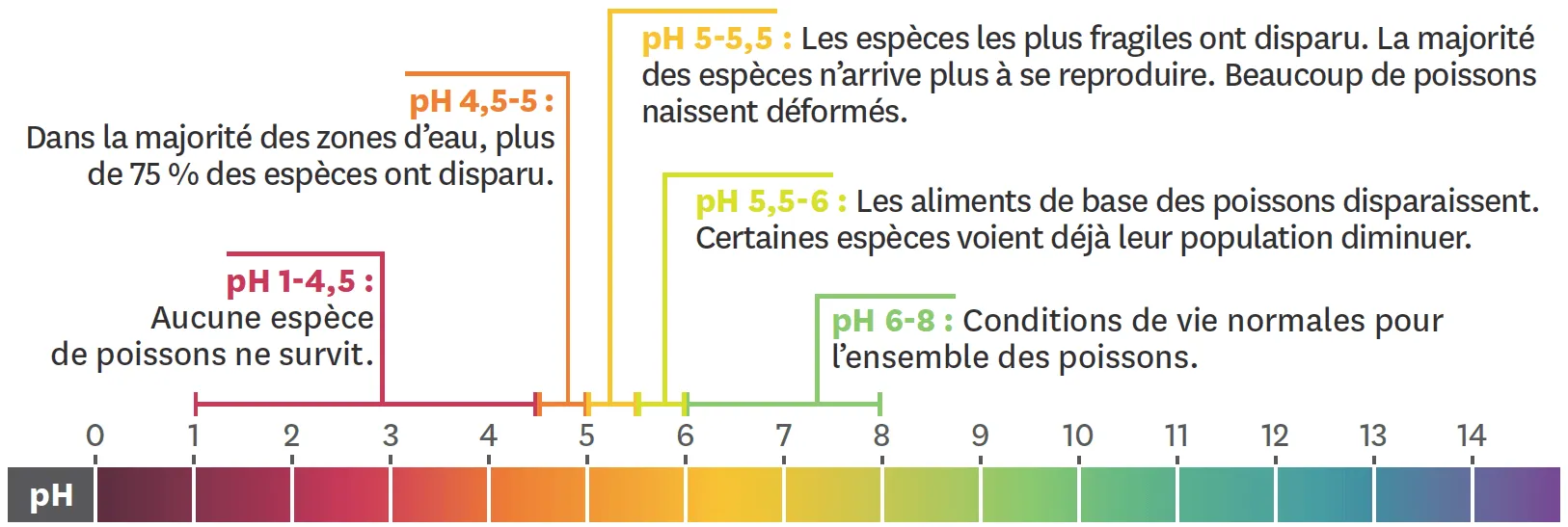
Doc. 5 Échelle de pH avec les conséquences sur la mortalité des poissons.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Les poissons, vivant en eau douce dans les lacs et rivières, sont dans un environnement au pH compris entre 6 et 8 dans des conditions normales. Toute modification de ce pH, hors de ces valeurs, affecte très rapidement la reproductibilité voire la survie des espèces.
1. Si quelques gouttes de pluie acide tombent dans un lac, quel phénomène physique subissent-elles ? Est-ce que le pH du lac varie beaucoup ?
2. En cas de fortes précipitations, quel sera l'effet sur l'eau du lac et ses poissons ?
1. Si quelques gouttes de pluie acide tombent dans un lac, quel phénomène physique subissent-elles ? Est-ce que le pH du lac varie beaucoup ?
2. En cas de fortes précipitations, quel sera l'effet sur l'eau du lac et ses poissons ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Partie 3 Le saturnisme
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 6 Une canalisation d'eau.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 7 Modes de contamination.
La contamination du sang par un corps étranger se fait principalement par trois voies différentes.
- La voie respiratoire : le corps étranger est un gaz (ou dans un gaz) que le patient a respiré. Il passe la barrière des poumons et se retrouve dans le sang.
- La voie digestive : le corps étranger est dans un aliment ou dans un liquide, avalé par le patient. Il passe la barrière de l'estomac ou des intestins et se retrouve dans le sang.
- La voie cutanée : le corps étranger a pénétré dans l'organisme du patient via une plaie.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 8 Réaction entre le plomb et l'acide chlorhydrique.
Dans un tube à essais, on verse de la poudre de plomb et on y ajoute de l'acide chlorhydrique concentré. Une effervescence est alors observée. Au bout de quelques instants, la poudre de plomb a complètement disparu. Afin d'identifier les produits de la transformation chimique, on réalise 3 tests :
- test de flamme : on entend une légère détonation ;
- test à l'iodure de potassium : on obtient un précipité jaune ;
- test au nitrate d'argent : on obtient un précipité blanc.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 9 Tests de reconnaissance de quelques espèces chimiques.
| Test | Espèce chimique | Observation |
| Test de flamme | Dioxygène O2 | La flamme se ravive |
| Test de flamme | Dihydrogène H2 | Détonation |
| Test à l'hydroxyde de sodium | Ions zinc (II) Zn2+ | Précipité blanc |
| Test à l'iodure de potassium | Ions plomb (II) Pb2+ | Précipité jaune |
| Test au nitrate d'argent | Ions de chlorure Cl- | Précipité blanc |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Le saturnisme est une intoxication grave pouvant entrainer la mort. Elle est causée par la présence de plomb dans le sang (au-delà du seuil de 50 μg par litre de sang). Le plomb est un métal qui peut se trouver notamment dans nos canalisations. L'eau des pluies acides peut réagir avec lui avant d'être utilisée.
1. Écris l'équation de réaction équilibrée de la transformation chimique du plomb avec l'acide chlorhydrique.
2. Comment peut-on avoir du plomb dans le sang ? Sous quelle forme s'y trouve-t-il ?
1. Écris l'équation de réaction équilibrée de la transformation chimique du plomb avec l'acide chlorhydrique.
2. Comment peut-on avoir du plomb dans le sang ? Sous quelle forme s'y trouve-t-il ?
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

