Chapitre 1
Exercices
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je me teste
Je sais
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Les atomes doivent leur origine :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Le noyau d'un atome est constitué :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Complète la grille de mots-croisés. Pour écrire sur ce schéma, veuillez cliquer sur l'image et utiliser notre outil de dessin.
Horizontal :
1. Particule électriquement neutre appartenant au noyau d'un atome.
2. Assemblage d'atomes liés entre eux.
3. Astre sphérique, en orbite autour d'une étoile.
4. Lettre majuscule, suivie parfois d'une minuscule, représentant un élément chimique.
1. Particule électriquement neutre appartenant au noyau d'un atome.
2. Assemblage d'atomes liés entre eux.
3. Astre sphérique, en orbite autour d'une étoile.
4. Lettre majuscule, suivie parfois d'une minuscule, représentant un élément chimique.
Vertical :
4. Particule chargée négativement se trouvant autour du noyau d'un atome.
5. Particule chargée positivement appartenant au noyau d'un atome.
6. Particule formant le noyau d'un atome.
7. Astre produisant sa propre énergie lumineuse et thermique.
8. Espèce chimique simple, électriquement neutre, constituant la matière.
4. Particule chargée négativement se trouvant autour du noyau d'un atome.
5. Particule chargée positivement appartenant au noyau d'un atome.
6. Particule formant le noyau d'un atome.
7. Astre produisant sa propre énergie lumineuse et thermique.
8. Espèce chimique simple, électriquement neutre, constituant la matière.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je sais faire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
4Si on connait le nombre de protons d'un élément chimique, que peut-on déterminer dans le tableau périodique ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5Le fait qu'un atome soit globalement électriquement neutre :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6Un atome de numéro atomique Z = 5 possède forcément :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercice corrigé
Compétence : Lire et comprendre des documents scientifiques pour en extraire des informations.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7Utilisation du tableau périodique.
À l'aide du tableau périodique :
1. Donne le nom et le symbole de l'atome qui a pour numéro atomique Z = 26.
2. Donne le nom et le symbole de l'atome qui a 7 protons dans son noyau.
3. Donne le nom et le symbole de l'atome qui possède 8 électrons.
1. Donne le nom et le symbole de l'atome qui a pour numéro atomique Z = 26.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Étapes de la méthode
- Pour relier la composition d'un atome au tableau périodique, il faut se souvenir de la définition suivante : le numéro atomique Z de l'atome est égal au nombre de protons dans le noyau.
- Pour connaitre le nombre d'électrons à partir du numéro atomique Z, il faut se souvenir que l'atome est électriquement neutre : il possède autant de protons que d'électrons, ces deux particules ayant des charges opposées.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Corrigé
1. L'atome qui a pour numéro atomique Z = 26 se trouve dans la 26e case du tableau périodique. Il s'agit du fer de symbole Fe.
2. Par définition, le nombre de protons est le numéro atomique Z de l'atome. Ici, il s'agit de l'atome pour lequel Z = 7, soit d'après le tableau, de l'azote de symbole N.
3. Un atome est électriquement neutre, car il possède autant d'électrons que de protons. Un atome possédant 8 électrons a donc 8 protons, et son numéro atomique est alors Z = 8. Il s'agit de l'oxygène de symbole O.
2. Par définition, le nombre de protons est le numéro atomique Z de l'atome. Ici, il s'agit de l'atome pour lequel Z = 7, soit d'après le tableau, de l'azote de symbole N.
3. Un atome est électriquement neutre, car il possède autant d'électrons que de protons. Un atome possédant 8 électrons a donc 8 protons, et son numéro atomique est alors Z = 8. Il s'agit de l'oxygène de symbole O.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercice similaire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8Encore des atomes !
À l'aide du tableau périodique :
1. Donne le nom et le symbole de l'atome qui a pour numéro atomique Z = 29.
2. Donne le nom et le symbole de l'atome qui a 79 protons dans son noyau.
3. Donne le nom et le symbole de l'atome qui possède 47 électrons.
1. Donne le nom et le symbole de l'atome qui a pour numéro atomique Z = 29.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je m'entraine
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9Faire des schémas.
Compétence
Produire et transformer des tableaux ou des documents graphiques

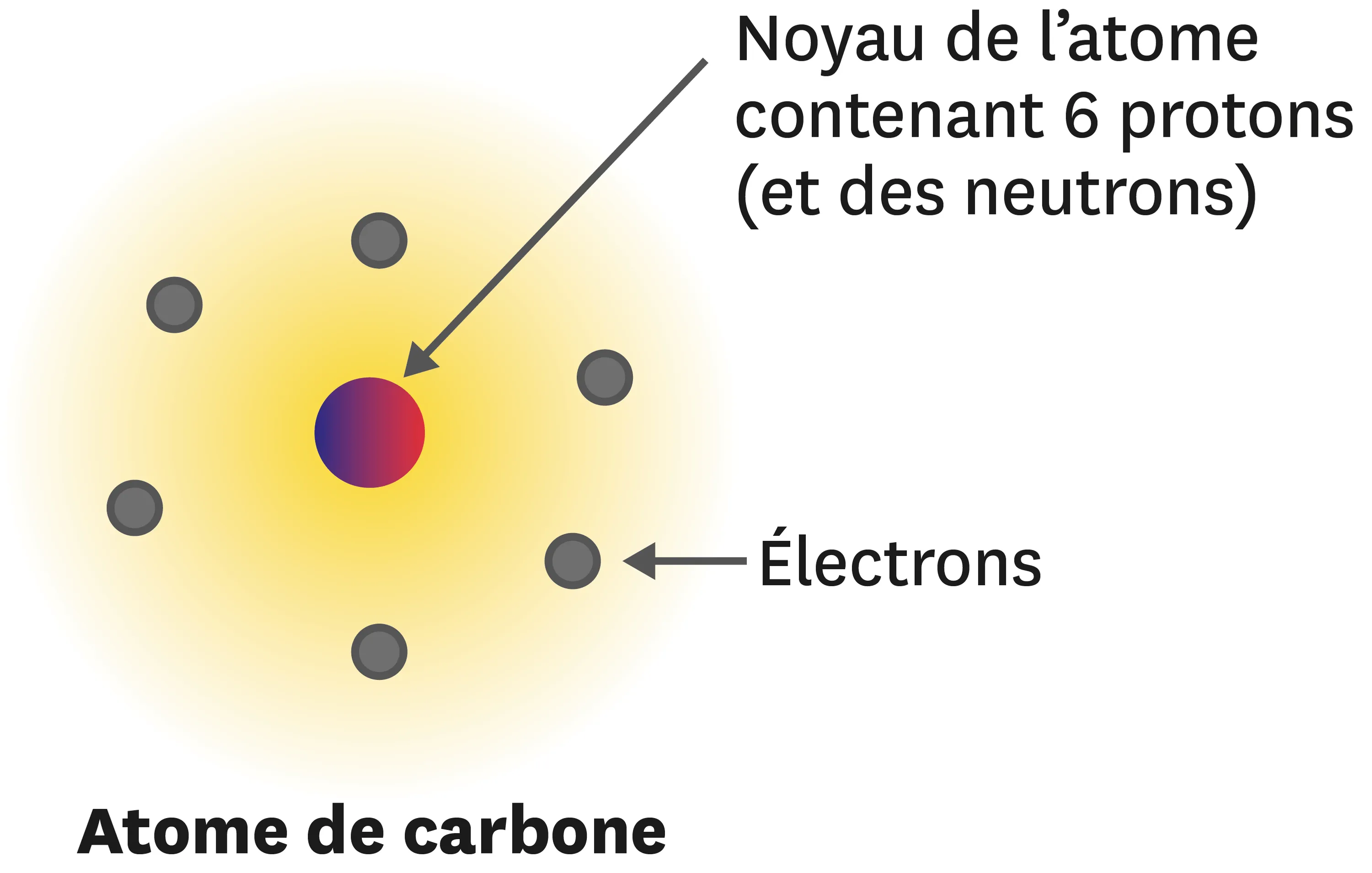
Fais un schéma légendé de chacun des atomes suivants sans indiquer le nombre de neutrons (voir l'exemple de l'atome de carbone).
1. Hélium.
Cliquez pour accéder à une zone de dessin
2. Azote.
Cliquez pour accéder à une zone de dessin
3. Oxygène.
Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10Structure d'un atome.
1. Clique sur le schéma et complète les parties manquantes de la légende avec l'outil dessin.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11Associe chaque objet à sa dimension.
Compétence
Identifier différentes échelles spatiales
| Diamètre de l'Univers observable | |
| Diamètre d'un atome | |
| Diamètre du noyau de l'atome | |
| Diamètre de la Terre | |
| Diamètre de la Lune | |
| Diamètre du Soleil | |
| Distance Terre-Soleil |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
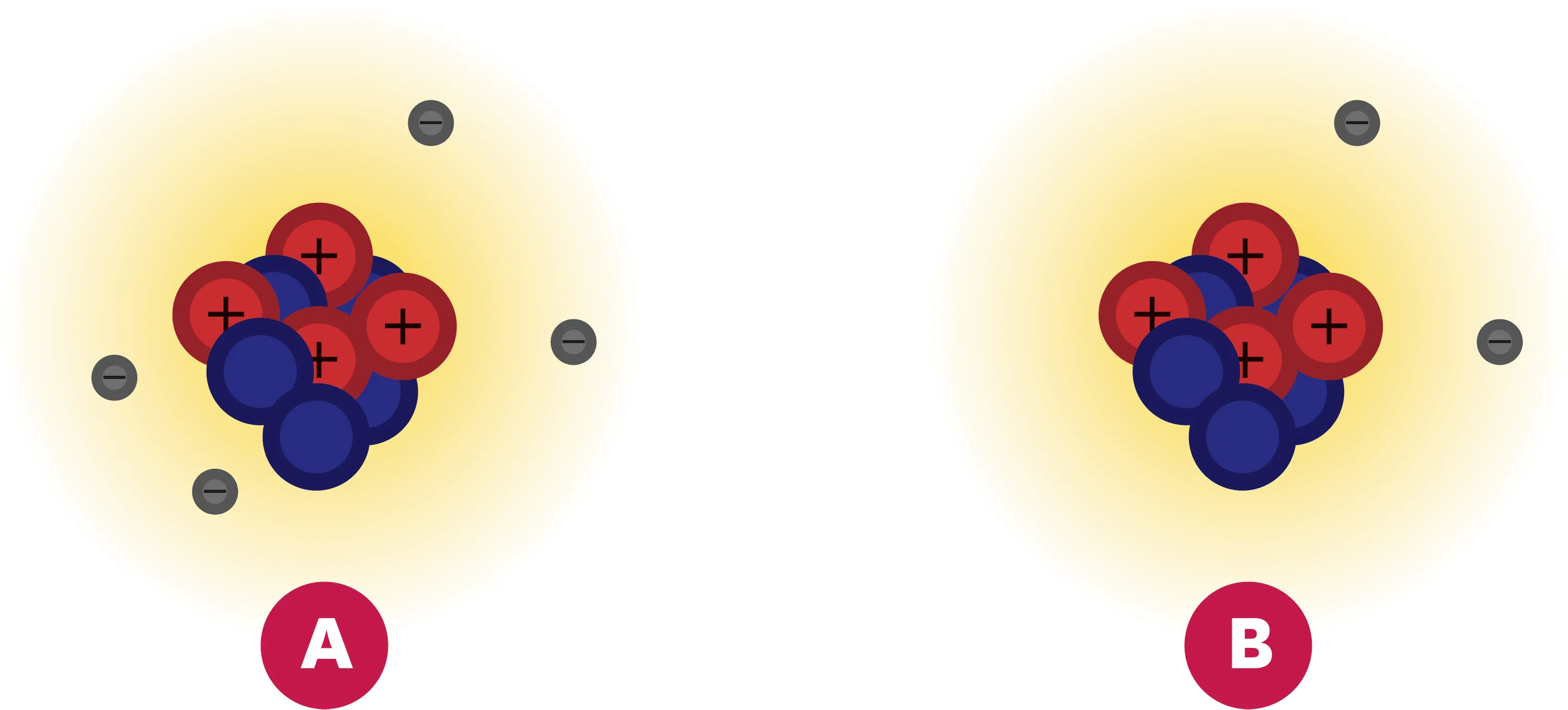
12Reconnaitre l'atome.
1. Un de ces schémas représente l'atome de béryllium. Lequel ? Justifie ton choix à l'aide du tableau périodique et donne le symbole de cet atome.



Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13Un peu d'étymologie.
1. Associe les racines grecques ou latines aux termes scientifiques.
| nucleus « noyau » | |
| atomos « insécable » | |
| molecula « petite masse » | |
| galaxias « cercle de lait » | |
| stella « étoile » | |
| nebula « nuage » |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14Analyse du tableau périodique.
Compétence
Lire et comprendre des documents scientifiques pour en extraire des informations
1. Quel est le nombre total d'atomes contenus dans ce tableau ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15Charade.
Les trois premières questions doivent te permettre de répondre à la quatrième question.
1. Mon premier est le symbole de l'atome dont le nuage électronique contient 11 électrons.
2. Mon deuxième est le symbole d'un atome qui est avant-dernier dans la colonne de l'oxygène.
3. Mon troisième est le symbole d'un atome dont le numéro atomique est trois.
4. Mon tout est le nom (dans sa langue d'origine) d'une ville du sud-ouest de l'Italie.
1. Mon premier est le symbole de l'atome dont le nuage électronique contient 11 électrons.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16Retrouve l'âge de chacun des évènements.
1. À toi de jouer !
| 100 ans | |
| 4,6 milliards d'années | |
| 13,7 milliards d'années | |
| 400 000 000 ans | |
| 66 millions d'années | |
| 200 000 ans | |
| 2 500 ans |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Structure des atomes.
1. Complète le tableau.
| Nom de l'atome |
| Chlore |
|
|
|
| Symbole de l'atome | He |
|
|
| H |
| Nombre de protons dans le noyau |
|
| 26 |
|
|
| Nombre d'électrons |
|
|
| 79 |
|
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18Des mots pour une phrase.
Utilise les mots dans l'ordre de ton choix pour construire des phrases correctes.
1. nucléons - électrons - cortège électronique - atome - noyau
2. électrons - électriquement neutres - protons - chargés négativement - neutrons - chargés positivement
3. électrons - nuage électronique - protons - noyau - globalement électriquement neutre - atome
1. nucléons - électrons - cortège électronique - atome - noyau
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Compétence : Comprendre et interpréter des tableaux ou des documents graphiques.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19-ALes constituants d'une molécule. Des électrons dans l'alcool ?
Romain réalise que les molécules, composées d'atomes, contiennent nécessairement des neutrons, des protons et des électrons. Il se demande combien d'électrons contient une molécule comme l'éthanol.

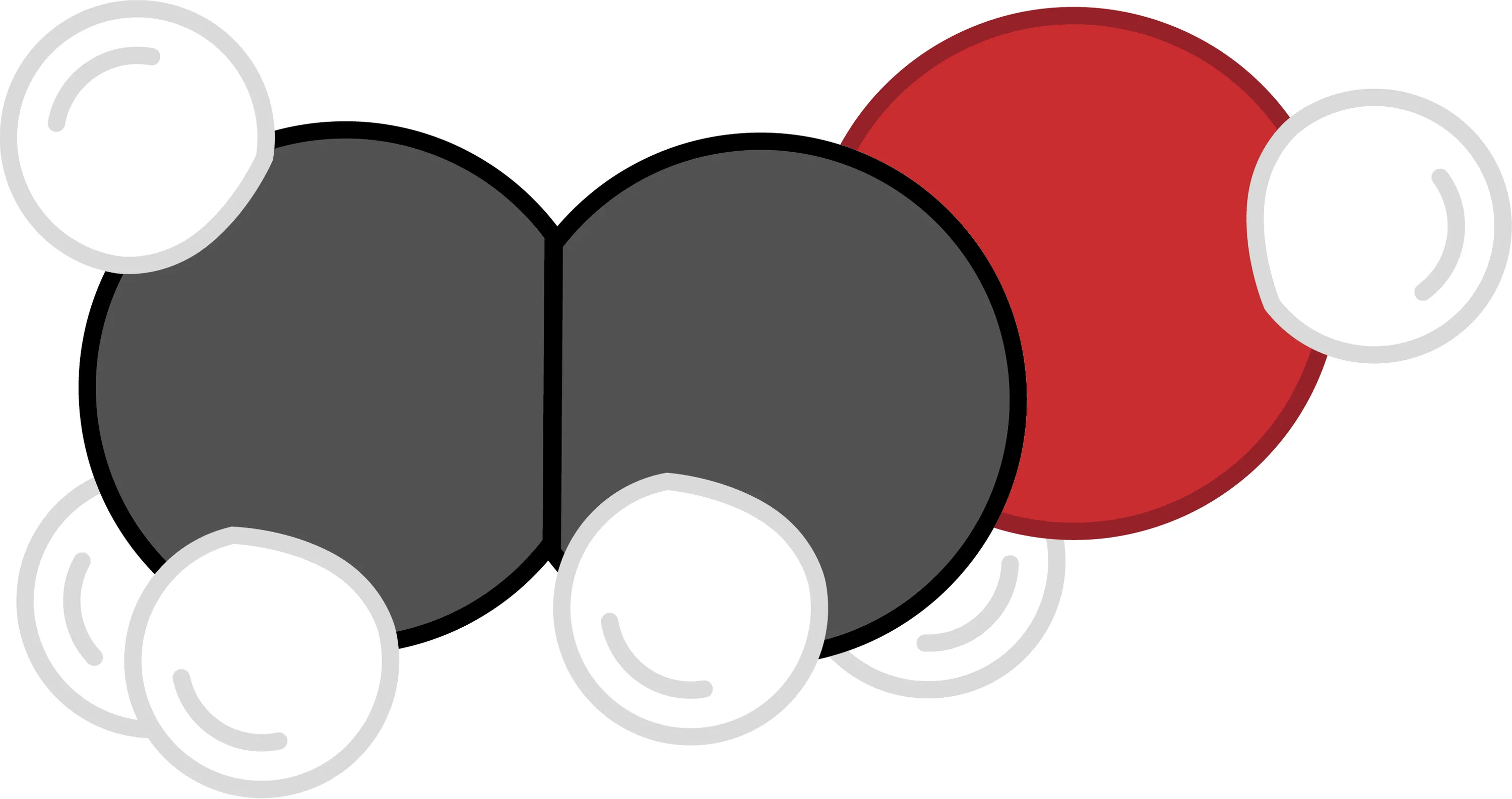
1. Quels sont les atomes qui composent cette molécule ?
2. Combien y en a-t-il de chaque sorte ?
3. Détermine le nombre de protons de chaque atome à l'aide du tableau périodique.
4. Détermine le nombre d'électrons de chaque atome en t'appuyant sur le fait qu'ils sont neutres.
5. Réponds à la question de Romain.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19-BLes constituants d'une molécule. Des électrons dans le vinaigre ?
Valentine réalise que les molécules, composées d'atomes, contiennent nécessairement des neutrons, des protons et des électrons. Elle se demande combien d'électrons contient une molécule comme l'acide acétique, qui est, après l'eau, le principal composant du vinaigre.

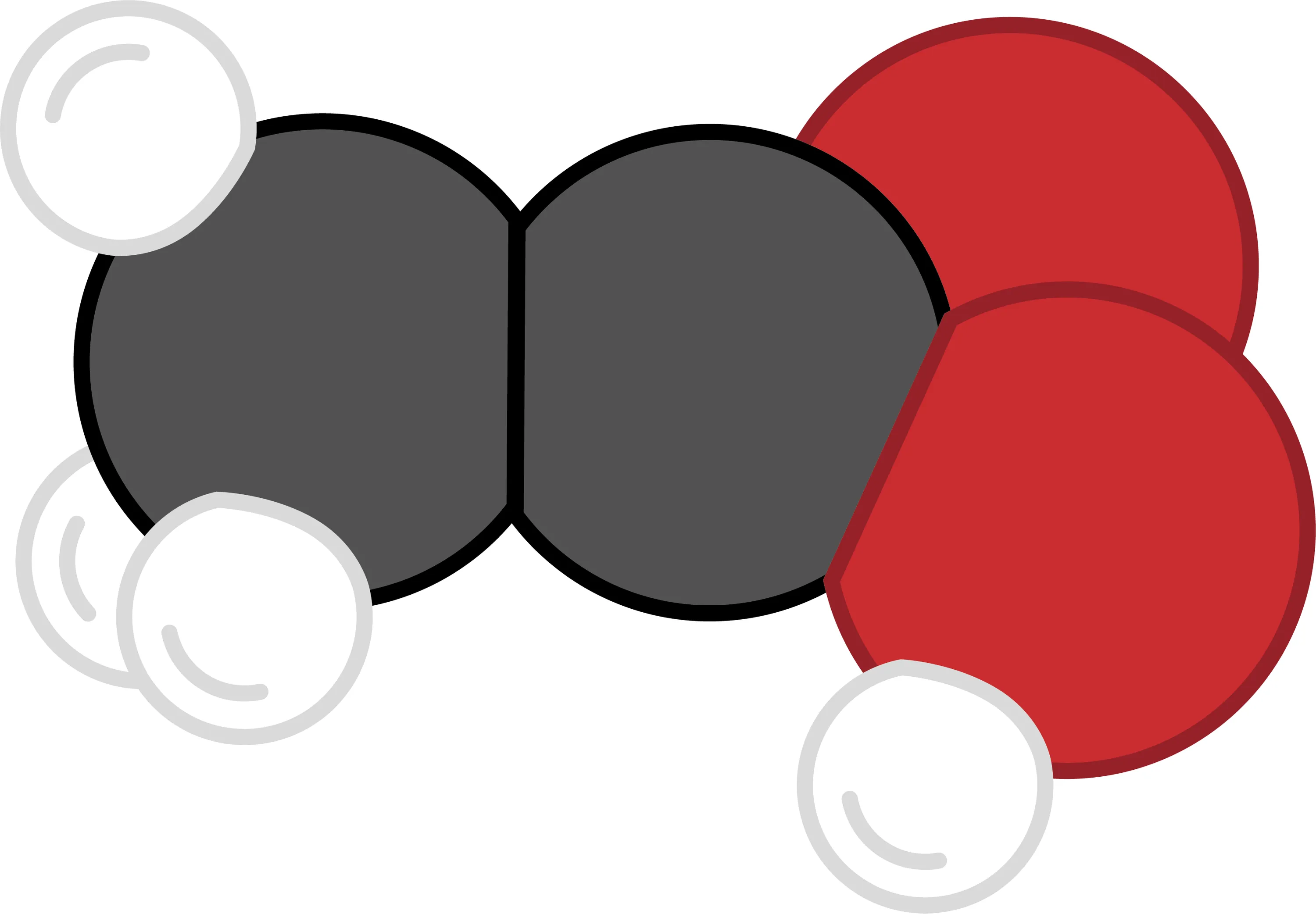
1. Détermine la composition de l'acide acétique à l'aide du dessin de sa molécule.
2. Détermine le nombre d'électrons pour chaque type d'atome à l'aide du tableau périodique.
3. Réponds à la question de Valentine.


1. Détermine la composition de l'acide acétique à l'aide du dessin de sa molécule.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19-CLes constituants d'une molécule. Des électrons dans le sucre ?
Yasmine réalise que les molécules, composées d'atomes, elles contiennent nécessairement des neutrons, des protons et des électrons. Elle se demande combien d'électrons contient une molécule comme le glucose.

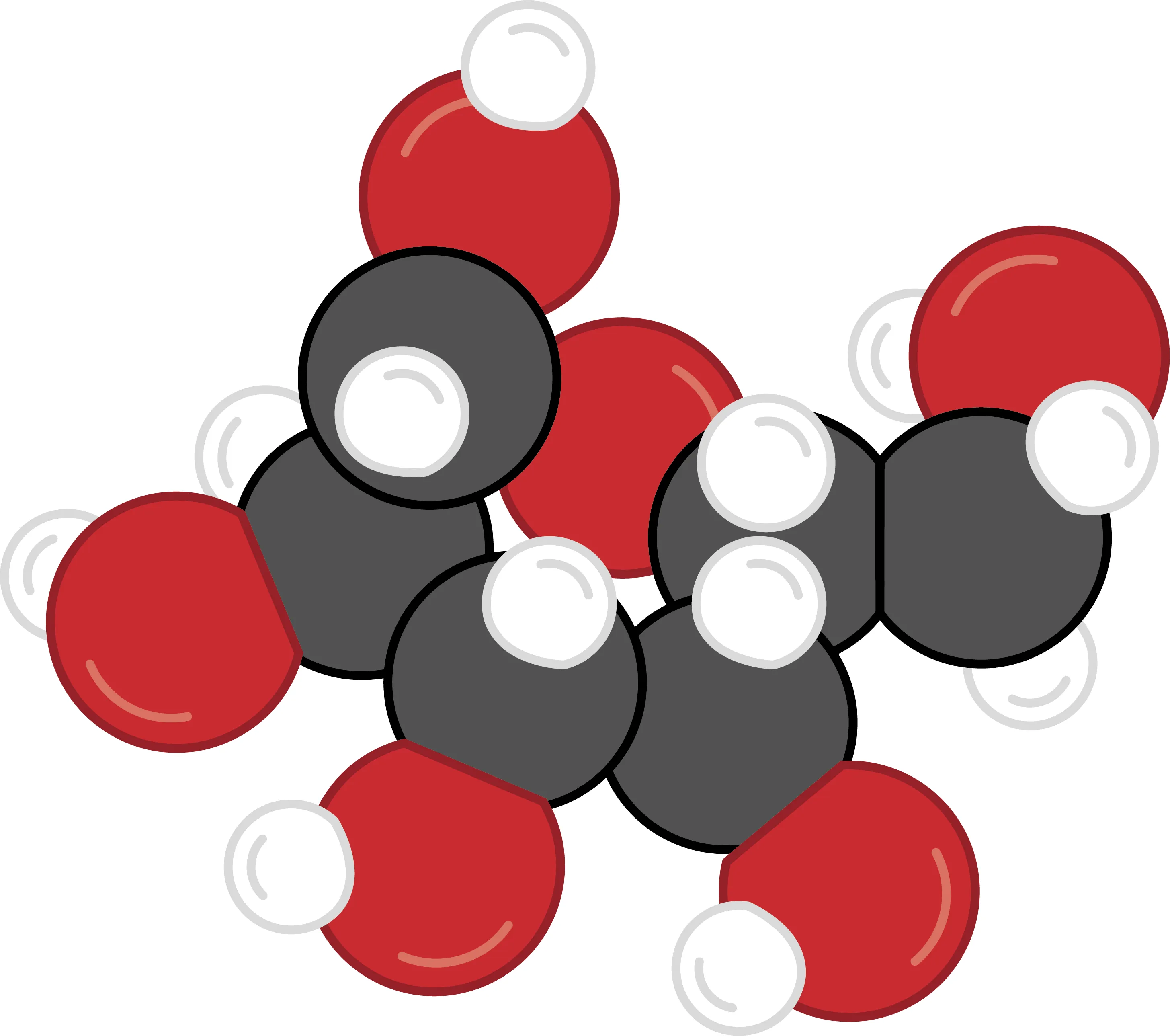
1. À l'aide du dessin de la molécule de glucose et du tableau périodique, réponds à la question de Yasmine.


1. À l'aide du dessin de la molécule de glucose et du tableau périodique, réponds à la question de Yasmine.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
J'approfondis
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20Nucléosynthèse stellaire.
Lors de la formation des atomes dans les étoiles massives, juste avant qu'elles n'explosent en supernovae, les atomes sont formés différemment selon que l'on se situe proche du centre de l'étoile, où la température est d'environ 100 millions de degrés, ou en périphérie à seulement 3 000 degrés.
1. Pour chaque couche, recherche à l'aide du tableau périodique le numéro atomique des atomes formés.
2. Que remarques-tu ?

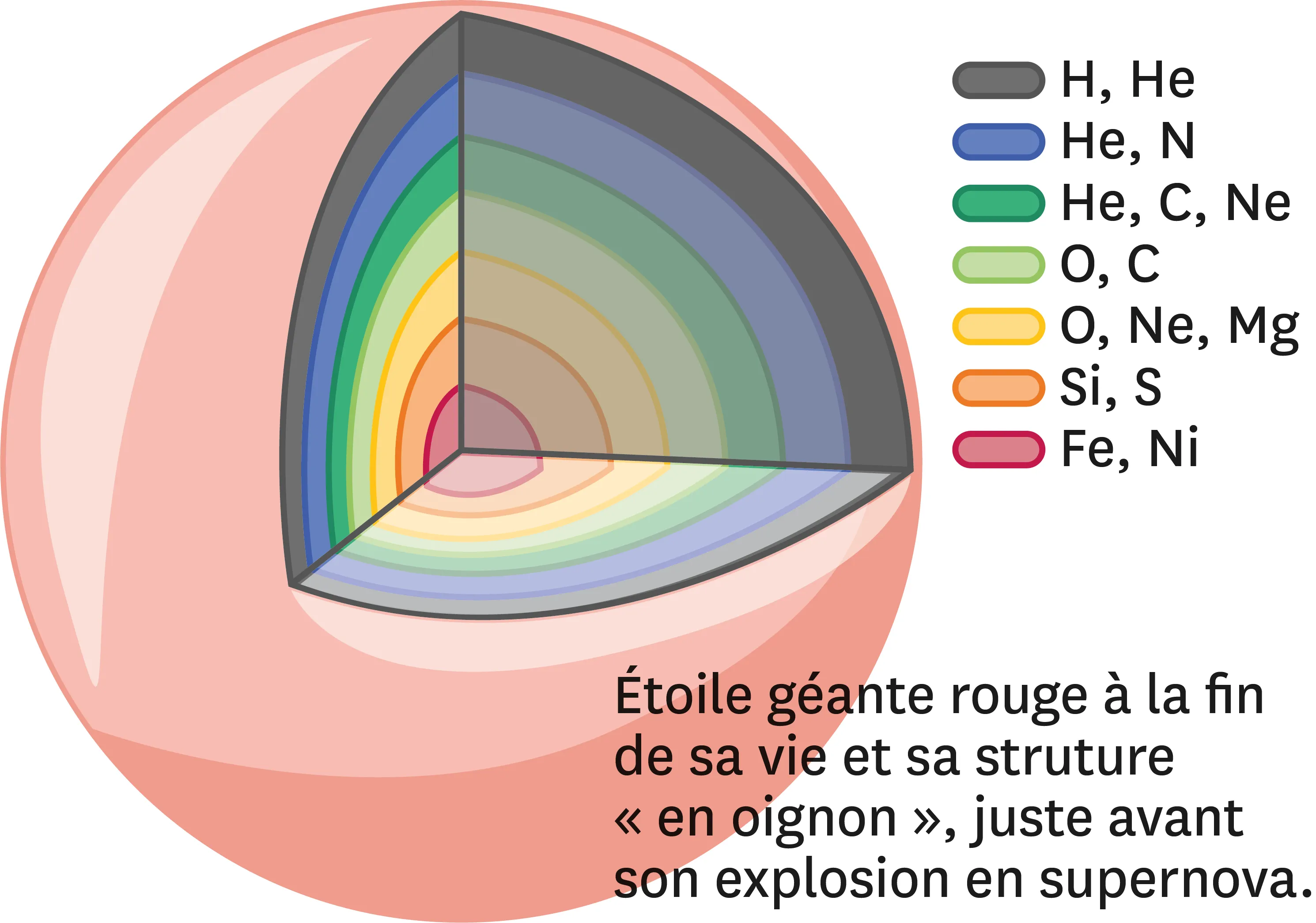
1. Pour chaque couche, recherche à l'aide du tableau périodique le numéro atomique des atomes formés.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21Transformer le plomb en or, vraiment ?
Compétence
Comprendre l'évolution d'un savoir scientifique dans le temps et son influence sur la société
1. À l'aide du tableau p�ériodique, indique la composition en protons et en électrons de l'atome de plomb puis celle de l'atome d'or.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22Masse d'un atome.
Compétence
Pratiquer le calcul numérique et le calcul littéral
Données : masse d'un neutron ≈ masse d'un proton = 1,6 × 10-27 kg ; masse d'un électron = 9,1 × 10‑31 kg.

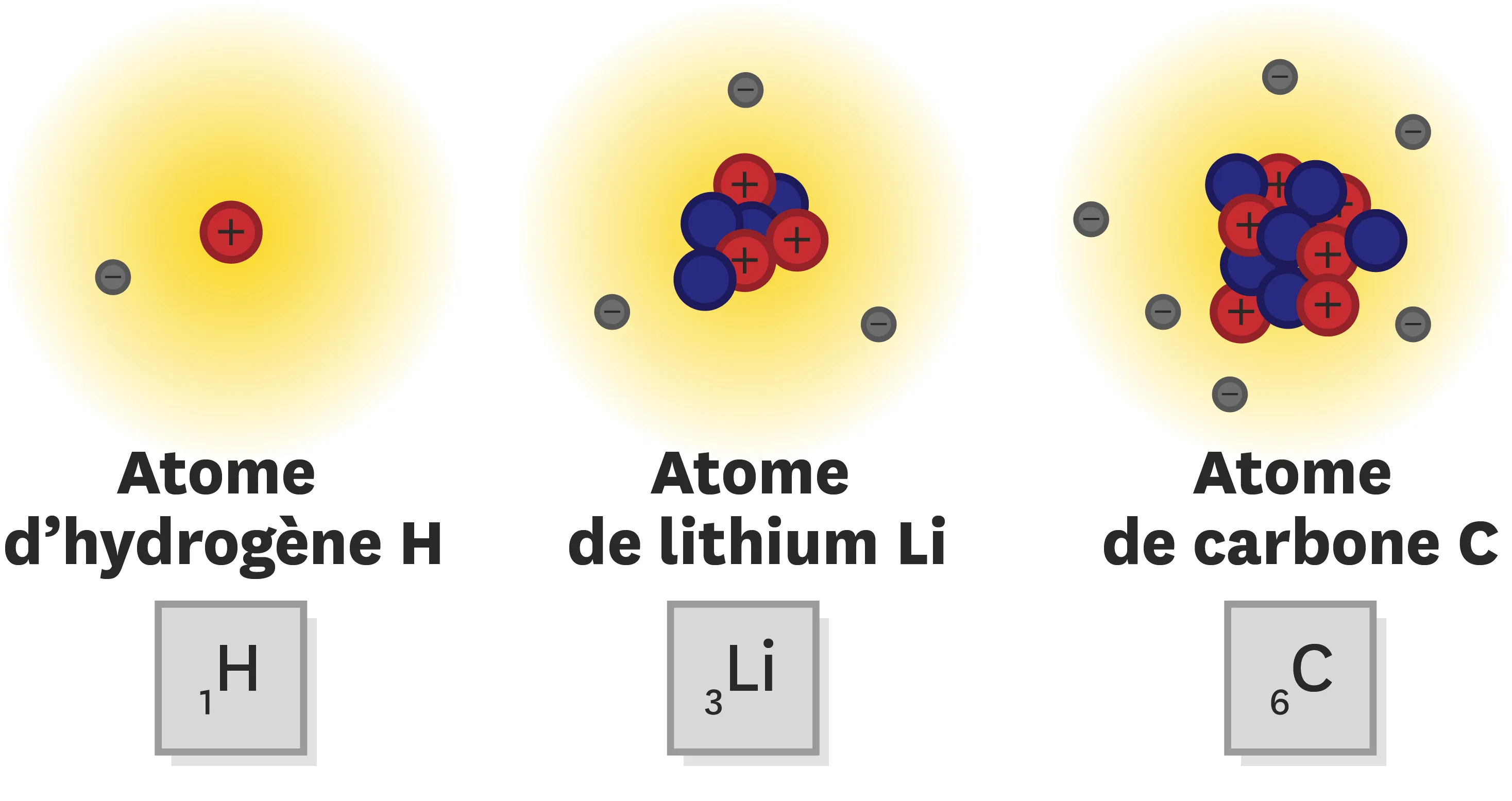
1. Le noyau de l'atome de lithium contient 7 nucléons. Quelle est la masse du noyau de l'atome de lithium ?
2. L'atome de lithium possède 3 électrons. Quelle est la masse de l'ensemble de ses électrons ?
3. Quelle est la masse totale de l'atome de lithium ? Quelle remarque peux-tu faire ?
4. Raisonne de la même manière et analyse la composition des atomes d'hydrogène et de carbone pour calculer leur masse.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23Cherche l'intrus.
Trois de ces schémas représentent les atomes de lithium, béryllium et bore. Le quatrième est un intrus.
1. Associe les bons schémas aux atomes qui correspondent, en justifiant ton choix.

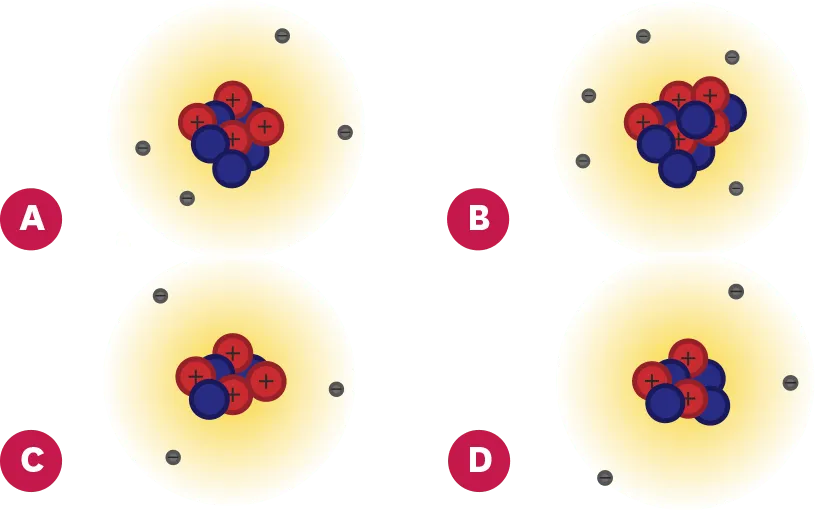
1. Associe les bons schémas aux atomes qui correspondent, en justifiant ton choix.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24Quand un atome perd ses « plumes ».
Le nombre de protons dans le noyau est très difficile à modifier. En revanche, il est facile d'ajouter ou d'enlever des électrons à certains atomes. On obtient alors une espèce chimique chargée : un ion.
1. Quel schéma ci-dessous représente un atome ? Quel schéma représente un ion ?
2. Cet ion est électriquement chargé. La charge globale est-elle positive ou négative ?

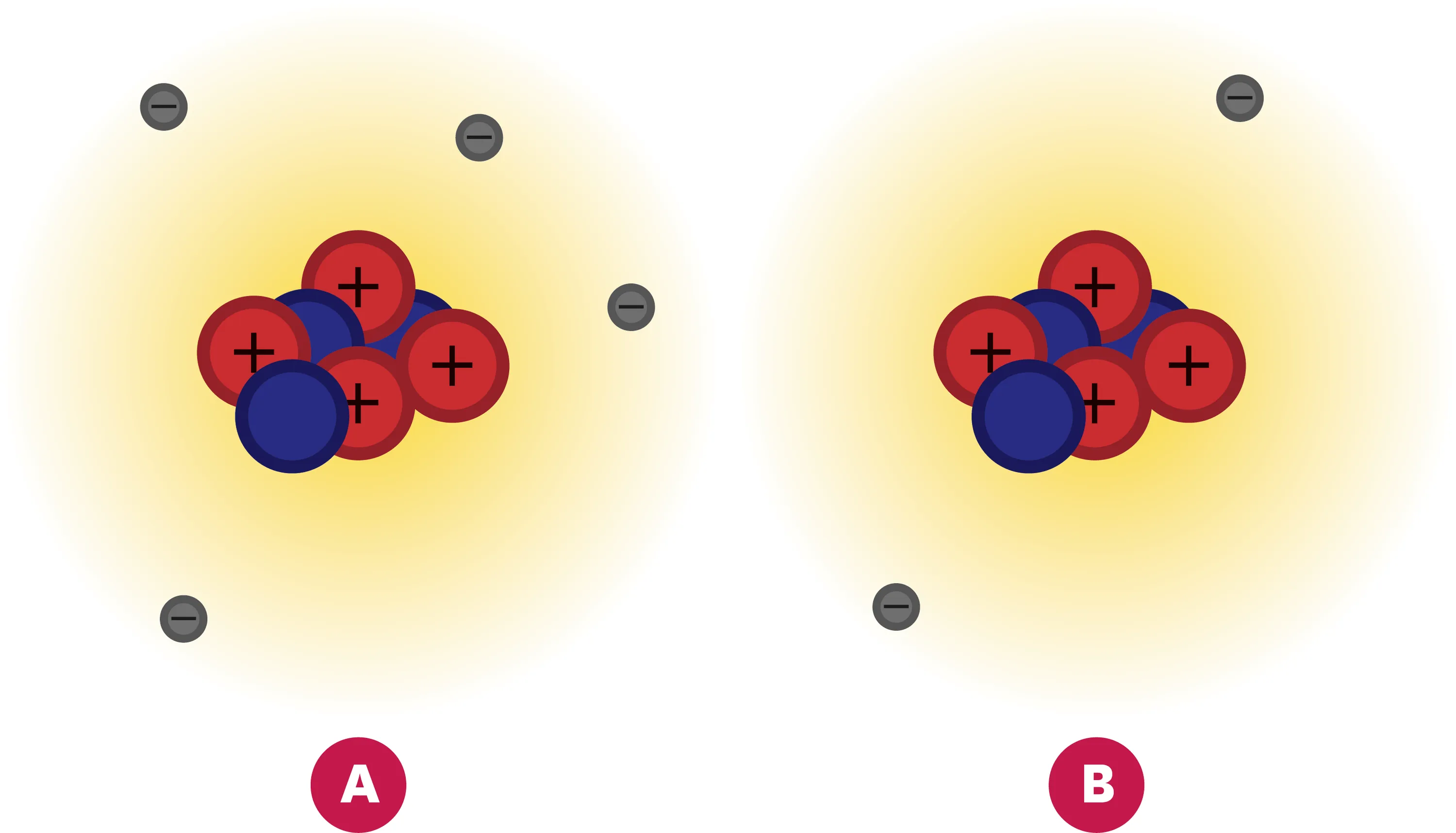
1. Quel schéma ci-dessous représente un atome ? Quel schéma représente un ion ?


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25Quelques précisions sur l'atome.
« [Les composants du noyau] s'entourent d'un cortège d'électrons dont la charge compense exactement celle [du noyau]. En effet, la matière est neutre sinon elle [serait instable] en raison de la répulsion qu'exercent l'une sur l'autre des charges de même signe, positif ou négatif. [...] Le diamètre d'un atome est voisin d'un centième de millionième de centimètre. Celui d'un noyau d'atome est cent mille fois plus petit. »
Extrait de La vie à fil tendu de Georges Charpak (1924-2010 ; prix Nobel de Physique 1992).
1. D'après le texte de Georges Charpak, qu'est-ce qui justifie qu'il y ait autant de protons que d'électrons dans un atome ?
2. À l'aide des données du texte, retrouve la dimension d'un atome (en m), à partir du produit de trois puissances de 10.
3. De la même façon, retrouve la dimension du noyau atomique (en m) à partir d'une fraction de deux puissances de 10.
Extrait de La vie à fil tendu de Georges Charpak (1924-2010 ; prix Nobel de Physique 1992).
1. D'après le texte de Georges Charpak, qu'est-ce qui justifie qu'il y ait autant de protons que d'électrons dans un atome ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26Évalue le nombre d'atomes d'un objet.
Compétence
Pratiquer le calcul numérique et le calcul littéral
1. Calcule le nombre d'atomes de carbone qu'il faut aligner pour tracer un trait de 20 cm, en utilisant les puissances de 10.
Donnée : rayon d'un atome de carbone : 0,070 nm
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27Interactions entre particules chargées.
Recopie et complète les schémas ci-dessous.Représente l'attraction entre les charges électriques par des flèches partant des particules chargées et les répulsions par d'autres flèches.




Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
28La famille, c'est sacré.
Dans le tableau périodique, les atomes d'une même colonne ont des propriétés physiques et chimiques similaires. On dit qu'ils appartiennent à une même famille chimique.
1. Fais une recherche pour savoir quels sont les trois métaux utilisés depuis l'Antiquité pour fabriquer des bijoux, des pièces de monnaie ou des objets précieux.
2. Détermine leur symbole chimique à l'aide du tableau périodique des éléments.
3. Que peux-tu dire au sujet de ces trois métaux grâce à leur position dans le tableau périodique des éléments ?


1. Fais une recherche pour savoir quels sont les trois métaux utilisés depuis l'Antiquité pour fabriquer des bijoux, des pièces de monnaie ou des objets précieux.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je résous un problème
Compétence : Pratiquer le calcul numérique et le calcul littéral.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Un même numéro atomique Z peut correspondre à différents atomes qui différent par leur nombre de neutrons. Dans le tableau périodique tel qu'il est présenté au lycée, le nombre de protons est indiqué en indice à gauche du symbole de l'atome. Un deuxième nombre placé en exposant à gauche indique le nombre de nucléons, c'est-à-dire le total des particules contenues dans le noyau.
Calcule la masse des deux atomes de carbone présentés dans le Doc. 3. Détaille ensuite leurs points communs et leurs différences.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Principe de la datation au carbone 14.
La datation au carbone 14 est utilisée en archéologie pour mesurer l'âge d'organismes végétaux ou animaux.
Tout organisme vivant contient une proportion constante de carbone 14 par rapport au carbone 12 qui est le plus abondant (99 %). Lorsqu'il meurt, la proportion de carbone 14 dans l'organisme diminue par un phénomène physique appelé radioactivité. En mesurant la nouvelle proportion entre les deux sortes de carbone, on peut dater l'organisme.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Masses des composants de l'atome.
(masse d'un neutron ≈ masse d'un proton = 1,6 × 10−27 kg ; masse d'un électron = 9,1 × 10−31 kg).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Description de la composition des atomes de carbone 12 (de symbole 12C) et carbone (de symbole 14C).

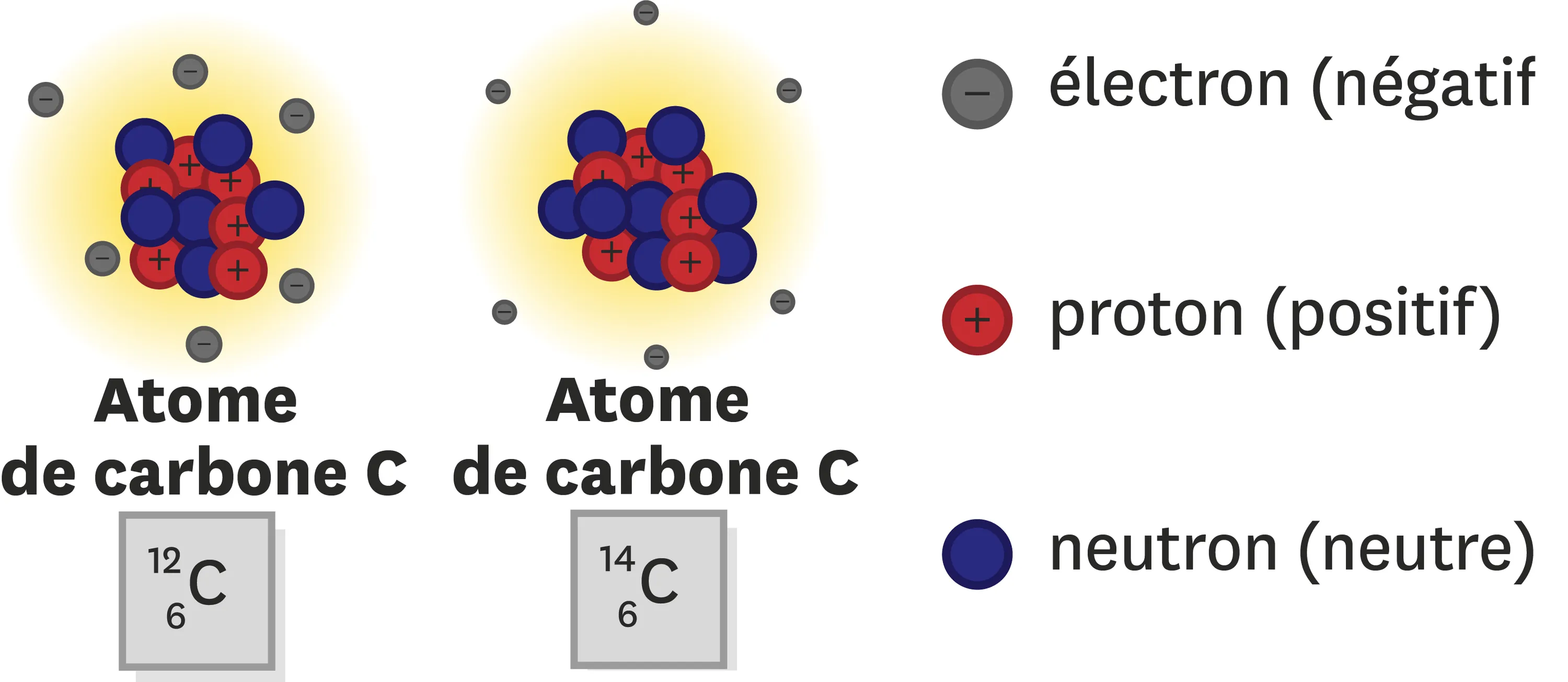
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercices supplémentaires
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
29As-tu retenu ?
1. Le Big Bang a eu lieu il y a :
2. Un atome est constitué...
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30Un peu d'Histoire des Sciences.
Lorsque S. Mendeleiev publie le premier tableau périodique des éléments chimiques, il sait prévoir, grâce à celui-ci, les propriétés physique et chimiques d'éléments manquants dans le tableau car encore inconnus. La suite lui a donné raison, puisque les cases manquantes ont été comblées par des découvertes ultérieures.Au XIXème et au XXème siècle, la découverte de nouveaux éléments chimiques, conjointement à l'explication des phénomènes physiques observés, ont fait faire un bon extraordinaire à la science sans lequel les moyens de communication actuels n'existeraient pas, pas plus que certaines sources d'énergie.Dans le domaine de la radioactivité, les travaux de Pierre et Marie Curie ont fait date, complétant même le tableau périodique des éléments.


1. Fais des recherches biographiques sur Marie Curie.
2. Quelle est sa particularité de Marie Curie en terme de reconnaissance scientifique ?
3. Donne le numéro atomique et le symbole des éléments dont elle a découvert l'existence.
4. Les éléments radioactifs du tableau périodique des éléments sont parmi les plus lourds. Les phénomènes radioactifs observés avec les deux éléments découverts par Marie Curie sont-ils justifiés selon ce critère ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31Le rôle des neutrons.
« [Une] répulsion [s]'exerce l'une sur l'autre [entre] des charges de même signe, positif ou négatif. »
À fil tendu, George Charpak (1924-2010, Prix Nobel de Physique 1992). Les particules de charge électrique positive dans le noyau de l'atome sont appelées protons, mais elles ne pourraient pas tenir ensemble dans le noyau sans la présence des neutrons, particules électriquement neutres, qui ont sensiblement la même masse qu'un proton (1,67 × 10-27 kg).
1. D'après l'extrait de texte présent dans l'énoncé, pour quelle raison la matière serait-elle instable sans la présence des neutrons ?
À fil tendu, George Charpak (1924-2010, Prix Nobel de Physique 1992). Les particules de charge électrique positive dans le noyau de l'atome sont appelées protons, mais elles ne pourraient pas tenir ensemble dans le noyau sans la présence des neutrons, particules électriquement neutres, qui ont sensiblement la même masse qu'un proton (1,67 × 10-27 kg).
1. D'après l'extrait de texte présent dans l'énoncé, pour quelle raison la matière serait-elle instable sans la présence des neutrons ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Parcours de compétences
Compétence : Effectuer des recherches documentaires.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
La première exoplanète a été découverte en 1995. De nombreuses autres ont été découvertes depuis. Le télescope Kepler lancé en 2009 a fait prendre une ampleur particulière à cette chasse aux exoplanètes.
- Le télescope Képler permet la recherche d'un type particulier d'exoplanètes. Précise lequel et recherche les raisons de cet intérêt.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 1
Je connais différents outils de recherches.
Coup de pouce
Comment peux-tu trouver des informations sur les exoplanètes ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 2
J'identifie les informations utiles proposées par un document.
Coup de pouce
Dans un document sur les exoplanètes, relève les informations liées aux catégories recensées. Laquelle est plus fréquemment évoquée que les autres ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 3
Je collecte les informations utiles en vérifiant la fiabilité de mes sources.
Coup de pouce
Les informations que tu as trouvées répondent-elles bien à la question ? Les sites que tu as consultés mentionnent-ils leur source ? L'auteur est-il identifiable ? Retrouves-tu les mêmes informations sur d'autres sites ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 4
Je trie de façon pertinente les informations issues de ma recherche en vérifiant la fiabilité de mes sources.
Coup de pouce
Explique ce qui rend les recherches du satellite Kepler importantes.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

