Chapitre 4
Exercices
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je me teste
Je sais
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Lorsqu'on mélange du sel avec de l'eau, celle-ci est :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Lorsqu'on mélange du sucre avec de l'eau, on réalise :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Lorsqu'on ne peut plus dissoudre de soluté dans un volume donné de solvant, on dit que la solution est :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
4Deux liquides miscibles forment un mélange :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5Qui est qui ?
Relie chaque mot à sa définition.
| Solution | |
| Solvant | |
| Soluté |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6Complète la grille de mots-croisés.
Vertical :
1. Masse maximale de soluté peut être dissoute
dans un litre de solution.
2. Se dit de deux liquides dont le mélange est homogène.
3. État physique du solvant.
Horizontal :
4. Mélange dont on ne distingue pas les différents constituants à l'oeil nu.
5. Mélange homogène d'un solvant et d'un soluté.
6. Se dit d'une solution pour laquelle le seuil de solubilité est atteint.
1. Masse maximale de soluté peut être dissoute
dans un litre de solution.
2. Se dit de deux liquides dont le mélange est homogène.
3. État physique du solvant.
Horizontal :
4. Mélange dont on ne distingue pas les différents constituants à l'oeil nu.
5. Mélange homogène d'un solvant et d'un soluté.
6. Se dit d'une solution pour laquelle le seuil de solubilité est atteint.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je sais faire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7Pour déterminer expérimentalement une solubilité, il faut ajouter le soluté dans un volume donné de solvant :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8Attribue à chaque situation une ou plusieurs applications qui lui convient :

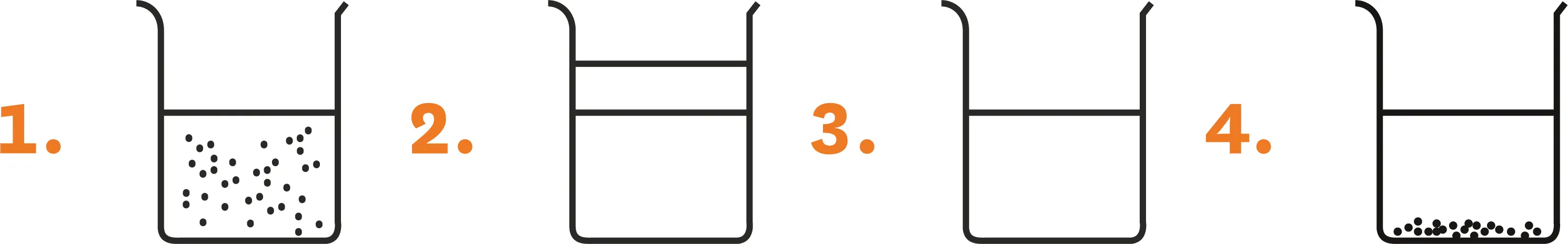
1.
2.
2.
3.
4.
4.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercice corrigé
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Compétence : Présenter mon résultat avec l'unité adaptée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9Déterminer une solubilité.
Caroline souhaite mesurer la solubilité du sel dans l'eau. Pour cela, elle a préparé un verre contenant un volume V = 150 mL d'eau. Petit à petit, en agitant entre chaque ajout, elle a réussi à y dissoudre une masse m = 53,7 g de sel. L'ajout de sel suivant qu'elle a fait ne s'est pas dissout.
1. Détermine par le calcul la solubilité du sel dans l'eau en g/L.
1. Détermine par le calcul la solubilité du sel dans l'eau en g/L.


Solubilité du sel
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Étapes de la méthode
1. Pour obtenir la solubilité en g/L, il faut convertir le volume en L.
2. Pour convertir les unités de volume, on utilise un tableau de conversion des volumes.
3. Pour calculer la solubilité, on utilise un tableau de proportionnalité.
m'= \dfrac{A \times C}{B}
2. Pour convertir les unités de volume, on utilise un tableau de conversion des volumes.
| m3 | dm3 | cm3 | ||||||
| hL | daL | L | dL | cL | mL | |||
| 0 | 1 | 5 | 0 | |||||
| Masse en gramme | A | m' ? |
| Volume en litre | B | C |
m'= \dfrac{A \times C}{B}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Corrigé
1. La solubilité s'exprime en g/L, or ici on a m = 53,7 g et V = 150 mL. Il faut donc convertir les unités de volume :
V = 150 mL soit V = 0,150 L.
2. La solubilité correspond à la masse en grammes de soluté dissoute dans un litre de solution, la masse et le volume sont donc proportionnels.
3. Calcul de la masse m' de soluté dissoute dans 1 L de solution :
m' = \dfrac{53\text{,}7 \times 1}{0\text{,}150}
m' = 358 g.
4. La solubilité du sel dans l'eau est donc de 358 g/L.
V = 150 mL soit V = 0,150 L.
2. La solubilité correspond à la masse en grammes de soluté dissoute dans un litre de solution, la masse et le volume sont donc proportionnels.
3. Calcul de la masse m' de soluté dissoute dans 1 L de solution :
m' = \dfrac{53\text{,}7 \times 1}{0\text{,}150}
m' = 358 g.
4. La solubilité du sel dans l'eau est donc de 358 g/L.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercice similaire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10
Solubilité du glucose.
Anita n'a pas réussi à dissoudre 180 g de glucose, un sucre utilisé en pâtisserie, dans 200 mL d'eau.
1. Détermine par le calcul la solubilité du glucose dans l'eau.
1. Détermine par le calcul la solubilité du glucose dans l'eau.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je m'entraine
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11
Soluble ou pas.
Compétence
Interpréter des résultats
Regarde bien les photos ci-dessous.


1. Le mélange de la photographie 1 est-il un mélange homogène ou hétérogène ?
2. Le sucre est-il soluble dans l'eau ?
3. Le mélange de la photographie 2 est-il un mélange homogène ou hétérogène ?
4. Le sucre est-il soluble dans l'alcool ?
2. Le sucre est-il soluble dans l'eau ?
3. Le mélange de la photographie 2 est-il un mélange homogène ou hétérogène ?
4. Le sucre est-il soluble dans l'alcool ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12
Marée noire.
Quand un bateau qui transporte du pétrole fait naufrage, le risque principal est la formation d'une marée noire. Le pétrole peut s'échapper des soutes du bateau et s'étaler à la surface de la mer, polluant la faune et la flore maritime.
1. L'eau de mer et le pétrole forment-ils un mélange homogène ou hétérogène ? Justifie ta réponse.
2. L'eau de mer et le pétrole sont-ils miscibles ?
1. L'eau de mer et le pétrole forment-ils un mélange homogène ou hétérogène ? Justifie ta réponse.
2. L'eau de mer et le pétrole sont-ils miscibles ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13
Quelle masse de lait au miel pour Kemal ?
Pour s'endormir, on dit qu'il faut boire un verre de lait sucré avec du miel au moment du coucher. Kemal se demande quelle sera la masse de sa boisson avant d'aller au lit : il a mis 200 g de lait dans une tasse et a rajouté 30 g de miel.
1. Calcule la masse de la boisson de Kemal.
1. Calcule la masse de la boisson de Kemal.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14
Paracétamol
Compétence
Interpréter des résultats
Le paracétamol est un médicament contre la fièvre et les douleurs. Sur la boite, il est indiqué : « Boire après dissolution complète dans un verre d'eau ».


1. Regarde la photographie obtenue après une longue agitation. Le mélange est-il homogène ou hétérogène ?
2. Le paracétamol est-il soluble ou insoluble dans l'eau ?
3. L'expression « dissolution complète » écrite sur la boite est-elle adaptée ?
2. Le paracétamol est-il soluble ou insoluble dans l'eau ?
3. L'expression « dissolution complète » écrite sur la boite est-elle adaptée ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15
Le sirop, l'eau et l'huile
On a préparé les trois mélanges ci-dessous.

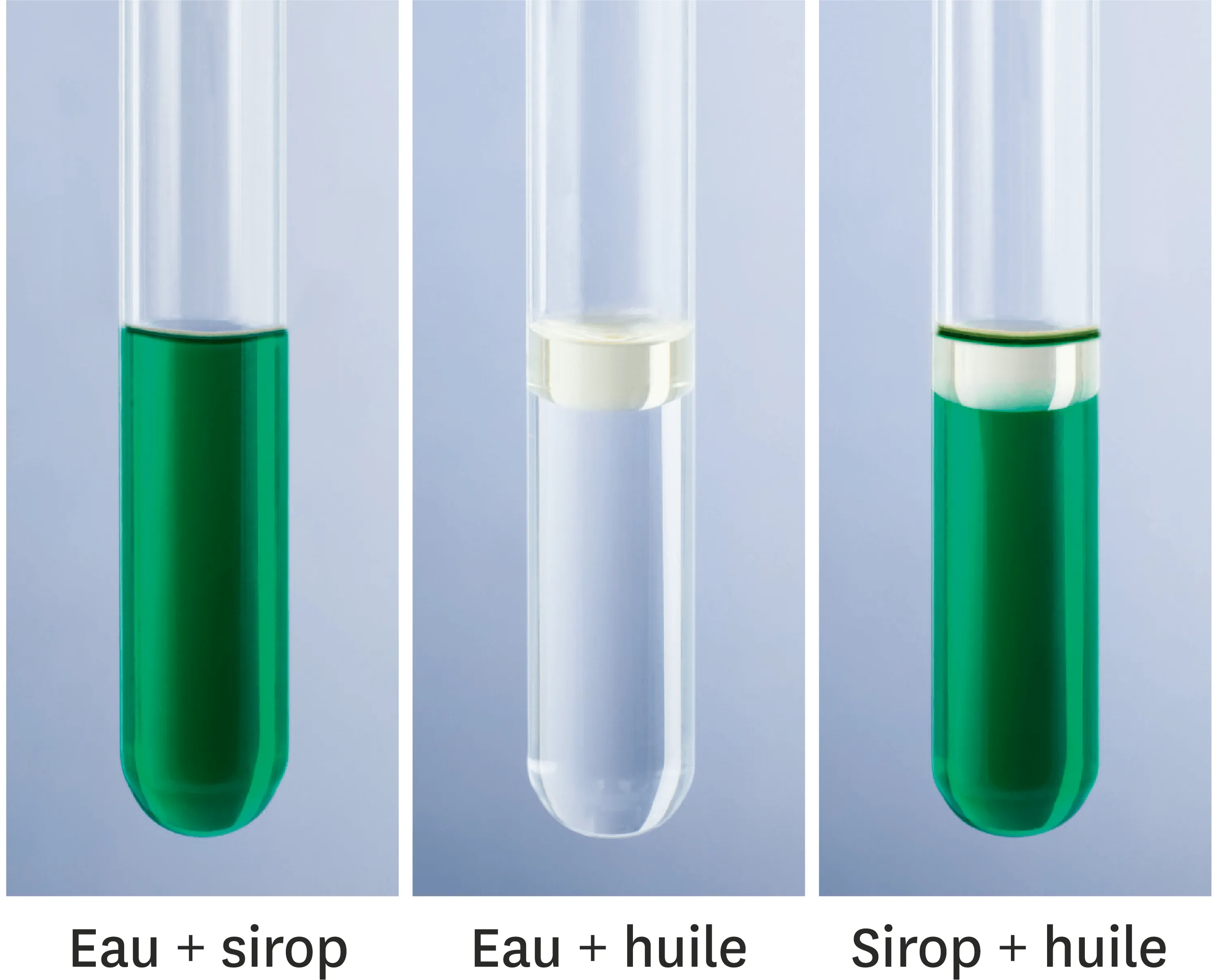


1. L'eau et le sirop de menthe sont-ils miscibles ? Justifie ta réponse.
2. L'eau et l'huile sont-elles miscibles ? Justifie ta réponse.
3. Le sirop et l'huile sont-ils miscibles ? Justifie ta réponse.
2. L'eau et l'huile sont-elles miscibles ? Justifie ta réponse.
3. Le sirop et l'huile sont-ils miscibles ? Justifie ta réponse.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16
Le baume pour les lèvres
On peut fabriquer un baume à lèvres en mélangeant à chaud 2,1 g de cire d'abeille, 2,3 g d'huile de calendula, 2,2 g de beurre de karité et quelques gouttes d'huile essentielle de citron. Après refroidissement, on obtient le baume présenté ci-contre.




1. Les substances qui constituent le baume sont-elles miscibles entre elles ?
2. Quelle est la masse du baume obtenu si on néglige les gouttes d'huile essentielle ?
2. Quelle est la masse du baume obtenu si on néglige les gouttes d'huile essentielle ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Compétence : Pratiquer le calcul numérique et le calcul littéral.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Identifier une substance grâce à sa solubilité. Du sucre ou du sel ?
Émeline a fait des expériences sur la dissolution du sel et du sucre. Elle a noté sur une fiole la masse de la poudre qu'elle a réussi à y dissoudre (1,5 g dans 250 mL d'éthanol) et les valeurs de solubilité finalement obtenues. Elle veut maintenant retrouver quel soluté elle a dissout.
1. Exprime en litres (L) le volume d'éthanol qui a servi à préparer la solution de la fiole marquée.
2. Les substances qui constituent le baume sont-elles miscibles entre elles ?
3. Complète le tableau de proportionnalité suivant :
4. Quelle est la masse du baume obtenu si on néglige les gouttes d'huile essentielle ?
5. Détermine, à l'aide du tableau de proportionnalité, la solubilité de la première espèce dissoute dans l'éthanol.
6. Compare la valeur que tu as calculée avec les valeurs indiquées dans le tableau des solubilités.
7. Déduis-en l'espèce chimique dissoute dans la fiole.
| Soluté | Sel de table | Sucre |
| Solubilité en g/L | 0,7 | 6 |
1. Exprime en litres (L) le volume d'éthanol qui a servi à préparer la solution de la fiole marquée.
2. Les substances qui constituent le baume sont-elles miscibles entre elles ?
3. Complète le tableau de proportionnalité suivant :
| Masse en gramme |
|
|
| Volume en litre |
| 1 |
4. Quelle est la masse du baume obtenu si on néglige les gouttes d'huile essentielle ?
5. Détermine, à l'aide du tableau de proportionnalité, la solubilité de la première espèce dissoute dans l'éthanol.
6. Compare la valeur que tu as calculée avec les valeurs indiquées dans le tableau des solubilités.
7. Déduis-en l'espèce chimique dissoute dans la fiole.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Identifier une substance grâce à sa solubilité. Ne pas se tromper de pot !
Le sel et le bicarbonate ont le même aspect, le même gout, et sont stockés dans des pots identiques. Pour être sure de ne pas se tromper, Inès mesure la solubilité du contenu d'un des pots. Elle arrive à dissoudre 17,4 g de poudre dans 200 mL d'eau.
1. Exprime le volume dans l'unité adaptée.
2. Détermine par un calcul de proportionnalité la solubilité de la poudre dissoute, puis identifie-la.
| Soluté | Sel | Bicarbonate de soude |
| Solubilité en g/L | 357 | 87 |
1. Exprime le volume dans l'unité adaptée.
2. Détermine par un calcul de proportionnalité la solubilité de la poudre dissoute, puis identifie-la.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Identifier une substance grâce à sa solubilité. De quel soluté s'agit-il ?
Au laboratoire, Dan trouve un bocal contenant une poudre blanche. Il ne sait pas s'il s'agit de sucre, de sel ou de vanilline. Pour identifier cette poudre, il détermine expérimentalement sa solubilité. Il calcule une solubilité de 356 g/L.
1. Identifie la poudre trouvée par Dan.
| Soluté | Sucre (saccharose) | Sel | Vanilline |
| Solubilité en g/L | 2 000 | 356 | 10 |
1. Identifie la poudre trouvée par Dan.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
J'approfondis
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18Qui est le plus soluble ?
Compétence
Comprendre et interpréter des tableaux ou des documents graphiques.
On donne la solubilité de plusieurs espèces chimiques dans l'eau et dans l'éthanol.
1. Quelle est l'espèce la plus soluble dans l'eau ?
2. Quelle est l'espèce la plus soluble dans l'éthanol ?
3. Quelle espèce se dissout avec la même facilité dans l'eau et dans l'éthanol ?
| Soluté | Solubilité dans l'eau en g/L | Solubilité dans l'éthanol en g/L |
| Chlorure de sodium | 357 | 0,7 |
| Saccharose | 2 000 | 6 |
| Aspartame | 10 | 10 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19Solubilité du dioxygène dans l'eau.
Les gaz peuvent, comme les solides, se dissoudre dans l'eau. Leur solubilité est généralement faible : à 0 °C, on peut dissoudre 4,37 mg de dioxygène dans 300 mL d'eau ; à 25 °C, on dissout 3,7 mg de dioxygène dans 450 mL d'eau.
1. Calcule la solubilité du dioxygène dans l'eau à 0 °C puis à 25 °C.
2. Comment évolue cette solubilité avec la température ?
1. Calcule la solubilité du dioxygène dans l'eau à 0 °C puis à 25 °C.
2. Comment évolue cette solubilité avec la température ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20La masse du solvant.
Pour l'une de ses recettes, Sophie a besoin de 420 g d'un sirop fait à base d'eau et de sucre. Elle le prépare en dissolvant 80 g de sucre dans de l'eau.
1. Quelle masse d'eau a-t-elle utilisée pour préparer son sirop ?
2. À quel volume d'eau cela correspond-il ?
1. Quelle masse d'eau a-t-elle utilisée pour préparer son sirop ?
2. À quel volume d'eau cela correspond-il ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21Solubilité du diiode.
Le diiode est un solide soluble dans l'eau (eau iodée) et dans le cyclohexane. On met dans un tube à essai de l'eau iodée puis du cyclohexane (schéma A).

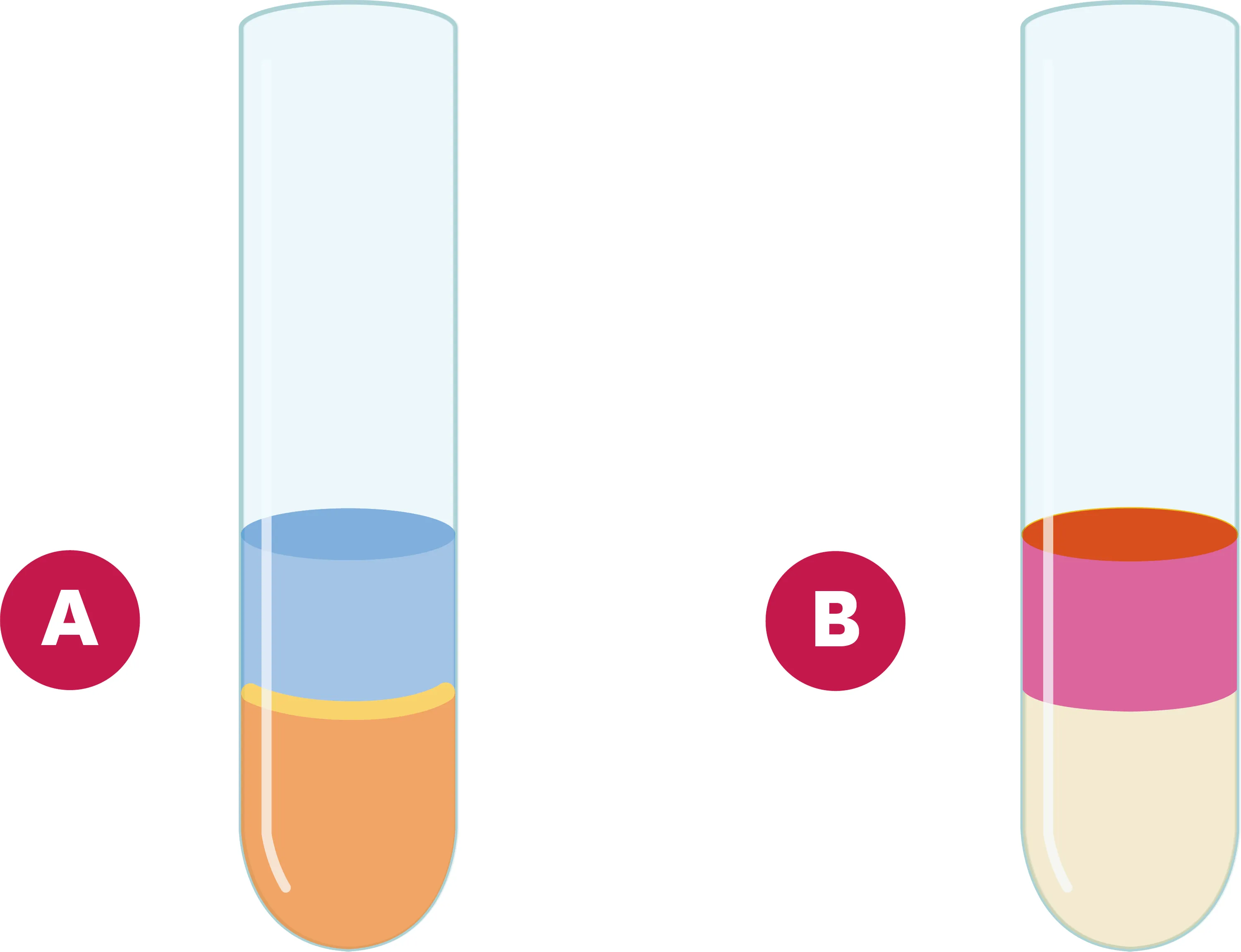
1. D'après le schéma A, l'eau et le cyclohexane sont-ils miscibles ?
2. Quelle est la couleur de l'eau iodée, placée en bas du tube ?
3. On agite le tube. Après séparation des liquides, on obtient la situation représentée sur le schéma B. Qu'observes-tu ? Comment expliquer cela ?
4. À ton avis, le diiode est-il davantage soluble dans l'eau ou dans le cyclohexane ?


1. D'après le schéma A, l'eau et le cyclohexane sont-ils miscibles ?
2. Quelle est la couleur de l'eau iodée, placée en bas du tube ?
3. On agite le tube. Après séparation des liquides, on obtient la situation représentée sur le schéma B. Qu'observes-tu ? Comment expliquer cela ?
4. À ton avis, le diiode est-il davantage soluble dans l'eau ou dans le cyclohexane ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22Mer Méditerranée et mer Morte.
La salinité (masse de sel dissout dans un litre de solution) de la mer Méditerranée est de 37 g/L, celle de la mer Morte de 300 g/L. La solubilité du sel dans l'eau pure est de 357 g/L.
1. Quelle mer est la plus salée ?
2. Caroline a des échantillons de 500 mL de ces deux eaux de mer. Pour chacun d'eux, quelle masse de sel doit-elle ajouter pour atteindre la saturation ?


1. Quelle mer est la plus salée ?
2. Caroline a des échantillons de 500 mL de ces deux eaux de mer. Pour chacun d'eux, quelle masse de sel doit-elle ajouter pour atteindre la saturation ?


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23Quelle solution est la plus sucrée ?
Marvin a préparé quatre solutions d'eau sucrée.
1. Classe ces solutions de la moins sucrée à la plus sucrée.
1. Classe ces solutions de la moins sucrée à la plus sucrée.
| Solution a : 10 g de sucre dans 100 mL d'eau | |
| Solution b : 20 g de sucre dans 100 mL d'eau | |
| Solution c : 10 g de sucre dans 200 mL d'eau | |
| Solution d : 20 g de sucre dans 200 mL d'eau | |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24Sulfate de zinc.
Compétence
Mettre en oeuvre un raisonnement logique simple pour résoudre un problème.
Clara prépare une solution saturée de sulfate de zinc pour traiter du cuir. La solubilité du sulfate de zinc est de 540 g/L. Pour préparer 15 mL de solution, Clara a pesé 9,8 g de sulfate de zinc.
1. Même en agitant longtemps, il reste des grains de sulfate de zinc non dissouts. Explique pourquoi.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25Purification de l'acide benzoïque.
La recristallisation est une méthode de purification des composés basée sur la différence de solubilité de ces derniers en fonction de la température. On mélange 68 g d'acide benzoïque avec 1 L d'eau et on chauffe à 100 °C (schéma A). On laisse descendre la température doucement au début, puis on place le mélange dans un bain-marie de glace (schéma B).

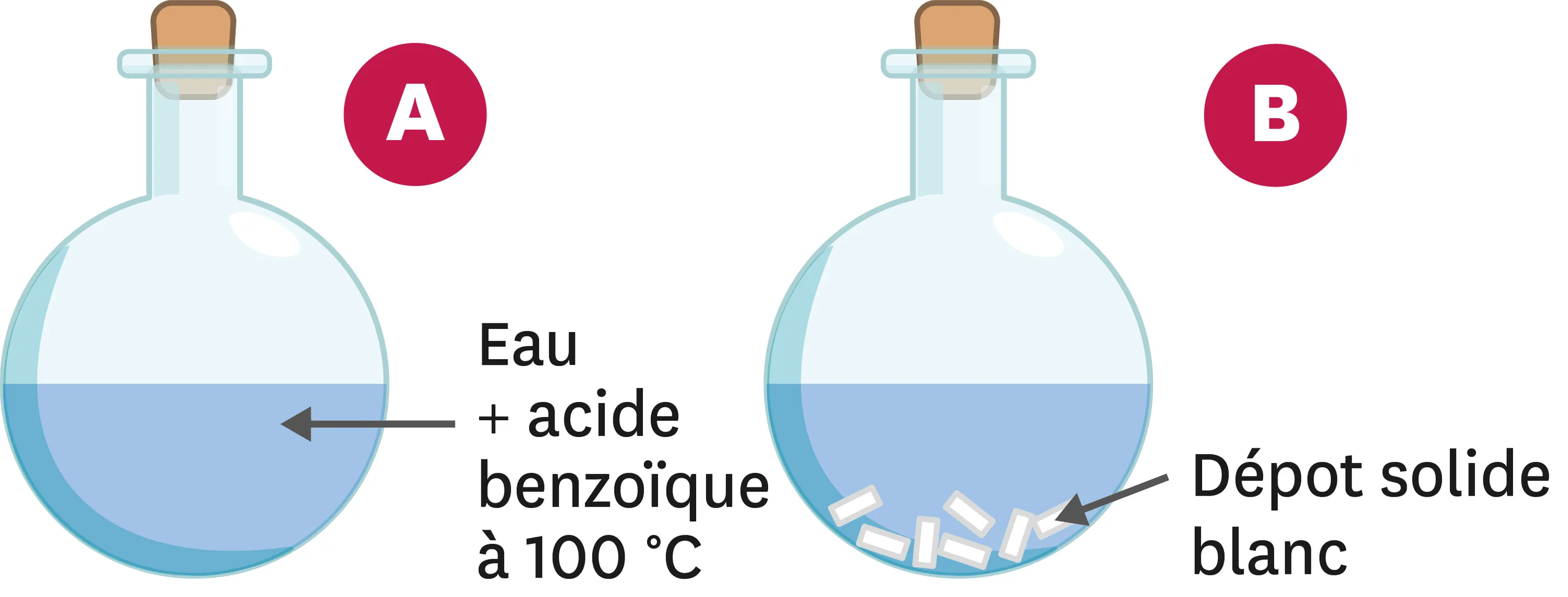


1. À 100 °C, comment peut-on qualifier le mélange obtenu ?
2. À 0 °C, qu'observes-tu dans le ballon ?
3. Que peux-tu en déduire concernant la solubilité de l'acide benzoïque dans l'eau en fonction de la température ?
2. À 0 °C, qu'observes-tu dans le ballon ?
3. Que peux-tu en déduire concernant la solubilité de l'acide benzoïque dans l'eau en fonction de la température ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26Que de mélanges !
On a réalisé les mélanges suivants.

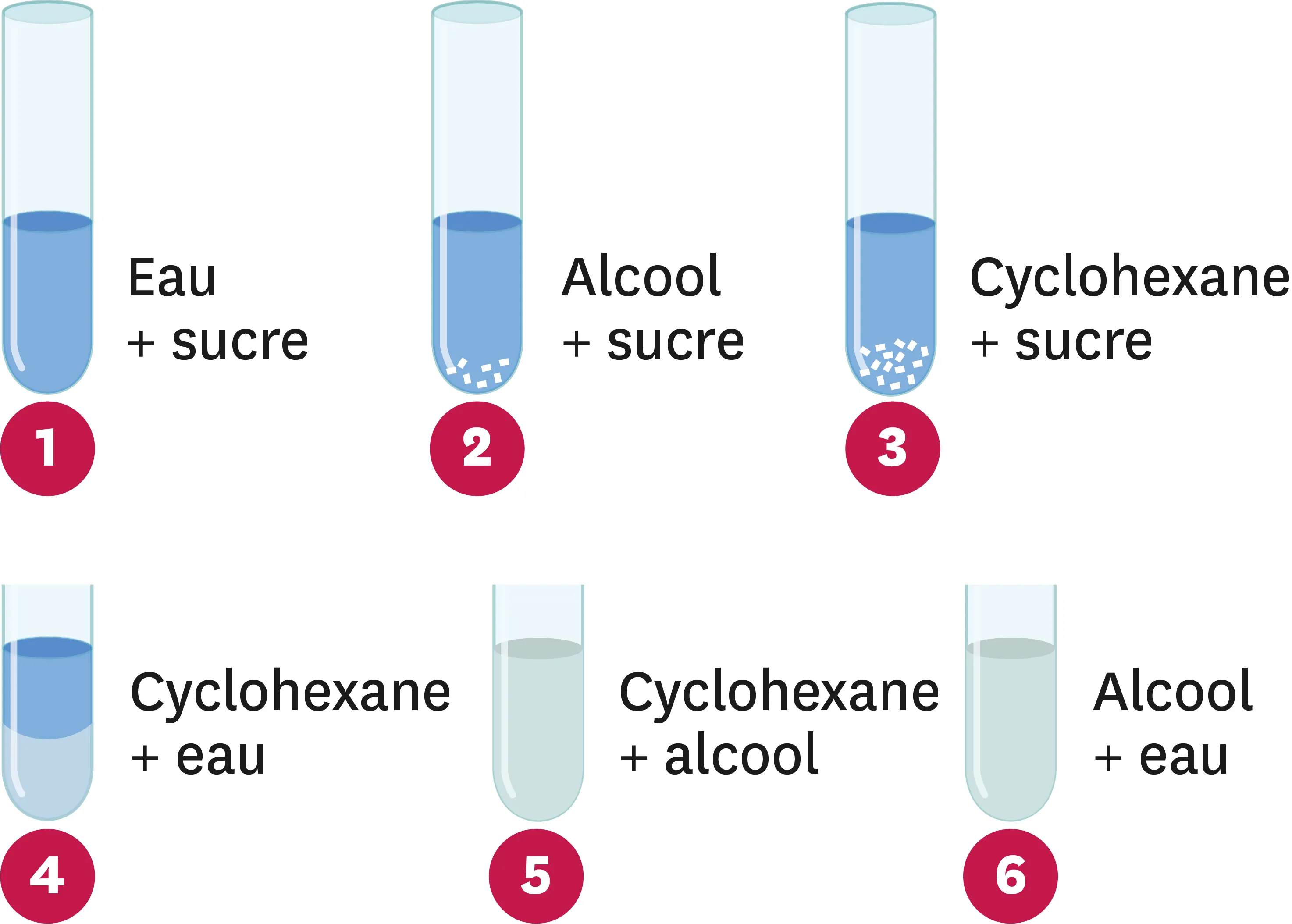


1. Quels sont les mélanges homogènes ?
2. Quels sont les mélanges hétérogènes ?
3. Que peux-tu en déduire sur la miscibilité deux à deux de ces trois liquides ? Justifie ta réponse.
4 Que peux-tu en déduire sur la solubilité du sucre dans ces trois liquides ? Justifie ta réponse.
5 On ajoute le mélange 1 au mélange 2. Que dois-tu observer ? Justifie ta réponse.
6. On fait de même avec les mélanges 1 et 3, puis 2 et 3. Que devrais-tu observer ? Justifie tes réponses.
2. Quels sont les mélanges hétérogènes ?
3. Que peux-tu en déduire sur la miscibilité deux à deux de ces trois liquides ? Justifie ta réponse.
4 Que peux-tu en déduire sur la solubilité du sucre dans ces trois liquides ? Justifie ta réponse.
5 On ajoute le mélange 1 au mélange 2. Que dois-tu observer ? Justifie ta réponse.
6. On fait de même avec les mélanges 1 et 3, puis 2 et 3. Que devrais-tu observer ? Justifie tes réponses.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27Déjà saturé ?
Théo a appris dans sa leçon que la solubilité du chlorure de sodium (le sel de cuisine) est de 358,5 g/L. Il voudrait savoir si cette solubilité reste la même quand l'eau dissout déjà un autre soluté. Il trouve au collège un litre de solution aqueuse contenant 74,5 g de chlorure de potassium. Dans 160 mL de cette solution, il arrive à dissoudre au plus 52,32 g de chlorure de sodium.
1. Calcule la solubilité du sel dans la solution trouvée au collège.
2. La solubilité est-elle la même que dans l'eau pure ? Que peux-tu en conclure ?
1. Calcule la solubilité du sel dans la solution trouvée au collège.
2. La solubilité est-elle la même que dans l'eau pure ? Que peux-tu en conclure ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je résous un problème
Compétence : Mettre en oeuvre un raisonnement logique simple pour résoudre un problème.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Sabine vient de découvrir une nouvelle gourmandise : le chocolat pétillant !
Pourquoi le gaz est-il libéré dans la bouche et non au moment où le sucre est mélangé au chocolat ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Composition de la salive et du chocolat.
| Chocolat pour 100 g | Salive pour 100 g | |
| Sucres | 57 g | 0 g |
| Lipides (huile | 33,3 g | 0 g |
| Protéines | 7,6 g | moins de 1 g |
| Eau | 0 g | 99 g |
| Autres | 3,1 g | moins de 1 g |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Une nouvelle friandise.
Le chocolat pétillant est obtenu en mélangeant du chocolat fondu avec du sucre pétillant. L'ensemble est placé dans des petits moules et mis à refroidir.
Lorsque le chocolat pétillant fond dans la bouche, le gaz est libéré.
Lorsque le chocolat pétillant fond dans la bouche, le gaz est libéré.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercices supplémentaires
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
28Dissolution.
Lors d'une dissolution, à l'échelle microscopique...
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
29Décrire une dissolution à l'échelle microscopique.
À l'aide des mots indiqués ci-dessous, rédige une phrase expliquant ce qu'il se passe à l'échelle microscopique lors d'une dissolution.
molécules - dissolution - solvant - soluté - nombre - nature - identiques
molécules - dissolution - solvant - soluté - nombre - nature - identiques
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30Dissolution et aspect microscopique.
Guillaume dissout complètement 30 g de chlorure de sodium (sel pur) dans 200 mL d'eau pure.
1. Combien de corps purs sont présents dans ce mélange ?
2. Est-ce un mélange homogène ou hétérogène ?
3. Dessine une représentation à l'échelle microscopique de ce mélange. Légende ton schéma.
1. Combien de corps purs sont présents dans ce mélange ?
2. Est-ce un mélange homogène ou hétérogène ?
3. Dessine une représentation à l'échelle microscopique de ce mélange. Légende ton schéma.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31Liquides non miscibles et aspect microscopique.
On mélange de l'eau et de l'huile, on obtient un mélange hétérogène.


1. Combien de sortes de molécules sont présentes dans le mélange ?
2. Dessine une représentation de ce mélange à l'échelle microscopique. Légende ton schéma.


1. Combien de sortes de molécules sont présentes dans le mélange ?
2. Dessine une représentation de ce mélange à l'échelle microscopique. Légende ton schéma.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
32Conservation de la masse.
Caroline a étudié en cours de chimie que lors d'une dissolution, la masse de la solution est égale à la somme de la masse du solvant et de la masse du soluté.Elle aimerait modéliser cette propriété à l'aide de molécules lors de la dissolution de sel dans l'eau.
1. Représente le sel à l'échelle moléculaire. Tu peux choisir n'importe quelle représentation.
2. Représente l'eau à l'échelle moléculaire.
3. Représente le mélange du sel et de l'eau.
1. Représente le sel à l'échelle moléculaire. Tu peux choisir n'importe quelle représentation.
2. Représente l'eau à l'échelle moléculaire.
3. Représente le mélange du sel et de l'eau.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
33Quelle masse mesurer ?
Pour ses travaux pratiques de chimie, Thomas doit préparer 600 mL d'une solution saturée de chlorure de zinc.Il connaît la solubilité du chlorure de zinc dans l'eau : 4 320 g/L.
1. Détermine par le calcul la masse de chlorure de zinc que Thomas va devoir peser pour préparer 600 mL de solution saturée en chlorure de zinc.
1. Détermine par le calcul la masse de chlorure de zinc que Thomas va devoir peser pour préparer 600 mL de solution saturée en chlorure de zinc.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
34Conservation de la masse. Et le volume ?
Un morceau de sucre a une masse msucre = 6 g et ses dimensions sont les suivantes : L = 2,7 cm ; l = 1,8 cm ; h = 1,2 cm.Thomas dissout 4 morceaux de sucre dans son verre de lait (Vlait = 200 mL et mlait = 206,4 g).Le volume total Vlait+sucre qu'il mesure est de 210 mL.
1. Détermine par le calcul la masse du lait sucré.
2. Détermine par le calcul le volume d'un sucre, puis de 4 sucres.
3 Le volume se conserve t-il lors d'une dissolution ?
1. Détermine par le calcul la masse du lait sucré.
2. Détermine par le calcul le volume d'un sucre, puis de 4 sucres.
3 Le volume se conserve t-il lors d'une dissolution ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
35Soluté, solvant et solution.
On réalise les mélanges suivants :- eau avec du dioxyde de carbone ;- sucre avec du café ;- vinaigre et sel.
1. Dans chaque cas, identifie le soluté, le solvant et la solution.
1. Dans chaque cas, identifie le soluté, le solvant et la solution.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
36Ça mousse !
Quand on frotte un savon sous l'eau, il mousse. Cette mousse se forme par la réaction de la matière qui constitue le savon avec l'eau. Il se forme des bulles d'air qui sont emprisonnées dans la matière.


1. De quoi est formée la mousse ?
2. Comment qualifier ce mélange ?
3. Que devient la mousse au bout d'un moment ? Comment expliquer cela ?


1. De quoi est formée la mousse ?
2. Comment qualifier ce mélange ?
3. Que devient la mousse au bout d'un moment ? Comment expliquer cela ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
37Des mélanges et des condiments.
Guillaume et Caroline s'amusent à réaliser des mélanges.Guillaume mélange de l'eau avec du poivre, Caroline de l'eau avec du sel.
1. Comment se nomment ces "préparations" ?
2. Quels sont les points communs de ces deux “préparations” ? Quels sont les différences ?
3. Nomme, avec le vocabulaire adapté, ces deux “préparations”.
1. Comment se nomment ces "préparations" ?
2. Quels sont les points communs de ces deux “préparations” ? Quels sont les différences ?
3. Nomme, avec le vocabulaire adapté, ces deux “préparations”.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Parcours de compétences
Compétence : Interpréter des résultats.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Kaolack est une ville du Sénégal à environ 180 km au sud de la capitale, Dakar. La ville est située sur un bras de mer. On y trouve encore des marais salants. Lorsque le temps est sec, l'eau s'évapore et on observe le résultat ci-contre.
L'eau de mer de ce marais salant est-elle saturée en sel ?
L'eau de mer de ce marais salant est-elle saturée en sel ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 1
J'identifie les résultats obtenus.
Coup de pouce
Observe bien la photographie et décris la surface de l'eau.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 2
Je donne du sens aux résultats.
Coup de pouce
Vérifie que tu connais bien le sens des mots scientifiques utilisés dans la question pour orienter ton observation.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 3
Je présente les idées qui permettent d'expliquer les résultats.
Coup de pouce
Pourquoi le sel visible ne se dissout-il pas ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 4
J'interprète mes résultats en structurant mes arguments.
Coup de pouce
Fais le lien entre ton cours et ton observation, puis organise ta réponse.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

