Physique-Chimie Cycle 4
Mes Pages
Thème 1 - Organisation et transformations de la matière
Ch. 1
L'eau que nous buvons est-elle pure ?
Ch. 2
La matière : états, masse et volume
Ch. 3
Les changements d'état de la matière
Ch. 4
Les mélanges
Ch. 5
La matière à l'échelle microscopique
Ch. 6
Que trouve-t-on dans l'air ?
Ch. 7
Les transformations chimiques et la pollution
Ch. 8
Modélisation des transformations chimiques
Ch. 9
Les ions dans notre quotidien
Ch. 10
Quand les acides et les bases réagissent
Ch. 11
Introduction à la masse volumique
Ch. 12
La masse volumique
Ch. 13
La matière, dans l'espace et dans l'Univers
Ch. 14
De l'Univers aux atomes
Thème 2 - Mouvement et interactions
Ch. 15
Introduction à la vitesse et au mouvement
Ch. 16
Repérage de mouvement et mesure de vitesse
Ch. 17
Vitesse et mouvement
Ch. 18
Les interactions
Ch. 19
Les forces
Ch. 20
Le poids
Thème 3 - L'énergie et ses conversions
Ch. 21
Introduire la notion d'énergie
Ch. 22
Conversion et transfert de l'énergie
Ch. 23
La conservation de l'énergie
Ch. 24
Les circuits électriques
Ch. 25
La tension et l'intensité
Ch. 26
Relations entre grandeurs dans les circuits électriques
Ch. 27
Résistance et loi d'Ohm
Ch. 28
Puissance et énergie en électricité
Thème 4 - Des signaux pour observer et communiquer
Ch. 29
Le son
Ch. 30
La lumière
Ch. 31
Vitesse de propagation des signaux
Ch. 32
Des signaux au-delà de la perception humaine
Chapitre 3
Exercices
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je me teste
Je sais
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Une combustion est :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Une combustion du butane est incomplète :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Lors d'une transformation chimique, la masse totale :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
4Au cours d'une transformation chimique, les espèces :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5Un gaz dangereux pour la santé.
1. Trouve l'intrus dans la liste suivante.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6Complète la grille de mots-croisés. Pour écrire sur ce schéma, veuillez cliquer sur l'image et utiliser notre outil de dessin.
Horizontal :
3. Corps dont la quantité augmente lors d'une transformation chimique.
4. Corps dont la quantité diminue au cours d'une combustion.
5. Lors de sa combustion, le carbone en est un exemple.
3. Corps dont la quantité augmente lors d'une transformation chimique.
4. Corps dont la quantité diminue au cours d'une combustion.
5. Lors de sa combustion, le carbone en est un exemple.
Vertical :
1. Transformation chimique entre le dioxygène et un combustible avec transfert d'énergie thermique.
2. Grandeur physique qui se conserve lors de la transformation chimique.
1. Transformation chimique entre le dioxygène et un combustible avec transfert d'énergie thermique.
2. Grandeur physique qui se conserve lors de la transformation chimique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je sais faire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7L'action de l'acide chlorhydrique sur le calcaire est :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8Pour vérifier la conservation de la masse :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9Quand on réalise la combustion du carbone dans le dioxygène :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercice corrigé
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Compétence : Interpréter des résultats.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
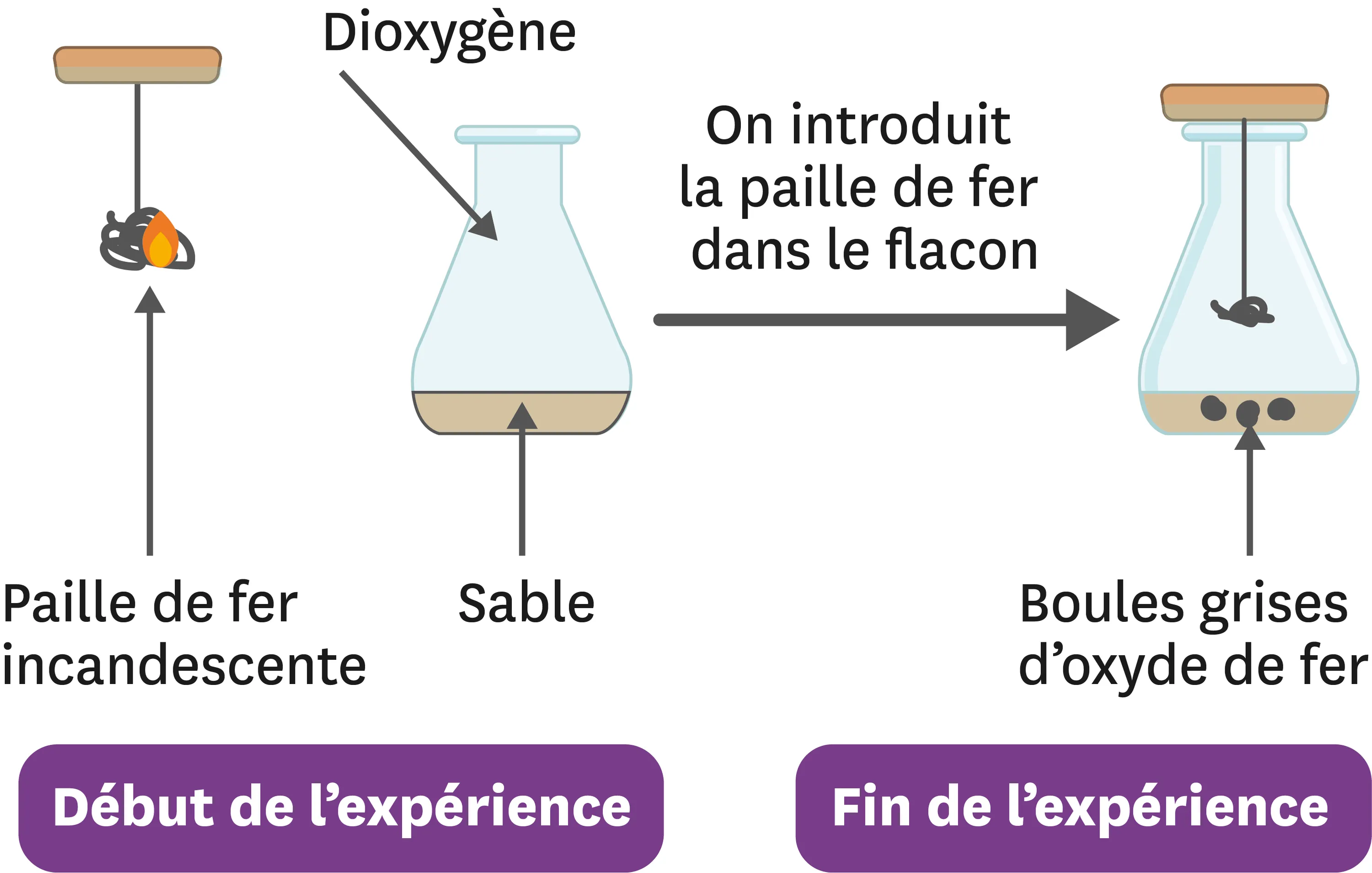
10Faire bruler du fer !
On réalise la combustion du fer dans le dioxygène de l'air. Se forment alors uniquement des petites boules grises : de l'oxyde de fer.
1. Fais une liste du matériel nécessaire.
2. Quels sont les réactifs mis en jeu dans cette combustion ?
3. Quel est le produit ?
4. Écris le bilan de cette transformation chimique.
1. Fais une liste du matériel nécessaire.
5. 8,4 g de paille de fer brulent avec 3,2 g de dioxygène. Quelle est la masse d'oxyde de fer obtenue ?



Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Étapes de la méthode
- Dresser un tableau listant les espèces chimiques présentes à l'état initial et à l'état final, afin d'identifier les réactifs et les produits.
- Écrire le bilan avec les réactifs à gauche de la flèche et les produits à droite.
- Utiliser la règle de la conservation de la masse en écrivant celles mises en jeu pour chaque réactif et chaque produit.
- Remplacer par les valeurs données dans le texte.
- Calculer la valeur de la masse inconnue.
- Faire une phrase de conclusion.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Corrigé
-
1. Matériel : flacon, bouchon avec support, paille de fer, dioxygène, allumettes.
2.
| État initial | État final |
| Fer Dioxygène | Oxyde de fer |
Les réactifs sont le fer et le dioxygène.
3.Le produit est l'oxyde de fer.
4.Fer + Dioxygène \rightarrow Oxyde de fer.
5.Étant donné que la masse se conserve lors d'une transformation chimique, je peux écrire : m(fer) + m(dioxygène) = m(oxyde de fer).
m(oxyde de fer) = 8,4 + 3,2 - 11,6 g
Il se forme donc 11,6 g d'oxyde de fer.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercice similaire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11Combustion de carbone.
La combustion de 6 g de carbone dans du dioxygène donne 22 g de dioxyde de carbone.
1. Écris le bilan de cette transformation.
2. Calcule la masse de dioxygène qui a été consommée.
1. Écris le bilan de cette transformation.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je m'entraine
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12Transformations chimiques.
1. Comment reconnait-on une transformation chimique ?
2. Décris deux transformations chimiques.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13Des bilans.
1. Explique ce qu'est une combustion.
2. Écris le bilan des trois transformations chimiques suivantes :
a. Combustion du carbone.
b. Combustion complète du méthane.
c. Combustion incomplète du méthane.
Le méthane est un gaz distribué en ville.
a. Combustion du carbone.
b. Combustion complète du méthane.
c. Combustion incomplète du méthane.
Le méthane est un gaz distribué en ville.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14Combustions incomplètes.
1. Dans quelle condition la combustion du méthane peut-elle être incomplète ?
2. Quels sont alors les produits ?
3. Pour quelles raisons ces combustions sont-elles dangeureuses ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15Groupe électrogène.
Un groupe électrogène à gaz est un appareil permettant
de produire de l'électricité à partir de la combustion de
gaz naturel (essentiellement composé de méthane). Il
est conseillé de le placer à l'extérieur du domicile.


1. Rappelle le bilan de la combustion complète du méthane.
2. Pourquoi est-il conseillé de le placer à l'extérieur ?


1. Rappelle le bilan de la combustion complète du méthane.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
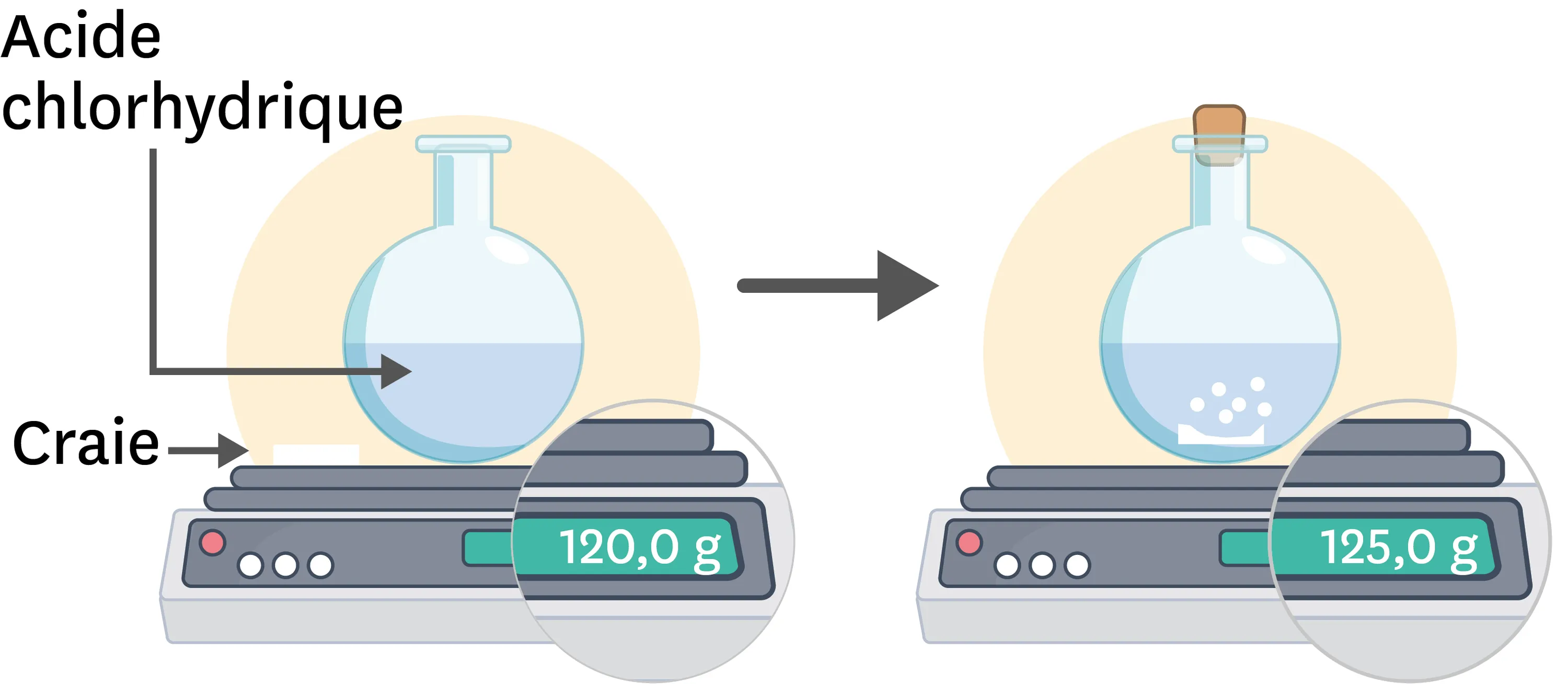
16Masses et transformations chimiques.
Compétence
Identifier le problème à résoudre
1. Aide Marie à trouver son erreur

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Analyse une expérience.
Compétence
Interpréter des résultats

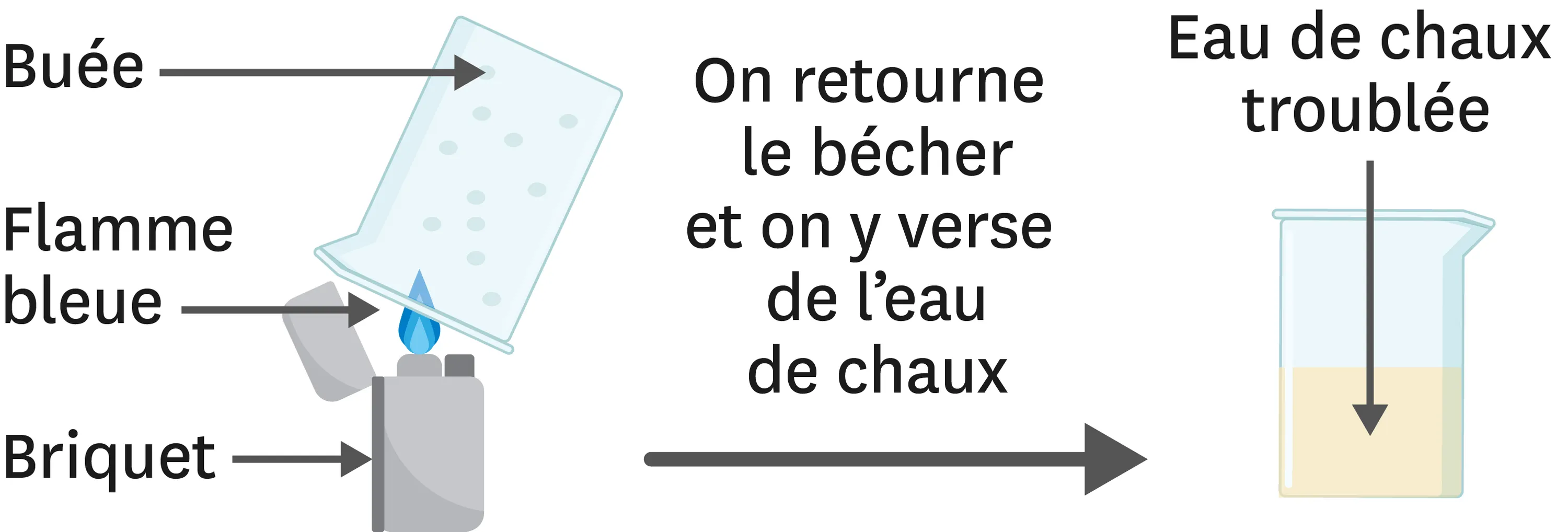
1. La combustion réalisée avec ces briquets est-elle complète ou incomplète ? Justifie.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18Test d'identification.
Julie a réalisé la combustion du charbon dans un flacon.
1. Rappelle le bilan de cette combustion.
2. Quel test d'identification doit-elle mettre en œuvre pour prouver qu'il s'agit bien d'une transformation chimique ? Justifie le choix de ce test.
1. Rappelle le bilan de cette combustion.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19Pollution et dioxyde de carbone.
La production de dioxyde de carbone est responsable de la dégradation de l'habitat de certains organismes vivants (voir activité 4).
1. Nomme un de ces organismes et explique en quoi la présence de dioxyde de carbone dans l'atmosphère est un danger pour eux.
1. Nomme un de ces organismes et explique en quoi la présence de dioxyde de carbone dans l'atmosphère est un danger pour eux.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20Combustion du carbone.
On réalise la combustion d'un fusain dans un flacon contenant du dioxygène.
1. Réalise un schéma légendé de cette expérience.
2. Qu'observe-t-on à chaque stade (avant, pendant et après la réaction) ?
3. Comment doit-on procéder pour vérifier que du dioxyde de carbone s'est formé ?
4. Quels sont les réactifs et les produits de cette transformation chimique ?
5. Écris le bilan de cette transformation chimique.
1. Réalise un schéma légendé de cette expérience.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21La bougie.
1. La flamme d'une bougie correspond-elle à une combustion complète ou incomplète ? Justifie ta réponse.
2. On place une coupelle sur la flamme de cette bougie. Un dépôt noir apparait. Quel est le produit mis ainsi en évidence ?
3. Quels autres produits se forment lors de cette combustion ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Compétence : Lire et comprendre des documents scientifiques pour en extraire des informations.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22-ABilan de combustion. Une bougie qui brule.
Les bougies sont faites de paraffine. La combustion de la bougie a lieu lorsque la paraffine réagit avec le dioxygène de l'air. Du dioxyde de carbone, du monoxyde de carbone et de l'eau sont alors formés. Lorsque la bougie est entièrement consumée, il ne reste presque plus de paraffine et le taux de dioxygène dans l'air de la pièce a diminué.
1. Identifie les espèces chimiques dont la quantité a diminué.
2. Quel rôle jouent-elles dans la transformation chimique ?
3. Identifie les espèces chimiques dont la quantité a augmenté et précise leur rôle dans la transformation.
4. Écris le bilan de la réaction qui modélise cette transformation chimique.




Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22-BBilan de combustion. Rouler à l'éthanol.
L'éthanol d'origine agricole, aussi appelé « bioéthanol », peut être utilisé comme carburant dans certains moteurs. Dans ces moteurs, de l'éthanol et du dioxygène sont consommés tandis que du dioxyde de carbone et de l'eau sont rejetés.
1. Quels sont les réactifs de la transformation chimique qui a lieu dans ces véhicules ?
2. Quels sont les produits ?
3. Écris le bilan de la réaction qui modélise cette transformation chimique.
1. Quels sont les réactifs de la transformation chimique qui a lieu dans ces véhicules ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22-CBilan de combustion. Des véhicules contre la pollution.
La voiture à hydrogène est un véhicule qui permet de limiter la pollution. Il s'agit de véhicules à moteur électrique qui convertissent l'énergie chimique en énergie électrique lors de la transformation chimique du dihydrogène avec le dioxygène. Cette transformation produit uniquement de la vapeur d'eau.
1. Écris le bilan de la réaction qui modélise cette transformation chimique.
1. Écris le bilan de la réaction qui modélise cette transformation chimique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
J'approfondis
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23La masse se conserve-t-elle ?
Compétence
Écrire des phrases claires, sans faute, en utilisant le vocabulaire adapté
1. Explique pourquoi Maud se trompe.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24Chauffage d'appoint.
Les radiateurs à gaz étaient très utilisés il y a quelques années comme chauffage d'appoint. Leur technologie a évolué pour les rendre plus efficaces et moins dangereux. Ils utilisent comme combustible du butane (gaz qui réagit avec le dioxygène comme le méthane).
1. Explique pourquoi une utilisation prolongée peut entrainer la formation de buée sur les vitres.
2. Écris le bilan de la combustion du butane.
3. Quelles précautions est-il nécessaire de prendre lorsqu'on utilise ce type d'appareil ? Pourquoi ?
1. Explique pourquoi une utilisation prolongée peut entrainer la formation de buée sur les vitres.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25Combustion et camping.
En camping, on emporte parfois des réchauds alimentés au butane. Ce gaz brule dans le dioxygène et donne les mêmes produits que la combustion du méthane.


1. La combustion est-elle complète ou incomplète ? Justifie ta réponse.
2. Écris le bilan de la combustion.
3. Décris les expériences que tu réaliserais pour mettre en évidence ces produits (matériel, schémas, descriptions des manipulations et conclusions).


1. La combustion est-elle complète ou incomplète ? Justifie ta réponse.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26Normes de pollution.
Certains moteurs de voitures fonctionnent grâce à la combustion de l'essence. Cette dernière est essentiellement constituée d'un mélange d'heptane et d'octane. Les moteurs actuels dégagent entre 80 et 250 g/km de dioxyde de carbone.


1. La combustion totale de l'essence produit les mêmes espèces chimiques que la combustion du méthane ou du butane. Écris le bilan de cette combustion.
2. En réalité, l'essence est composée de plusieurs espèces chimiques ; sa combustion produit aussi du monoxyde de carbone, des oxydes d'azote, etc. Cette combustion est-elle complète ? Justifie ta réponse.
3. Quelle est la masse maximale de dioxyde de carbone produite dans l'atmosphère par un automobiliste qui parcourt 15 000 km par an avec un véhicule de type B à essence ?
4. La masse de dioxyde de carbone est-elle identique pour un moteur diesel de même catégorie ?


1. La combustion totale de l'essence produit les mêmes espèces chimiques que la combustion du méthane ou du butane. Écris le bilan de cette combustion.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27Pollution industrielle.
Les combustibles fossiles utilisés dans les centrales thermiques contiennent des quantités de soufre variables. Lorsque le soufre brule, du dioxyde de soufre est libéré dans l'atmosphère. Des transformations complexes ont alors lieu. On peut les simplifier en considérant que le dioxyde de soufre réagit avec l'eau des nuages et le dioxygène pour former de l'acide sulfurique, entrainant alors une baisse du pH des eaux de pluie.
1. Écris le bilan de la combustion du soufre.
2. Écris le bilan de la transformation chimique qui se produit au niveau des nuages.
3. Quelle est la conséquence sur l'environnement de ces différentes réactions ?
1. Écris le bilan de la combustion du soufre.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
28Fait divers.
Compétence
Effectuer des recherches documentaires
Une famille de trois personnes a été hospitalisée dans la nuit de mardi à mercredi. Elles ont été prises de maux de tête et de nausées. Le père de famille a alors appelé les pompiers qui les ont évacuées vers l'hôpital. Elles ont été soignées par oxygénothérapie. Toutes sont à présent hors de danger. La chaudière serait à l'origine de cette intoxication.
1. Quel est le gaz responsable de cet incident ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
29Un projet insensé !
En 1991, le prix Nobel de chimie Paul Crutzen a imaginé, dans le but de faire baisser la température moyenne de la Terre, d'envoyer dans la haute atmosphère d'énormes quantités de sulfure d'hydrogène. Celui-ci réagit avec le dioxygène pour donner du dioxyde de soufre et de l'eau. Le dioxyde de soufre forme ensuite de microscopiques particules qui sont capables de renvoyer vers l'espace les rayonnements solaires. Ce projet est resté sans suite car le dioxyde de soufre est aussi un gaz polluant.
1. Quel corps chimique devait être envoyé dans l'atmosphère ?
2. Que serait-il devenu ? Écris le bilan de la transformation chimique correspondante.
3. Explique comment ce projet aurait pu permettre de lutter contre le réchauffement climatique.
4. Pourquoi aurait-il été dangereux d'envoyer du dioxyde de soufre dans l'atmosphère ?
1. Quel corps chimique devait être envoyé dans l'atmosphère ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30Transformations chimiques ou physiques ?
Dans chacun des cas suivants, précise s'il s'agit d'une transformation chimique ou d'une transformation physique. Justifie en réalisant un tableau dans lequel figurent l'état initial et l'état final.
1. Apparition de rouille sur des outils de jardinage en fer.
2. Un glaçon qui fond dans un jus de fruits.
3. Une allumette qui brule.
4. Du sel qui se dissout dans l'eau de cuisson des pâtes.
5. Le sucre que l'on ajoute dans le café.
1. Apparition de rouille sur des outils de jardinage en fer.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31Le fer et l'acide.
Dans un tube à essai, le professeur place un clou en fer et de l'acide chlorhydrique : une effervescence se produit. À la fin de l'heure, les élèves observent l'expérience : le clou est plus petit, la solution est légèrement colorée en vert.
1. En te servant des observations effectuées, montre que l'action du fer sur le clou est bien une transformation chimique. Pour cela, tu réaliseras un tableau décrivant l'état initial et l'état final.
1. En te servant des observations effectuées, montre que l'action du fer sur le clou est bien une transformation chimique. Pour cela, tu réaliseras un tableau décrivant l'état initial et l'état final.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
32Le propane.
Le propane est un gaz utilisé pour alimenter les installations domestiques (chauffe-eau, chaudière). Lorsqu'il brule, il se forme du dioxyde de carbone et de l'eau.
1. Écris le bilan de cette transformation chimique.
2. Pour bruler un litre de propane, il faut 5 L de dioxygène. Quel volume de dioxygène faudra-t-il pour bruler 16,8 m3 de propane (utilise la proportionnalité) ?
1. Écris le bilan de cette transformation chimique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
33Le dioxyde de carbone dans la cuisine moléculaire.
En cuisine moléculaire, pour rendre un plat pétillant, on peut utiliser deux techniques :
2. Prouve que la technique restante est bien une transformation chimique.
- la dissolution dans la préparation de dioxyde de carbone (acheté dans le commerce en bouteille sous pression). Le dioxyde de carbone formera les bulles ;
- l'effervescence obtenue par ajout d'acide citrique (qui provient du jus de citron) et de bicarbonate de sodium (vendu en pharmacie). Cela provoque la formation de bulles contenant du dioxyde de carbone.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je résous un problème
Compétence : Lire et comprendre des documents scientifiques pour en extraire des informations.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Écris le bilan de la photosynthèse pour montrer que c'est une transformation chimique. Explique ensuite en quoi cette transformation peut être le point de départ de solutions pour limiter le réchauffement climatique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Les biocarburants.
Depuis les années 1970, de nouvelles sources d'énergie font leur apparition : les biocarburants. Le préfixe « bio » est lié d'une part à leur origine : ils proviennent des plantes. D'autre part, ils seraient moins polluants que les carburants actuels. Les biocarburants de 3e génération, les plus récents, sont obtenus à partir d'algues. Afin d'accélérer leur croissance, on leur injecte du dioxyde de carbone. La biomasse ainsi formée pourra alors être transformée en carburant.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2La découverte de la photosynthèse.
- 1772 : Joseph Priestley a découvert que les plantes étaient capables de « restaurer l'air qui a été pollué par la combustion des chandelles ».
- 1779 : Jan Ingen-Housz prouve que la photosynthèse nécessite la présence de lumière.
- 1804 : Nicolas Théodore de Saussure montre que l'apport d'eau est essentiel pour que le phénomène se produise.
- 1865 : Mise en évidence de la formation d'amidon (substance indispensable à la croissance des plantes) dans les feuilles de plantes placées à la lumière.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercices supplémentaires
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
34Des combustions.
1. À l'aide des mots suivants, retrouve la définition du mot combustion.
comburant - combustible - dioxygène - transformation chimique
comburant - combustible - dioxygène - transformation chimique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
35Un gaz toxique.
Le monoxyde de carbone est un des produits de la combustion incomplète des gaz domestiques utilisés pour nous chauffer ou pour cuisiner. Toxique, il peut entraîner la mort.
1. Explique de quelle manière ce gaz agit sur notre organisme.
2. Quelles sont les propriétés de ce gaz qui le rendent d'autant plus dangereux ?
3. Donne quelques précautions à suivre permettant d'éviter sa formation.
1. Explique de quelle manière ce gaz agit sur notre organisme.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
36Conservation de la masse.
1. On réalise la combustion complète de 2,4 g de carbone dans 6,4 g de dioxygène. Quelle masse de dioxyde de carbone va-t-on obtenir ?
2. En brûlant 3,6 g de carbone, il se forme 13,2 g de dioxyde de carbone. Quelle masse de dioxygène a été utilisée ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
37Conséquences de la pollution.
1. Comment nomme-t-on les gaz responsables du réchauffement climatique ? Comment sont-ils produits ?
2. Quel est le gaz à la fois responsable du réchauffement climatique et de l'acidification des océans ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Parcours de compétences
Compétence : Conclure, valider ou non l'hypothèse.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour savoir si la rouille se forme bien quand le fer est en contact avec l'eau et l'air, Axel et Camélia mettent des clous dans différentes situations. Après quelques jours, ils observent que :
- Les clous à l'air libre, trempés dans l'eau salée et dans l'eau distillée, ont rouillé.
- Le clou plongé dans l'eau bouillie (pour supprimer l'air dissout) et couverte d'un film d'huile n'a pas rouillé.
- Le clou dans de l'air parfaitement sec n'a pas rouillé.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 1
J'identifie l'hypothèse à évaluer.
Coup de pouce
Quelle hypothèse font Axel et Camélia ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 2
Je rappelle les résultats en lien avec l'hypothèse.
Coup de pouce
S'attendait-on à ce que l'air et l'eau fassent rouiller le fer à chaque fois ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 3
Je valide ou non l'hypothèse, après avoir constaté que les résultats sont en accord ou non avec elle.
Coup de pouce
Les résultats avec l'air et l'eau seuls, ajoutés aux résultats avec l'air et l'eau ensemble, permettent-ils de valider l'hypothèse ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 4
Je valide ou non l'hypothèse, en précisant comment elle s'accorde ou pas avec les résultats.
Coup de pouce
Explique pourquoi les clous des observations 2 et 3 étaient nécessaires pour pouvoir valider l'hypothèse.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
