Physique-Chimie 4e
Mes Pages
Thème 1 : Organisation et transformations de la matière
Ch. 1
La matière, dans l'espace et dans l'Univers
Ch. 2
Que trouve-t-on dans l'air ?
Ch. 3
Les transformations chimiques et la pollution
Ch. 4
Modélisation des transformations chimiques
Ch. 5
Introduction à la masse volumique
Thème 2 : Mouvement et interactions
Ch. 6
Repérage de mouvement et mesure de vitesse
Ch. 7
Les interactions
Thème 3 : L'énergie et ses conversions
Ch. 8
Conversion et transfert de l'énergie
Ch. 9
La tension et l'intensité
Ch. 10
Relations entre grandeurs dans les circuits électriques
Thème 4 : Des signaux pour observer et communiquer
Ch. 11
Vitesse de propagation des signaux
Chapitre 4
Exercices
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je me teste
Je sais
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1La matière est constituée :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Les molécules :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3 Lors d'une transformation chimique :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
4Les atomes sont modélisés par :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5Complète la grille de mots-croisés. Pour écrire sur ce schéma, veuillez cliquer sur l'image et utiliser notre outil de dessin.
Vertical :
1. Elle est un assemblage d'atomes.
2. Elle sert à décrire la transformation chimique.
Horizontal :
3. Constituant microscopique et indivisible de la
matière.
4. Elle fait apparaitre la composition d'une molécule.
1. Elle est un assemblage d'atomes.
2. Elle sert à décrire la transformation chimique.
Horizontal :
3. Constituant microscopique et indivisible de la
matière.
4. Elle fait apparaitre la composition d'une molécule.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je sais faire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6 La molécule de méthane \text{CH}_4 est composée :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7 La molécule de butane \mathrm{C_4H_{10}} est composée :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8 L'équation équilibrée de la combustion du méthane est :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9L'équation équilibrée de la combustion du propane est :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercice corrigé
Compétence : Produire et transformer des tableaux ou des documents graphiques
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10Combustion du propane.
La combustion compléte du propane \text{C}_3\text{H}_8 produit du dioxyde de carbone et de l'eau.




1. Donne le nom des atomes qui composent la molécule de propane et précise leur nombre.
2. Écris en toutes lettres le bilan de la réaction.
3. En remplaçant les noms des réactifs et des produits par leur formule chimique, écris l'équation non équilibrée de la combustion du propane.
4. Ajuste les coefficients de l'équation de réaction afin d'équilibrer celle-ci.
2. Écris en toutes lettres le bilan de la réaction.
3. En remplaçant les noms des réactifs et des produits par leur formule chimique, écris l'équation non équilibrée de la combustion du propane.
4. Ajuste les coefficients de l'équation de réaction afin d'équilibrer celle-ci.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Étapes de la méthode
1. Pour interpréter une formule chimique :
- Chaque lettre majuscule désigne un type d'atome.
- Le nombre d'atomes est en indice.

Réactifs \rightarrow Produits
Réactif 1 + réactif 2 \rightarrow produit 1 + produit 2
3. Remplacer les noms par les formules chimiques.
4. Ajuster les coefficients en examinant la conservation des atomes, un type d'atome après l'autre.
- Commencer par ajuster le nombre de molécules de dioxyde de carbone dans les produits : il y en a autant que d'atomes de carbone présents dans la molécule du combustible.
- Ajuster ensuite le nombre de molécules d'eau dans les produits : il y en a deux fois moins que d'atomes d'hydrogène dans les réactifs.
- Ajuster enfin le nombre de molécules de dioxygène dans les réactifs : il y a en a deux fois moins que d'atomes d'oxygène dans les produits, une fois pris en compte les coefficients déjà écrits.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Corrigé
1. La molécule de propane est composée de 3 atomes de carbone et de 8 atomes d'hydrogène.
2. La réaction de combustion du propane est donnée par le bilan suivant :
Propane + dioxygène \rightarrow dioxyde de carbone + eau
2. La réaction de combustion du propane est donnée par le bilan suivant :
Propane + dioxygène \rightarrow dioxyde de carbone + eau
3. En remplaçant les noms des réactifs et des produits par leurs formules, on obtient : C3H8 + O2 \rightarrow CO2 + H2O
4. En ajustant l'équation de réaction, on obtient : C3H8 + 5 O2 \rightarrow 3 CO2 + 4 H2O
4. En ajustant l'équation de réaction, on obtient : C3H8 + 5 O2 \rightarrow 3 CO2 + 4 H2O
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11 Combustion du pentane.
La combustion du pentane C5H12 dégage du dioxyde de carbone et de l'eau.




1. Donne le nom et le nombre d'atomes qui composent la molécule de pentane.
2. Rédige en toutes lettres le bilan de la réaction.
3. En remplaçant les noms des réactifs et des produits par leur formule, rédige l'équation non équilibrée de la combustion du pentane.
4. Ajuste les coefficients de l'équation de réaction de combustion du pentane.
2. Rédige en toutes lettres le bilan de la réaction.
3. En remplaçant les noms des réactifs et des produits par leur formule, rédige l'équation non équilibrée de la combustion du pentane.
4. Ajuste les coefficients de l'équation de réaction de combustion du pentane.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je m'entraine
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12 Oxygène et dioxygène.
On dit couramment qu'on respire de l'oxygène. Cependant, les scientifiques parlent de dioxygène.
1. Oxygène et dioxygène désignent-ils la même chose ?
2. Lequel est un atome ?
1. Oxygène et dioxygène désignent-ils la même chose ?
2. Lequel est un atome ?
3. Lequel est une molécule ?
4. Dessine le modèle de l'oxygène.
5. Dessine le modèle du dioxygène.
4. Dessine le modèle de l'oxygène.
5. Dessine le modèle du dioxygène.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13 Combustion du carbone.
La combustion du carbone produit du dioxyde de carbone.
1. Écris le bilan de la réaction.
2. Remplace le nom des réactifs et des produits par leur modèle. Que constates-tu au niveau du nombre d'atomes ?
3. Écris l'équation de réaction.
1. Écris le bilan de la réaction.
2. Remplace le nom des réactifs et des produits par leur modèle. Que constates-tu au niveau du nombre d'atomes ?
3. Écris l'équation de réaction.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14 Ajuster une équation de réaction à partir des dessins des molécules.
Soit la réaction dessinée ci-dessous.

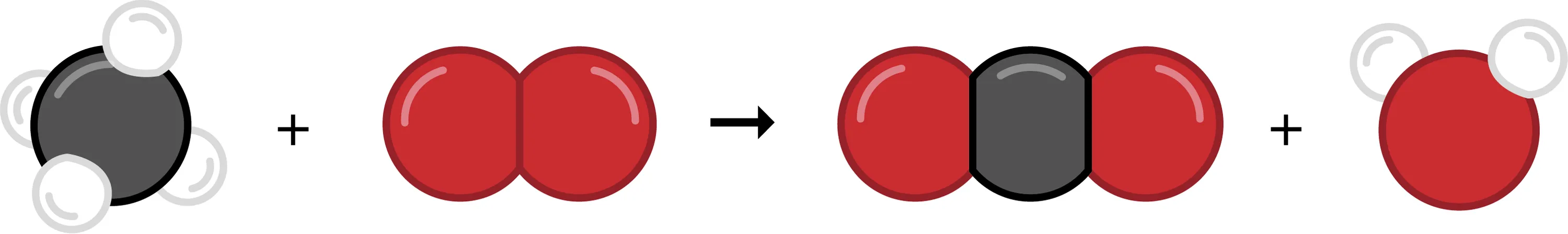
1. Comment s'appellent les espèces chimiques à gauche de la flèche ?
2. Comment s'appellent les espèces chimiques à droite de la flèche ?
3. Donne le bilan de la réaction en toutes lettres.
4. Remplace les noms des molécules par leur formule chimique.
5. Cette équation de réaction est-elle équilibrée ?
6. Recopie la réaction dessinée ci-dessus et ajoute les molécules manquantes afin d'ajuster cette réaction.
7. Donne l'équation de réaction équilibrée.


1. Comment s'appellent les espèces chimiques à gauche de la flèche ?
2. Comment s'appellent les espèces chimiques à droite de la flèche ?
3. Donne le bilan de la réaction en toutes lettres.
4. Remplace les noms des molécules par leur formule chimique.
5. Cette équation de réaction est-elle équilibrée ?
6. Recopie la réaction dessinée ci-dessus et ajoute les molécules manquantes afin d'ajuster cette réaction.
7. Donne l'équation de réaction équilibrée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15 Équations de réaction.
1. Ajuste les équations des réactions suivantes :
a. CH4 + O2 → CO2 + H2O
b. C7H16 + O2 → CO2 + H2O
c. C6H12O6 + O2 → CO2 + H2O
a. CH4 +
b. C7H16 +
c. C6H12O6 +
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16 La glycine.
La glycine est un acide aminé entrant dans la composition de l'ADN. Elle joue un rôle important dans le corps humain.

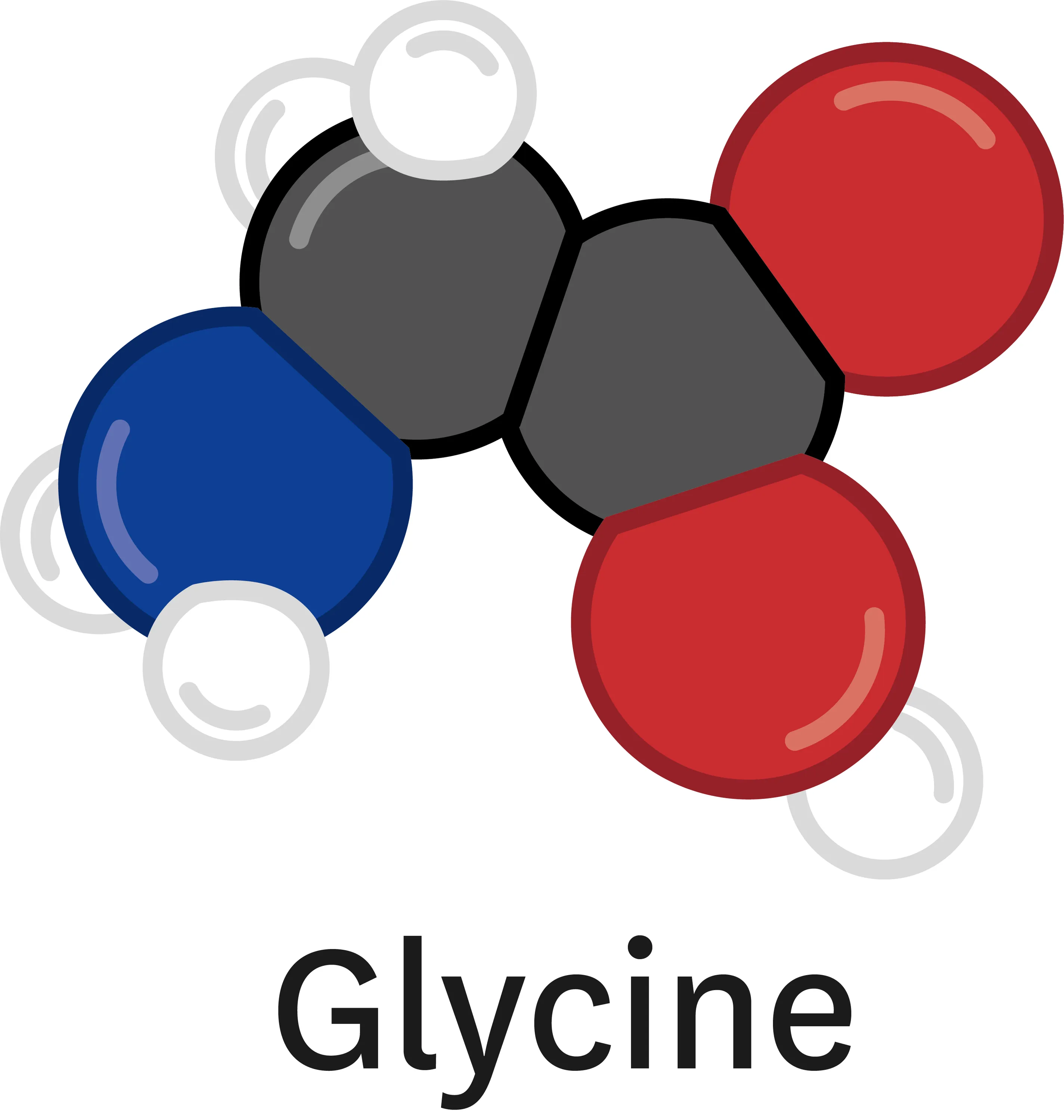
1. Donne la composition de la glycine en précisant le nombre de chaque type d'atome.
2. Quelle est la formule chimique de la glycine ?
2. Quelle est la formule chimique de la glycine ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17 L'air.
L'air est composé d'environ 80 % de diazote et 20 % de dioxygène.

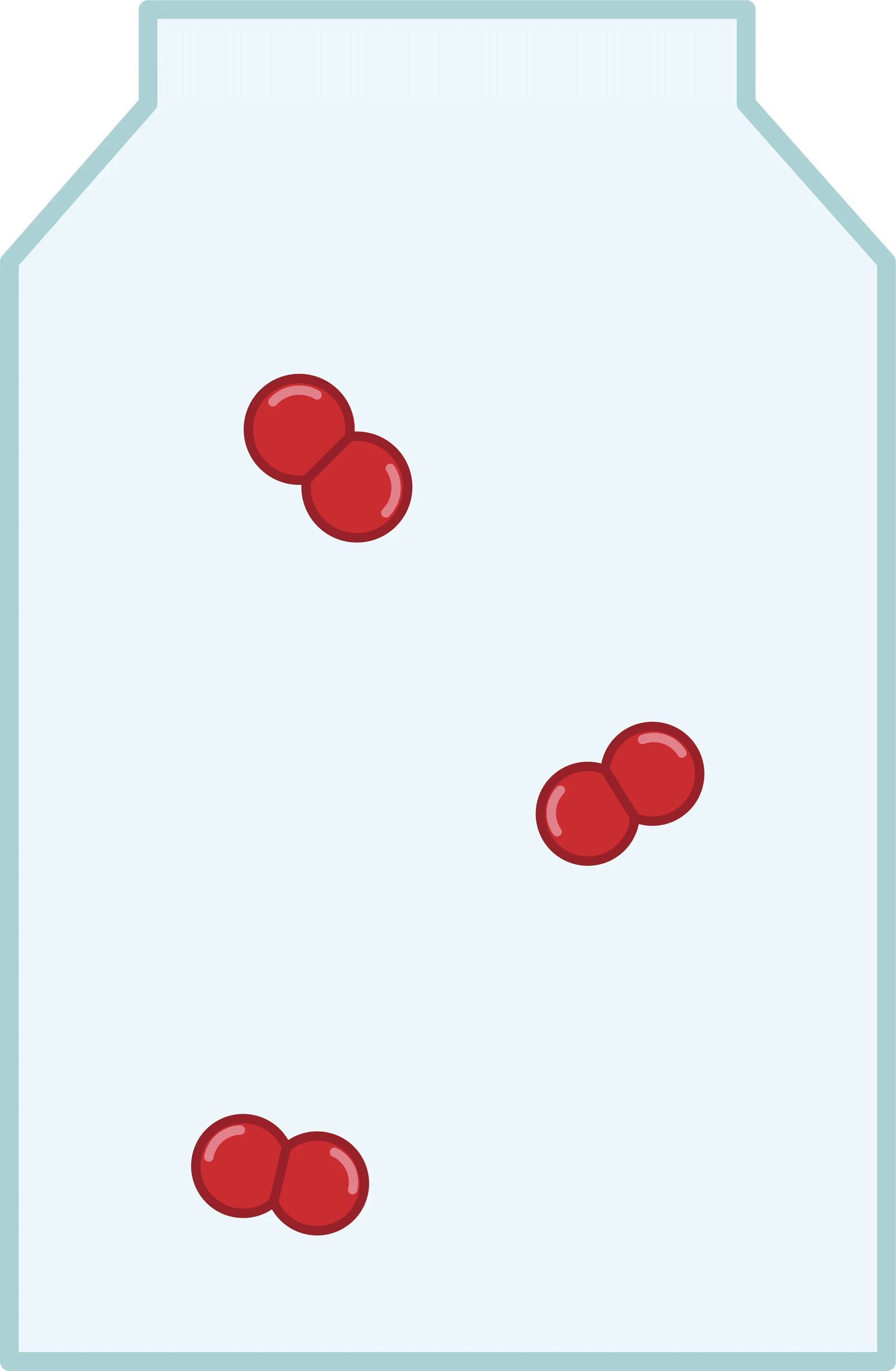


1. Quelle est la formule du diazote ?
2. Quelle est la composition de la molécule de diazote ?
3. Dessine le modèle de la molécule de diazote.
4. Quelle est la formule du dioxygène ?
2. Quelle est la composition de la molécule de diazote ?
3. Dessine le modèle de la molécule de diazote.
4. Quelle est la formule du dioxygène ?
5. Quelle est la composition de la molécule de dioxygène ?
6. Dessine le modèle de la molécule de dioxygène.
7. Combien de molécules de diazote faudrait-il dessiner dans la bouteille ci-dessus pour modéliser l'air ?
6. Dessine le modèle de la molécule de dioxygène.
7. Combien de molécules de diazote faudrait-il dessiner dans la bouteille ci-dessus pour modéliser l'air ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18 À chaque modèle sa formule.
1. À partir de ces dessins de modèles, donne la formule des molécules suivantes.

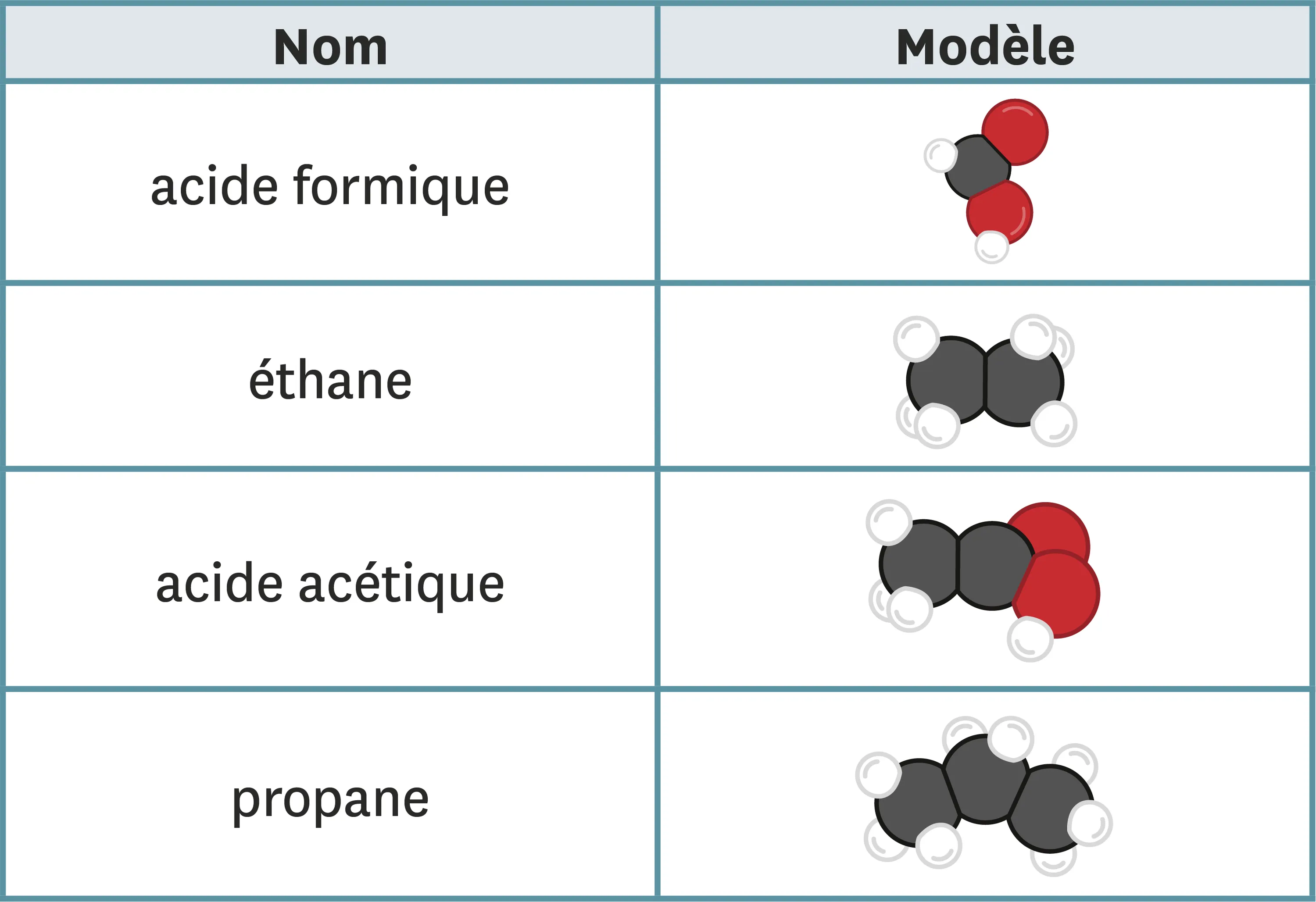


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19 Composition des molécules.
Compétence
Lire et comprendre des documents scientifiques pour en extraire des informations
1. l'éthylène C2H4
2. le monoxyde d'azote NO
3. l'ozone O3
4. l'eau oxygénée H2O2
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20 Atomes et molécules.
Soit les formules chimiques et symboles suivants : CO2 - Fe - H2O - H - CuSO4 - He.
1. Lesquel(le)s désignent des atomes ?
2. Lesquel(le)s désignent des molécules ?
3. Comment as-tu fait pour les différencier ?
1. Lesquel(le)s désignent des atomes ?
2. Lesquel(le)s désignent des molécules ?
3. Comment as-tu fait pour les différencier ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Compétence : Modéliser des phénomènes pour les expliquer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21-A Équation de réaction d'une combustion. La corrosion du fer.
Au contact du dioxygène O2 et en présence d'eau H2O, le fer Fe se corrode en rouille Fe2O3. L'eau est indispensable pour ce processus, mais lors de cette transformation la quantité totale d'eau reste la même. On propose une équation pour modéliser cette réaction : 4 Fe + 4 O2 \rightarrow 2 Fe2O6


1. Explique pourquoi l'eau n'est ni un réactif, ni un produit dans cette transformation.
2. Compte le nombre d'atomes de fer dans les réactifs de l'équation.
2. Compte le nombre d'atomes de fer dans les réactifs de l'équation.
3. Compte le nombre d'atomes de fer dans les produits de l'équation puis fais de même pour les atomes d'oxygène.
4. Indique, à l'aide des réponses précédentes, si l'équation de réaction est équilibrée. Si ce n'est pas le cas, propose une correction de l'équation.
4. Indique, à l'aide des réponses précédentes, si l'équation de réaction est équilibrée. Si ce n'est pas le cas, propose une correction de l'équation.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21-B Équation de réaction d'une combustion. La combustion du gaz naturel.
Le méthane est le composé principal du gaz naturel délivré dans les habitations. La réaction de combustion du méthane CH4 avec le dioxygène O2 produit du dioxyde de carbone CO2 et de l'eau H2O. On propose une équation de réaction pour modéliser cette transformation chimique : CH4 + O2 \rightarrow CO2 + 2 H2O
1. Compte le nombre d'atomes de carbone, d'oxygène et d'hydrogène de chaque côté de l'équation de réaction.
2. D'après ta réponse à la question précédente, l'équation est-elle équilibrée ? Si ce n'est pas le cas, propose une correction.
1. Compte le nombre d'atomes de carbone, d'oxygène et d'hydrogène de chaque côté de l'équation de réaction.
2. D'après ta réponse à la question précédente, l'équation est-elle équilibrée ? Si ce n'est pas le cas, propose une correction.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21-C Équation de réaction d'une combustion. L'alcool à bruler.
L'alcool à bruler est constitué d'éthanol dont la formule est C2H6O. La combustion de l'éthanol dans l'air consomme de l'éthanol et du dioxygène O2 et forme du dioxyde de carbone CO2 et de l'eau H2O.


1. Écris et équilibre l'équation de réaction de la combustion de l'éthanol.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
J'approfondis
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
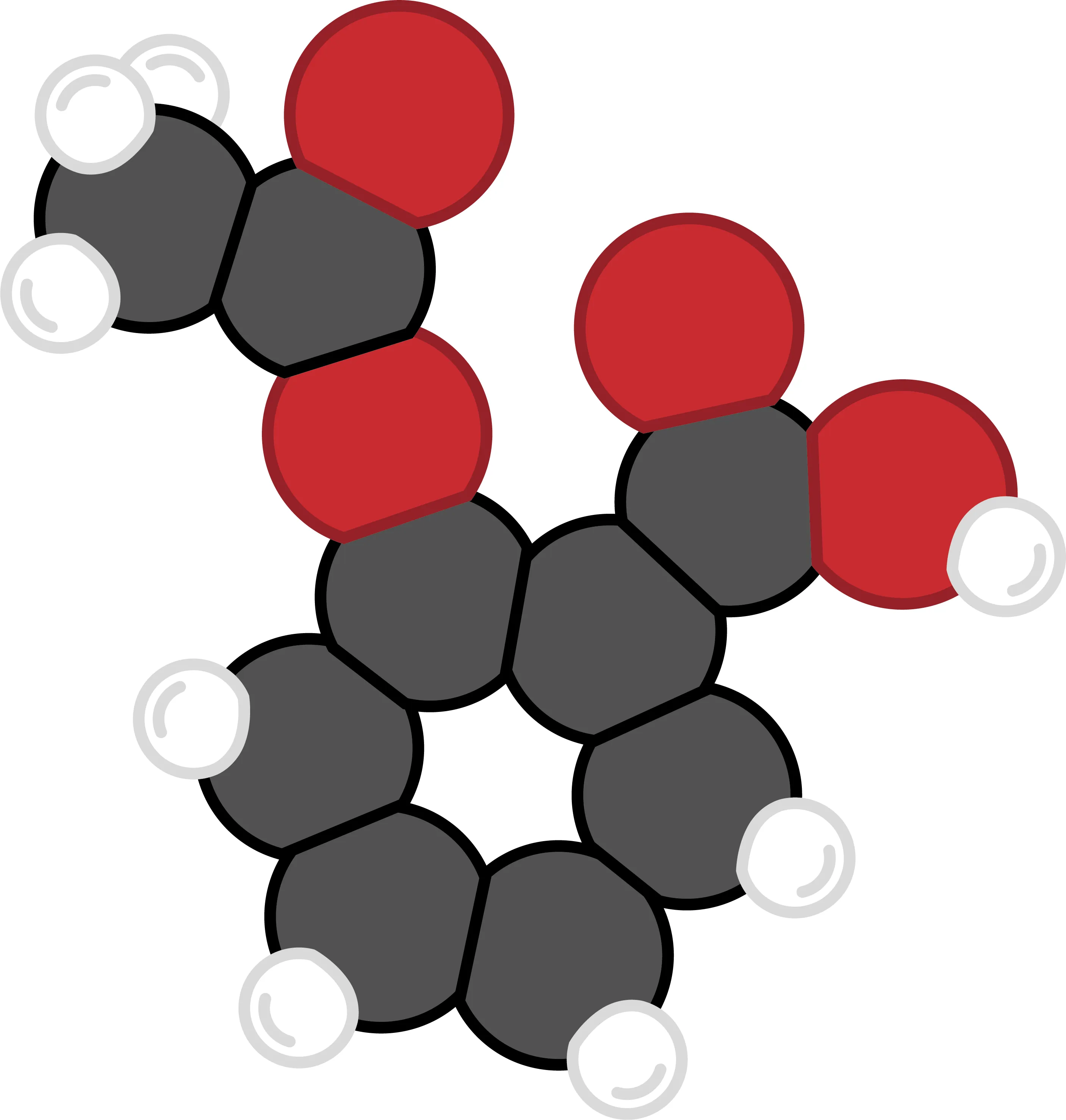
22 L'aspirine.
L'aspirine contient de l'acide acétylsalicylique dont le dessin figure ci-contre. Cette substance peut être obtenue à partir d'une espèce chimique présente dans l'écorce du saule. Ses infusions servaient autrefois à calmer les douleurs. Désormais, l'acide acétylsalicylique est fabriqué en laboratoire.

1. Comment se nomme la molécule qui permet à l'aspirine de calmer les douleurs ?
2. Est-elle d'origine naturelle ou 100 % artificielle, c'est-à-dire qui n'existe pas dans la nature ?
2. Est-elle d'origine naturelle ou 100 % artificielle, c'est-à-dire qui n'existe pas dans la nature ?
3. En observant la molécule, donne sa composition.
4. Donne la formule chimique de l'acide acétylsalicylique.
4. Donne la formule chimique de l'acide acétylsalicylique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23 La vitamine C.
L'acide ascorbique ou vitamine C est présent dans les fruits ainsi que dans quelques légumes. Il a pour formule C6H8O6. Dans les jus, il se dégrade malheureusement lors de la pasteurisation (chauffage rapide et élevé) de la boisson pour former du dioxyde de carbone CO2, de l'eau H2O et du furfural C5H4O2.
1. Donne la composition atomique de l'acide ascorbique.
2. Écris le bilan de la réaction de dégradation de l'acide ascorbique.
3. Écris l'équation de réaction équilibrée en ajustant le cœfficient de la molécule d'eau.
1. Donne la composition atomique de l'acide ascorbique.
2. Écris le bilan de la réaction de dégradation de l'acide ascorbique.
3. Écris l'équation de réaction équilibrée en ajustant le cœfficient de la molécule d'eau.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24 Combustion du sucre.
À l'intérieur des muscles, le glucose ci-contre réagit avec le dioxygène fourni par les globules rouges. La réaction qui a lieu libère de l'énergie. Il se forme alors du dioxyde de carbone et de l'eau.

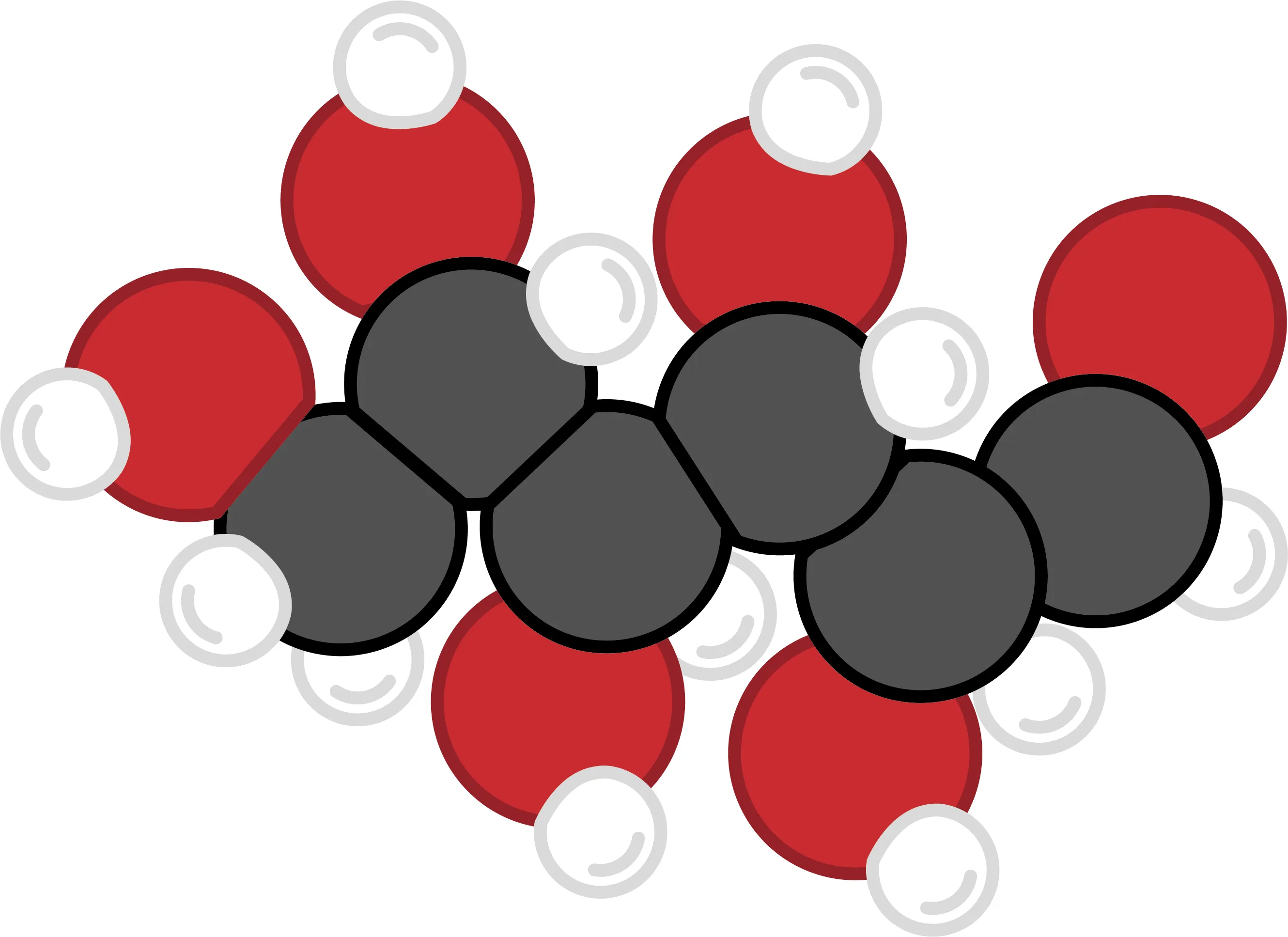
1. Donne la composition de la molécule de glucose.
2. Quelle est sa formule ?
3. Écris le bilan de la réaction.
4. Écris l'équation de réaction.


1. Donne la composition de la molécule de glucose.
2. Quelle est sa formule ?
3. Écris le bilan de la réaction.
4. Écris l'équation de réaction.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25 La synthèse du sucre.
Le sucre le plus utilisé en cuisine est le saccharose. Il est fabriqué à partir de fructose et de glucose, deux molécules différentes ayant la même formule chimique : C6H12O6. Il se forme alors du saccharose C12H22O11 et de l'eau H2O.
1. Écris le bilan de la réaction.
2. Quel est le nombre d'atomes de carbone, d'hydrogène et d'oxygène du côté des produits sachant qu'il ne se forme qu'une molécule de saccharose et une molécule d'eau ?
3. Sachant que le nombre d'atomes se conserve lors de la transformation chimique, retrouve la formule du fructose.
4. Écris l'équation de la transformation.
1. Écris le bilan de la réaction.
2. Quel est le nombre d'atomes de carbone, d'hydrogène et d'oxygène du côté des produits sachant qu'il ne se forme qu'une molécule de saccharose et une molécule d'eau ?
3. Sachant que le nombre d'atomes se conserve lors de la transformation chimique, retrouve la formule du fructose.
4. Écris l'équation de la transformation.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26 Les additifs alimentaires.
Compétence
Comprendre et interpréter des tableaux ou des documents graphiques
E200 : L'acide sorbique C6H8O2 est un conservateur présent dans les denrées alimentaires à base de fruits et de légumes, mais aussi de mayonnaise. Il était auparavant extrait des baies du sorbier.
E330 : L'acide citrique C6H8O7 est un acidifiant présent dans les aliments en étant que correcteur d'acidité. Il est naturellement présent dans les légumes et les fruits, surtout les agrumes.
1. Donne la composition de chacune de ces molécules.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27Réaction entre l'acide chlorhydrique et la craie.
La craie est une roche calcaire composée de carbonate de calcium CaCO3. Lorsqu'on verse de l'acide chlorhydrique HCl dessus, il se forme de l'eau, un gaz et un sel appelé chlorure de calcium CaCl2. Le gaz formé trouble l'eau de chaux.
1. Quel gaz a pu troubler l'eau de chaux ?
2. Quels sont les réactifs de cette réaction ? Quels sont les produits ?
3. Écris le bilan de la réaction.
4. Écris l'équation de réaction.
1. Quel gaz a pu troubler l'eau de chaux ?
2. Quels sont les réactifs de cette réaction ? Quels sont les produits ?
3. Écris le bilan de la réaction.
4. Écris l'équation de réaction.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
28 Feu d'artifice.
Lors des feux d'artifice, on brule la poudre d'aluminium afin d'obtenir des étincelles blanches très brillantes. Il se forme alors de l'oxyde d'aluminium de formule Al2O3.
1. Quels sont les réactifs ?
2. Quel est le produit ?
3. Écris le bilan de la réaction.
4. Écris l'équation de réaction.
1. Quels sont les réactifs ?
2. Quel est le produit ?
3. Écris le bilan de la réaction.
4. Écris l'équation de réaction.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
29 Le magnésium.
Le magnésium est très utilisé pour les feux d'artifice et on le retrouve dans la composition de la poudre qui servait autrefois à faire les flash pour les photographies. Lors de cette réaction, le magnésium Mg brule dans le dioxygène pour former de l'oxyde de magnésium MgO.


1. Quels sont les réactifs ?
2. Quel est le produit ?
3. Écris le bilan de la réaction.
4. Écris l'équation de réaction.
2. Quel est le produit ?
3. Écris le bilan de la réaction.
4. Écris l'équation de réaction.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30 Modéliser une transformation chimique.
Voici le schéma avant une réaction de combustion.

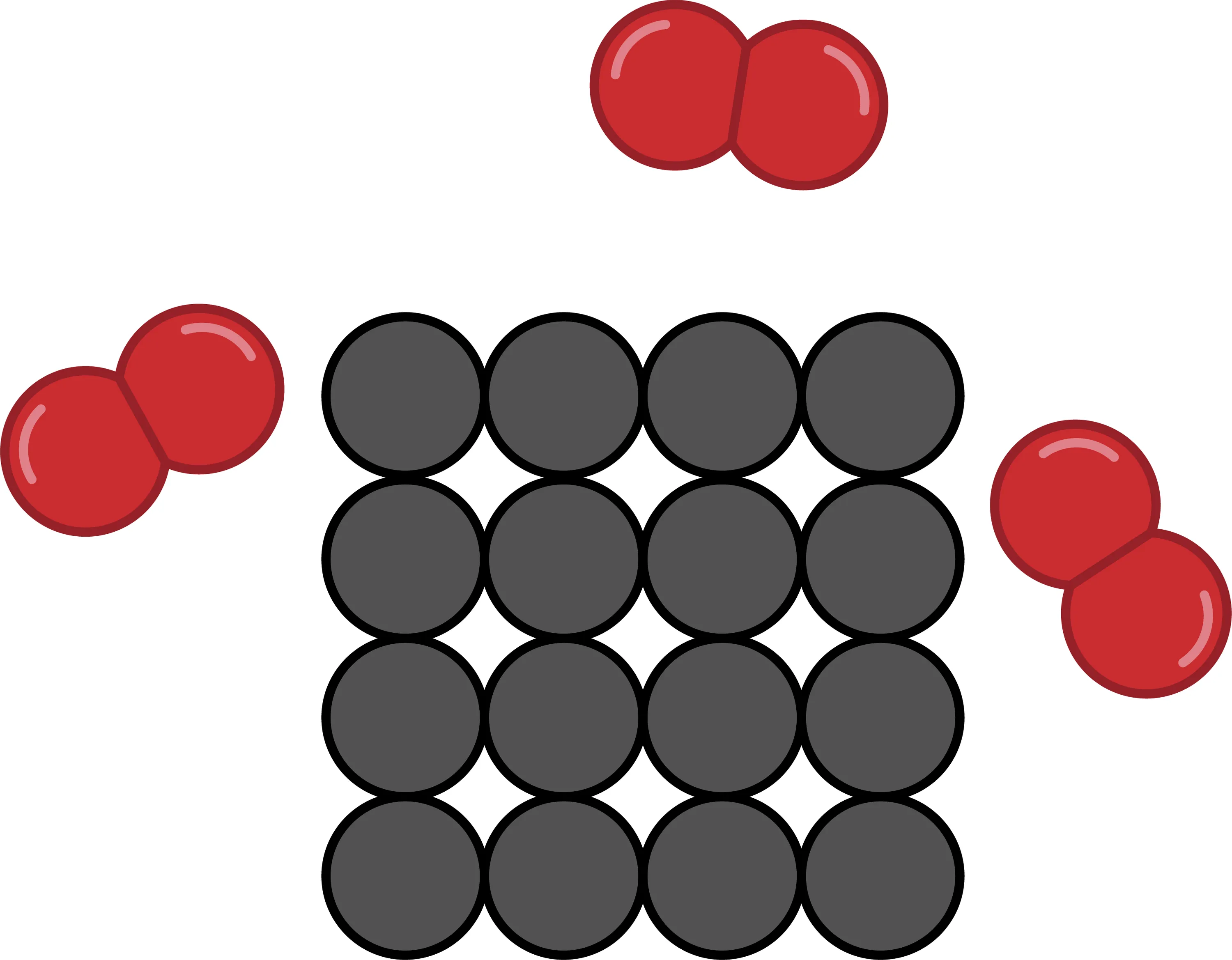
1. Quel est le combustible ?
2. Écris l'équation de la réaction.
3. Réalise le schéma de la situation après la réaction de combustion.


1. Quel est le combustible ?
2. Écris l'équation de la réaction.
3. Réalise le schéma de la situation après la réaction de combustion.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31 Le fer brule aussi !
Lors d'un incendie, source importante de chaleur, un clou en fer (symbole Fe) peut également réaliser une vive combustion avec le dioxygène contenu dans l'air. Il se forme alors de l'oxyde de fer (Fe2O3).
1. Indique quels sont le(s) réactif(s) et le(s) produit(s) de la réaction.
2. Donne la formule chimique et la composition atomique de chacun d'eux.
3. Quelle espèce chimique joue le rôle de combustible ?
4. Écris l'équation bilan de la transformation chimique qui s'est réalisée.
5. La combustion d'un clou de 12 g nécessite environ 3,6 L de dioxygène. Détermine la masse de dioxygène nécessaire à cette transformation, sachant que 1 L de dioxygène pèse environ 1,4 g.
6. Peux-tu prévoir la masse de l'oxyde de fer obtenu ? Si oui, explique comment et calcule la masse finale de cet oxyde.
7. Parfois, l'oxyde de fer obtenu a pour formule FeO. Écris la nouvelle équation bilan.
1. Indique quels sont le(s) réactif(s) et le(s) produit(s) de la réaction.
2. Donne la formule chimique et la composition atomique de chacun d'eux.
3. Quelle espèce chimique joue le rôle de combustible ?
4. Écris l'équation bilan de la transformation chimique qui s'est réalisée.
5. La combustion d'un clou de 12 g nécessite environ 3,6 L de dioxygène. Détermine la masse de dioxygène nécessaire à cette transformation, sachant que 1 L de dioxygène pèse environ 1,4 g.
6. Peux-tu prévoir la masse de l'oxyde de fer obtenu ? Si oui, explique comment et calcule la masse finale de cet oxyde.
7. Parfois, l'oxyde de fer obtenu a pour formule FeO. Écris la nouvelle équation bilan.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
32 La photosynthèse.
Compétence
Lire et comprendre des documents scientifiques pour en extraire des informations
1. Indique quels sont les réactifs et les produits de la réaction.
2. Explique pourquoi la forêt amazonienne est surnommée le « poumon vert » de la planète.
3. Donne la formule chimique et la composition atomique des produits de la photosynthèse.
4. Écris et équilibre l'équation de réaction de la transformation chimique qui s'est réalisée.
5. La photosynthèse est-elle possible la nuit ?
6. Les plantes respirent nuit et jour. Que fabriquent les plantes la nuit ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
33 La formation de l'eau par combustion.
Les premiers dirigeables volaient grâce au gaz dihydrogène. L'inconvénient principal de ce gaz est qu'il est extrêmement inflammable. En présence de dioxygène, il forme de l'eau en libérant énormément d'énergie.


1. Quel est le bilan de la réaction ?
2. Écris l'équation de réaction.
2. Écris l'équation de réaction.
3. Ajuste l'équation de manière à montrer la conservation du nombre d'atomes.
4. D'où provient le nom hydrogène ?
4. D'où provient le nom hydrogène ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je résous un problème
Compétence : Mettre en œuvre un raisonnement logique simple pour résoudre un problème
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 La combustion incomplète du méthane génère du monoxyde de carbone, du dioxyde de carbone et de l'eau.

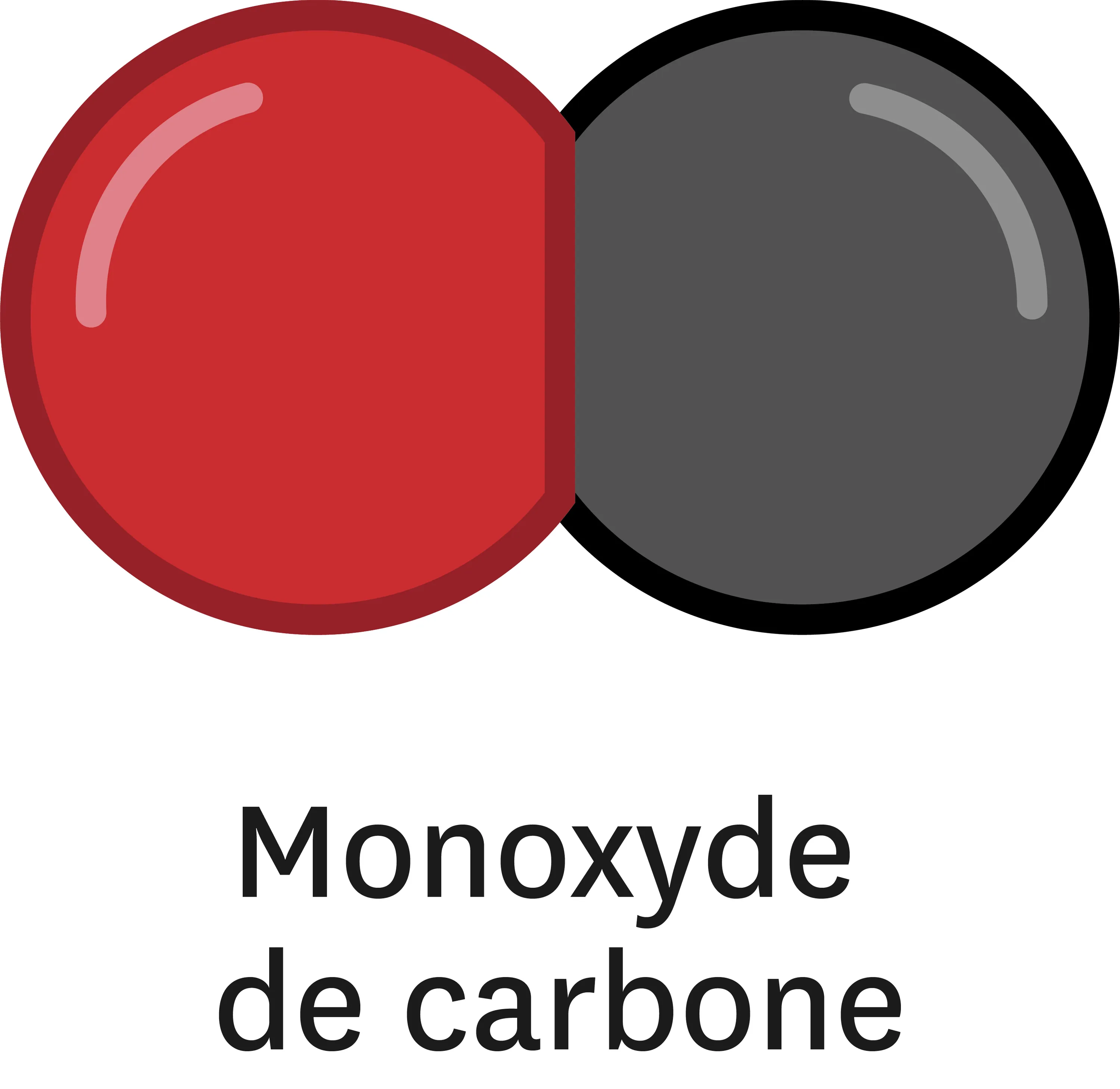
Le monoxyde de carbone est un gaz inodore et incolore produit lors des combustions incomplètes, quand l'apport en dioxygène n'est pas suffisant. Il est toxique car il prend la place du dioxygène sur les globules rouges du sang. Il peut entrainer une insuffisance respiratoire voire la mort.
Donne l'équation de réaction équilibrée de la combustion incomplète du méthane.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercices supplémentaires
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
34 Il faut trouver l'équilibre...
Voici une liste d'équation bilan de transformation chimique :
a) C + O2 → CO
b) CH4 + H2O → CO2 + H2
c) H2 + O2 → H2O
b) CH4 + H2O → CO2 + H2
c) H2 + O2 → H2O
d) CO + O2 → CO2
e) NH3 + O2 → NO + H20
f) N2 + H2 → NH3
e) NH3 + O2 → NO + H20
f) N2 + H2 → NH3
1. Explique selon quel principe on obtient une équation bilan équilibrée.
2. Équilibre chacune des réactions chimiques.
2. Équilibre chacune des réactions chimiques.
a) C + O2 → CO
b) CH4 + H2O → CO2 + H2
c) H2 + O2 → H2O
b)
c)
d) CO + O2 → CO2
e) NH3 + O2 → NO + H20
f) N2 + H2 → NH3
e)
f)
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
35 Une réaction pour déboucher les éviers.
Afin de déboucher les éviers, on verse du bicarbonate de soude et du vinaigre dans l'évier. Le bicarbonate de soude NaHCO3 réagit avec l'acide acétique du vinaigre CH3COOH pour former de l'acétate de sodium CH3COONa, de l'eau et beaucoup de gaz : le dioxyde de carbone, qui fait mousser la réaction.
1. Quels sont les réactifs ?
2. Quels sont les produits ?
3. Quelle est la formule du dioxyde de carbone ?
2. Quels sont les produits ?
3. Quelle est la formule du dioxyde de carbone ?
4. Quelle est la formule de l'eau ?
5. Écris le bilan en toutes lettres de cette réaction.
6. Écris l'équation bilan de cette réaction.
5. Écris le bilan en toutes lettres de cette réaction.
6. Écris l'équation bilan de cette réaction.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
36 L'airbag.
Un airbag est un coussin gonflable de sécurité utilisé dans les automobiles pour protéger les passagers lors d'une collision. Lors de l'impact, le sac se gonfle. En effet, un détonateur provoque la décomposition explosive d'azoture de sodium NaN3 en sodium Na et azote gazeux N2.
1. Quel est le réactif ?
2. Quels sont les produits formés ?
3. Quel est le nom du gaz qui remplit l'airbag une fois gonflé ?
4. Écris le bilan de la réaction.
5. Écris l'équation bilan de la réaction.
1. Quel est le réactif ?
2. Quels sont les produits formés ?
3. Quel est le nom du gaz qui remplit l'airbag une fois gonflé ?
4. Écris le bilan de la réaction.
5. Écris l'équation bilan de la réaction.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
37 Synthèse d'un arôme de banane.
Lors de la synthèse de l'arôme de banane, on fait réagir de l'acide acétique C2H4O2 avec de l'alcool isoamylique C5H12O. Il se forme alors de l'acétate d'isoamyle C7H14O2 qui dégage de l'eau H2O et l'arôme de banane.
1. Quels sont les réactifs ? Donne leur composition atomique.
2. Quels sont les produits ? Donne leur composition atomique.
3. Quel est le bilan de la réaction ?
4. Équilibre l'équation bilan de la réaction en remplaçant les noms des réactifs et des produits par leur formule.
5. Le nombre d'atomes a-t-il varié durant la transformation chimique ?
1. Quels sont les réactifs ? Donne leur composition atomique.
2. Quels sont les produits ? Donne leur composition atomique.
3. Quel est le bilan de la réaction ?
4. Équilibre l'équation bilan de la réaction en remplaçant les noms des réactifs et des produits par leur formule.
5. Le nombre d'atomes a-t-il varié durant la transformation chimique ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Parcours de compétences
Compétence : Comprendre l'évolution d'un savoir scientifique dans le temps et son influence sur la société
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Vers 440 av. J.-C., le savant grec Leucippe émet l'idée que la matière est constituée d'atomes. Vers 350 av. J.-C., Aristote affirme que la matière est une combinaison de quatre éléments. Jusqu'au XVIe siècle, les alchimistes en Europe s'efforcent de transformer le plomb en or. En 1808, l'Anglais Dalton relance la théorie atomique. L'Italien Amadeo Avogadro comprend en 1811 le lien entre atome, molécule et transformation chimique.
Pourquoi l'humanité ne comprend-elle les transformations de la matière que depuis 200 ans ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 1
Je place les évènements scientifiques sur une échelle de temps.
Coup de pouce
Place les grandes étapes de l'histoire de la chimie sur une frise chronologique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 2
J'associe les savoirs scientifiques à un lieu et un contexte historique.
Coup de pouce
Ajoute à la frise les lieux des découvertes.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 3
J'ai conscience de l'influence de l'évolution d'un savoir scientifique sur la société.
Coup de pouce
Cherche des exemples de changements rendus possibles pour la compréhension des transformations chimiques.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 4
J'ai un regard critique sur l'évolution d'un savoir scientifique dans le contexte historique, géographique, économique et culturel.
Coup de pouce
Quelles ont été les conséquences de la théorie des éléments d'Aristote sur la compréhension des transformations chimiques ?
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
