Chapitre 3
Exercices
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je me teste
Je sais
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Lorsque tu dilues une solution basique, le pH tend vers :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Une dilution est une transformation :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Lors de la dilution d'une solution :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
4À chacun son rôle.
Dans la réaction (H+ + Cl-) + (Na+ + HO-) \rightarrow H2O + (Na+ + Cl-), associe chacune des espèces à son rôle dans la réaction :
| Réactif | Ion spectateur | Produit |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5Des ions spectateurs sont des ions.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6Dans l'équation-bilan 2H+ + Fe \rightarrow Fe2+ + H2 :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7Diagramme de pH.
1. Indique à quel mot correspond chaque lettre du diagramme.

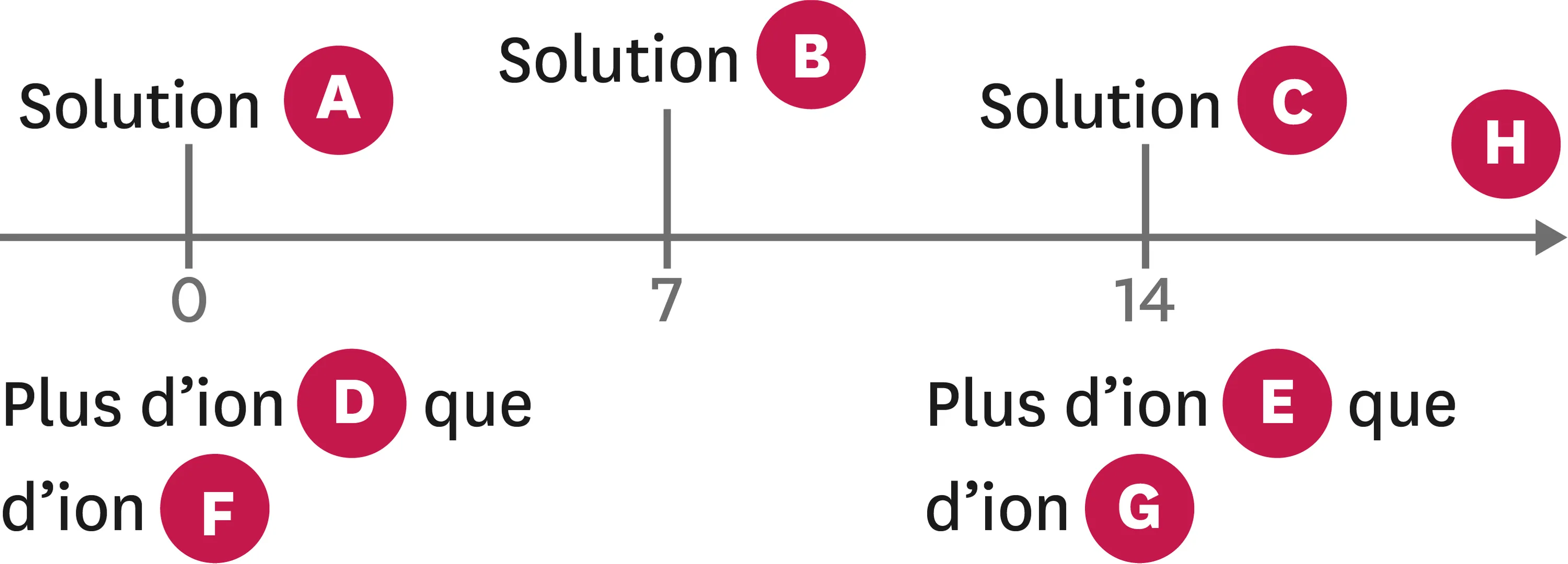


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je sais faire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8
Pour mesurer le pH, je dois utiliser :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9
Pour identifier un dégagement de dihydrogène H2, je dois :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10
Pour réaliser une dilution, je dois utiliser :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11
Pour diminuer la dangerosité d'une solution acide, je dois :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercice corrigé
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Compétence : Modéliser des phénomènes pour les expliquer.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12
Origine du nom hydrogène.
Le mot hydrogène est composé des racines grecques hydro qui signifie « eau » et gène qui signifie « engendrer ». Ce nom signifie donc « qui engendre l'eau ». L'hydrogène fut nommé ainsi par Antoine de Lavoisier (1743-1794). Lavoisier pratiqua la combustion, dans le dioxygène, du gaz formé par réaction d'un acide avec du fer. La combustion de ce gaz entraina la formation d'eau. C'est pourquoi il lui donna le nom d'hydrogène.
1. Rappelle l'équation de réaction d'un acide avec le fer.
2. Quel est le nom moderne du gaz formé par cette réaction ?
3. Comment peut-on l'identifier ?
2. Quel est le nom moderne du gaz formé par cette réaction ?
3. Comment peut-on l'identifier ?
4. Dans la réaction de combustion, donne alors les noms des deux réactifs avec leur formule chimique.
5. Dans la réaction de combustion, donne le produit avec sa formule chimique.
6. Propose une équation de réaction de cette combustion.
5. Dans la réaction de combustion, donne le produit avec sa formule chimique.
6. Propose une équation de réaction de cette combustion.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Étapes de la méthode
- Plusieurs transformations de métal sous l'action d'un acide fonctionnent selon le schéma suivant : des ions hydrogène H + prennent des électrons à un atome de métal, ce qui donne des ions du métal et des atomes H qui s'associent par paires et forment des molécules H2 .
- Pour un exemple particulier, l'énoncé contient les formules des espèces chimiques les moins courantes. Celles que l'on rencontre souvent sont évoquées à travers leurs propriétés les plus connues.
- Une réaction de combustion fait intervenir du dioxygène O 2 de façon générale.
- Pour écrire une équation, il faut que le même nombre de chaque noyau d'atome figure dans les réactifs et dans les produits. Les électrons sont également conservés.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Corrigé
- 2 H++ Fe \rightarrow Fe 2+ + H2.
- Le gaz formé est du dihydrogène.
- On peut l'identifier avec une flamme qui produit une détonation caractéristique.
- Les réactifs sont le dioxygène O2 et le dihydrogène H2 .
- Le produit formé est l'eau H 2O.
- L'équation de la réaction de combustion est O 2 + 2 H2 \rightarrow 2 H2 O.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercice similaire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13
Origine du nom hydrogène.
L'acidité des sodas amène les fabriquants de boissons à protéger les canettes en aluminium avec un fin film plastique qui en tapisse l'intérieur. Sans cela, la canette finirait par se percer, et avant que cela n'arrive, la boisson se chargerait en ions aluminium Al3+. De plus, un gaz inflammable s'accumulerait dans la canette, la rendant dangereuse.
1. Quel est le gaz formé par la réaction de l'acide des boissons avec l'aluminium ?
2. Quel test permet de l'identifier et que produit-il ?
3. Fais la liste des réactifs et des produits de la transformation chimique évoquée dans l'énoncé.
2. Quel test permet de l'identifier et que produit-il ?
3. Fais la liste des réactifs et des produits de la transformation chimique évoquée dans l'énoncé.
4. Précise la formule chimique de chaque réactif et de chaque produit.
5. Écris l'équation de la réaction qui modélise cette transformation chimique, sans te soucier d'ajuster les coefficients devant les formules.
6. Ajuste ces coefficients afin que l'équation traduise la conservation des éléments et des charges.
5. Écris l'équation de la réaction qui modélise cette transformation chimique, sans te soucier d'ajuster les coefficients devant les formules.
6. Ajuste ces coefficients afin que l'équation traduise la conservation des éléments et des charges.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je m'entraine
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14
Trouve le bon pH.
Ismaël a dilué une solution acide de pH = 3,0, et met au défi Mélanie de trouver la solution qu'il a obtenue parmi deux autres.
1. À ton avis, quelle est la solution obtenue ? Justifie ta réponse.

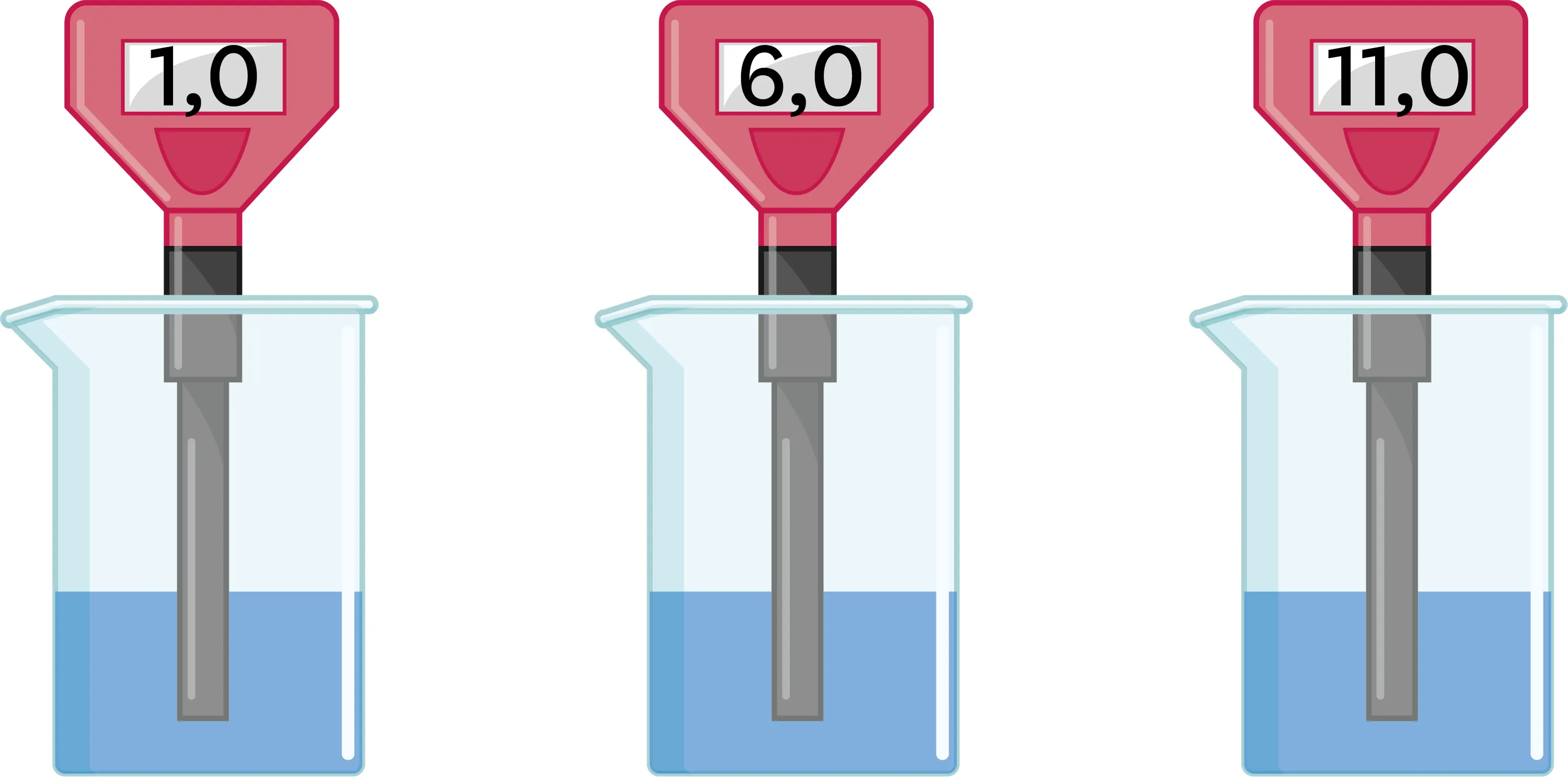
1. À ton avis, quelle est la solution obtenue ? Justifie ta réponse.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15
Trouve le bon pH.
C'est au tour de Mélanie de diluer une solution basique de pH = 11,0. Elle défie Ismaël de trouver la solution qu'elle a obtenue parmi deux autres.
1. À ton avis, quelle est la solution obtenue ? Justifie ta réponse.


1. À ton avis, quelle est la solution obtenue ? Justifie ta réponse.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16
À chacun son diagramme.
Compétence
Comprendre et interpréter des tableaux ou des documents graphiques.
Les diagrammes suivants représentent les proportions en ions H + et en ions HO− dans différentes solutions.
1. À quel diagramme correspond la solution acide ?
2. À quel diagramme correspond la solution basique ?
3. En t'inspirant de ces diagrammes, propose le diagramme pour une solution neutre.

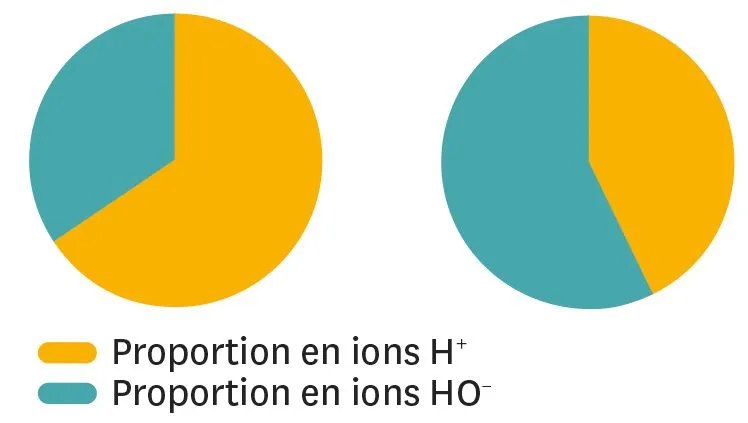
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17
Connaitre les espèces d'une réaction.
Obtenu en dissolvant du chlorure d'hydrogène gazeux dans l'eau, l'acide chlorhydrique réagit avec le fer en produisant un dégagement gazeux.
1. Quel est l'ion présent dans l'acide chlorhydrique qui réagit avec le fer ?
2. Par quel terme désigne-t-on l'autre ion présent mais qui ne réagit pas ?
3. Quel est le test qui permet de mettre en évidence cet ion ?
4. Comment s'appelle le gaz formé lors de la réaction de l'acide chlorhydrique avec le fer ?
5. Quel est le test qui permet de le mettre en évidence ?
6. Quel est l'ion formé lors de cette réaction ?
1. Quel est l'ion présent dans l'acide chlorhydrique qui réagit avec le fer ?
2. Par quel terme désigne-t-on l'autre ion présent mais qui ne réagit pas ?
3. Quel est le test qui permet de mettre en évidence cet ion ?
4. Comment s'appelle le gaz formé lors de la réaction de l'acide chlorhydrique avec le fer ?
5. Quel est le test qui permet de le mettre en évidence ?
6. Quel est l'ion formé lors de cette réaction ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18
Protocole de mesure du pH avec un papier-pH.
Mounia souhaite vérifier rapidement le pH de deux solutions grâce à du papier-pH. La première solution est de pH = 2,0. La deuxième solution est de pH = 9,0.
1. D'après l'échelle de couleur du papier-pH, de quelle couleur sera son papier-pH au contact de la solution de pH = 2,0 ?
2. D'après l'échelle de couleur du papier-pH, de quelle couleur sera son papier-pH au contact de la solution de pH = 9,0 ?
3. Propose le protocole que doit respecter Mounia pour mesurer le pH d'une solution avec du papier-pH en utilisant les mots suivants : bécher, agitateur en verre, papier-pH.


1. D'après l'échelle de couleur du papier-pH, de quelle couleur sera son papier-pH au contact de la solution de pH = 2,0 ?
2. D'après l'échelle de couleur du papier-pH, de quelle couleur sera son papier-pH au contact de la solution de pH = 9,0 ?
3. Propose le protocole que doit respecter Mounia pour mesurer le pH d'une solution avec du papier-pH en utilisant les mots suivants : bécher, agitateur en verre, papier-pH.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19
Comparaison des techniques de mesure du pH.
Il existe deux techniques couramment utilisées pour mesurer le pH : la mesure avec un pH-mètre, la mesure avec du papier-pH.
1. Quelle est la technique la plus rapide à utiliser ?
2. Quelle est la technique la plus précise ?
3. Pierre a mesuré le pH d'une solution et a obtenu une valeur de 6,4. Quelle technique a-t-il utilisée ?
1. Quelle est la technique la plus rapide à utiliser ?
2. Quelle est la technique la plus précise ?
3. Pierre a mesuré le pH d'une solution et a obtenu une valeur de 6,4. Quelle technique a-t-il utilisée ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20
Étiquette de sécurité et protection.
Compétence
Agir de façon responsable, respecter les règles de sécurité.
Thibault s'apprête à utiliser une solution d'acide sulfurique concentrée. Le pictogramme présent sur la bouteille l'interpelle.
1. Que signifie le pictogramme ?
2. Quels moyens de protection doit employer Thibault ?
3. Comment peut-il diminuer la dangerosité de son produit avant de l'utiliser ?
1. Que signifie le pictogramme ?
2. Quels moyens de protection doit employer Thibault ?
3. Comment peut-il diminuer la dangerosité de son produit avant de l'utiliser ?


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21
Protocole d'une dilution.
Compétence
Concevoir une expérience pour tester une hypothèse.
Nicolas souhaite diluer dix fois une solution de soude de 10 mL.
1. Quel est le volume final de la solution diluée ?
2. Propose un protocole pour réaliser la dilution avec les mots suivants : bécher, prélever, pipette jaugée de 10 mL, fiole jaugée de 100 mL, trait de jauge.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Compétence : Interpréter des résultats.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22Les changements liés à une transformation chimique. Transformation chimique ou non ?
Adrien ajoute de la soude (solution d'ions Na+ et HO−) à une solution acide. Il constate un échauffement assez important de la solution. À l'aide de papier-pH, il constate que le pH de la solution a augmenté. Des mesures permettent de conclure que tous les ions Na+ ajoutés dans la solution sont encore présents à la fin de l'ajout.
1. Quelle information te permet de supposer qu'une transformation chimique a eu lieu ?
2. Quelle indication sur les ions H+ t'est donnée par la variation de pH ?
3. Comment qualifie-t-on alors les ions H+ vis-àvis de la transformation chimique ?
4. Indique si la quantité d'ions Na+ a varié lors de cette transformation chimique.
5. Déduis-en le second réactif de cette transformation.
1. Quelle information te permet de supposer qu'une transformation chimique a eu lieu ?
2. Quelle indication sur les ions H+ t'est donnée par la variation de pH ?
3. Comment qualifie-t-on alors les ions H+ vis-àvis de la transformation chimique ?
4. Indique si la quantité d'ions Na+ a varié lors de cette transformation chimique.
5. Déduis-en le second réactif de cette transformation.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22Les changements liés à une transformation chimique. Transformation chimique ou non ?
Amel ajoute de l'eau à une solution acide. Elle n'observe pas de changement à l'œil nu (hormis l'augmentation due au volume ajouté). À l'aide de papier-pH, elle constate que le pH de la solution a augmenté.
1. Détermine si les observations présentées permettent de conclure qu'il y a eu une transformation chimique.
2. Indique alors si le nombre d'ions H+ a varié ou non.
3. Indique si le volume total de solution a augmenté ou non.
4. Déduis-en si la variation de pH peut être expliquée malgré l'absence de transformation chimique.
1. Détermine si les observations présentées permettent de conclure qu'il y a eu une transformation chimique.
2. Indique alors si le nombre d'ions H+ a varié ou non.
3. Indique si le volume total de solution a augmenté ou non.
4. Déduis-en si la variation de pH peut être expliquée malgré l'absence de transformation chimique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22Les changements liés à une transformation chimique. Transformation chimique ou non ?
Jade ajoute un morceau de fer dans une solution acide. Elle observe un dégagement gazeux qui provoque une détonation lorsque l'on approche une flamme. Elle constate que le volume du morceau de fer a diminué et, à l'aide d'un papier-pH, elle observe que le pH de la solution a augmenté.
1. Détermine si une transformation chimique a eu lieu ou non. Justifie ta réponse.
2. Écris le bilan de la transformation si celle-ci a eu lieu.
1. Détermine si une transformation chimique a eu lieu ou non. Justifie ta réponse.
2. Écris le bilan de la transformation si celle-ci a eu lieu.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
J'approfondis
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23Les mathématiques de la dilution.
Compétence
Pratiquer le calcul numérique et le calcul littéral.
Le facteur de dilution désigne le nombre de fois qu'une solution initiale a été diluée. Par exemple, une solution de volume initial Vi = 50 mL diluée d'un facteur 2 a un volume final Vf = 100 mL. Dans un protocole expérimental, la consigne sera par exemple : « Diluer 2 fois la solution initiale de 50 mL ». La formule mathématique reliant les deux volumes pour un facteur de dilution de 2 est donc Vf = 2 × Vi.
1. Soit la consigne : « Dans une fiole jaugée, diluer 2 fois la solution initiale de 75 mL ». Quel est le volume final de la solution obtenue ?
2. Le professeur t'indique que la solution qu'il tient dans les mains fait 50 mL et qu'il l'a obtenue après avoir dilué 2 fois une solution initiale. Quel est le volume de la solution initiale ?
3. En t'inspirant de la formule donnée, écris la formule mathématique reliant Vi et Vf dans le cas d'une dilution d'un facteur 10.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24Le chou rouge.

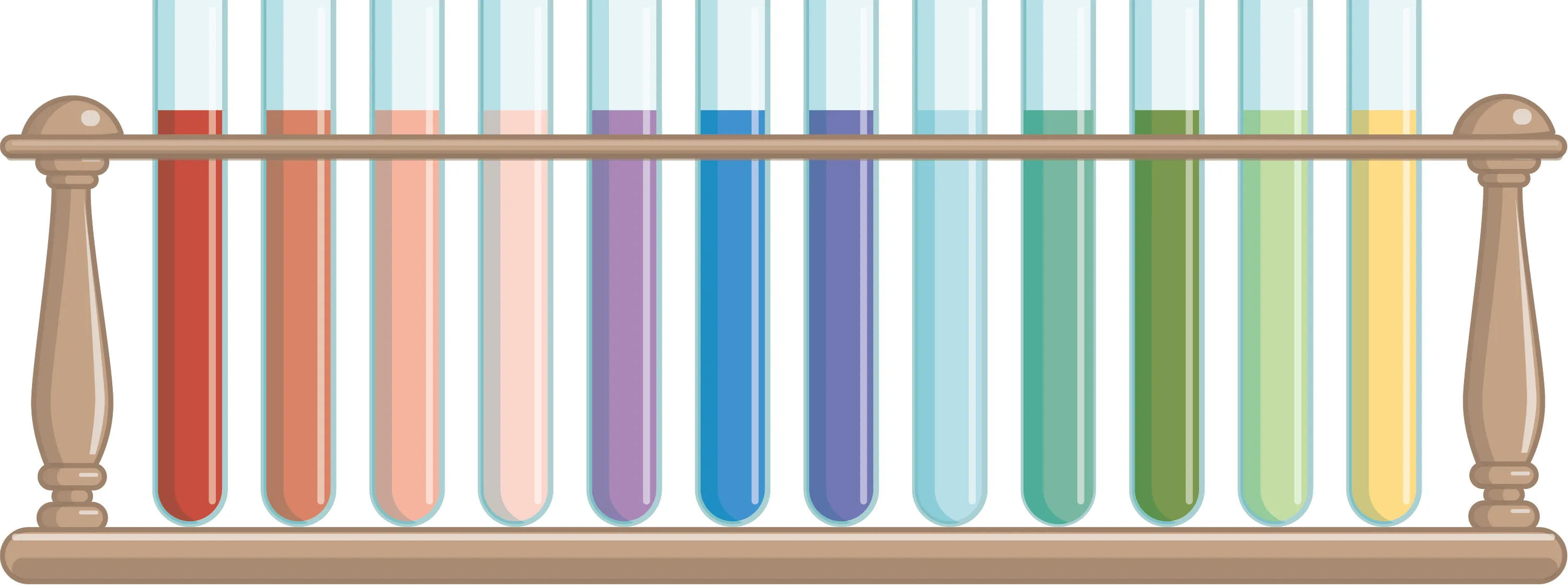
Le jus du chou rouge peut être récupéré en faisant bouillir les feuilles dans de l'eau chaude. Le jus a la particularité de prendre des couleurs différentes en fonction du pH.
1. À quel matériel de mesure de pH te fait penser le jus de chou rouge ?
2. Pour un pH donné, les résultats sont-ils exactement identiques entre le jus de chou rouge et ce matériel ?
3. Le jus de chou rouge avec du bicarbonate de soude donne une couleur bleu pâle. Quel est son pH ?
2. Pour un pH donné, les résultats sont-ils exactement identiques entre le jus de chou rouge et ce matériel ?
3. Le jus de chou rouge avec du bicarbonate de soude donne une couleur bleu pâle. Quel est son pH ?
4. Le jus de chou rouge avec du liquide extrait de ton effaceur donne une couleur jaune-vert. Quel est son pH ?
5. Quelle sera la couleur prise par le jus de chou rouge avec du jus de citron de pH = 2,3 ?
5. Quelle sera la couleur prise par le jus de chou rouge avec du jus de citron de pH = 2,3 ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25L'œuf rebondissant..
Compétence
Concevoir une expérience pour tester une hypothèse.


La réaction de la coquille d'œuf dans le vinaigre d'alcool permet d'obtenir après 24 h de réaction l'œuf cru sans sa coquille. Celle-ci est constituée des ions carbonate CO 32− et des ions calcium Ca2+. Le vinaigre d'alcool blanc est constitué comme tous les vinaigres d'acide acétique CH3 COOH. L'œuf obtenu après 24 h environ de réaction a un aspect translucide.
1. Quel phénomène permet de savoir qu'une réaction chimique a lieu lorsque l'œuf est plongé dans le vinaigre ?
2. Morgane suppose que le gaz qui est produit est du dihydrogène. Nassim pense que c'est du dioxyde de carbone. Propose une (ou des) expérience(s) pour savoir qui a raison en illustrant avec des schémas.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26Mélange de deux liquides au même pH.
Compétence
Mettre en oeuvre un raisonnement logique simple pour résoudre un problème.
Kaïa désire préparer une solution de 20 mL d'acide chlorhydrique de pH = 2,0. Se trompant dans ses calculs, elle prépare d'abord une solution de 10 mL d'acide chlorhydrique de pH = 2,0.
1. Julien lui dit que ce n'est pas grave et qu'elle peut directement rajouter 10 mL d'eau distillée. Elle aura ainsi 20 mL d'acide chlorhydrique de pH = 2,0. A-t-il raison ? Justifie ta réponse.
2. Kaïa pense plutôt préparer à nouveau 10 mL d'acide chlorhydrique à pH = 2,0. A-t-elle raison ? Tu pourras justifier à l'aide de schémas représentant les béchers et faisant apparaitre symboliquement (sous forme de boules, par exemple) des ions H+.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27 Vers la notion de dosage.
Le dosage est une technique utilisée pour déterminer la concentration d'une espèce en solution, par exemple celle d'un acide en solution dans le cas d'un dosage acido-basique. Ce dosage est volumétrique : on cherche le volume minimal de solution basique à introduire dans l'échantillon de solution acide que contient le bécher pour que chaque ion hydrogène initialement présent soit consommé par un ion hydroxyde apporté. Ci-dessous la courbe de dosage d'une solution d'acide chlorhydrique par de la soude.

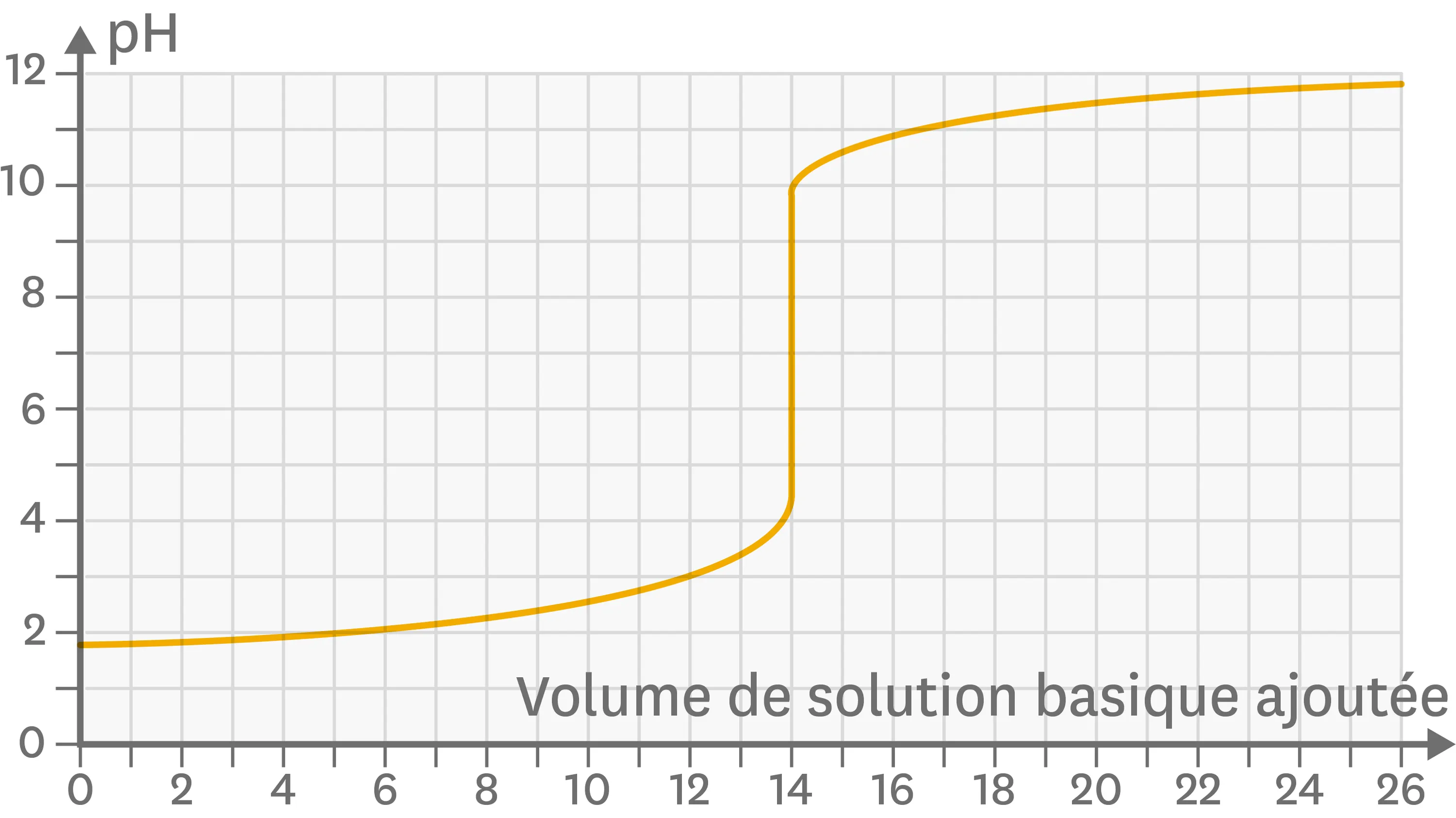 Courbe de dosage d'une solution d'acide chlorhydrique par de la soude.
Courbe de dosage d'une solution d'acide chlorhydrique par de la soude.


1. Quel est le pH de la solution initiale ?
2. Quel est le pH pour un volume de soude versé de 25 mL ?
3. Pour quel intervalle de volumes de soude ajoutés la solution obtenue est-elle acide ?
4. À quel volume précisément as-tu une solution neutre ?
5. Quel est le volume qui est intéressant pour exploiter ce dosage ?
2. Quel est le pH pour un volume de soude versé de 25 mL ?
3. Pour quel intervalle de volumes de soude ajoutés la solution obtenue est-elle acide ?
4. À quel volume précisément as-tu une solution neutre ?
5. Quel est le volume qui est intéressant pour exploiter ce dosage ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
28 Réaction de l'acide chlorhydrique avec l'aluminium.
Tout comme le fer, l'aluminium peut réagir avec l'acide chlorhydrique. L'équation de réaction est 2 Al + 6 H+ → 2 Al3+ + 3 H2.
1. Quels sont les produits de la réaction ?
2. Lequel est un gaz ?
3. Comment l'identifier ?
2. Lequel est un gaz ?
3. Comment l'identifier ?
4. Comment varie la population des ions H+ durant la réaction ?
5. Comment le vérifier ?
5. Comment le vérifier ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
29 L'incendie du Hindenburg.


Le Hindenburg est le plus grand ballon dirigeable commercial jamais réalisé. Il fut construit par la firme allemande Zeppelin et s'envola pour la première fois le 4 mars 1936. Un jour d'orage, il fit une escale à Lakehurst dans le New Jersey, le 6 mais 1937, et prit soudainement feu à l'atterrissage. Comme tous les gros ballons dirigeables de l'époque, le gaz utilisé pour le faire voler était du dihydrogène, moins cher et moins rare que l'hélium qui fut employé ensuite.
1 Donne une réaction chimique permettant de produire du dihydrogène. Tu rappelleras l'équation de cette réaction.
2. Quel test permet d'identifier le dihydrogène ?
3. Propose une explication sur l'origine de l'incendie du Hindenburg.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30 Relation mathématique entre la concentration, la masse et le volume.
La concentration exprimée en g/L dépend de la masse de soluté présent dans une solution. Elle est appelée concentration massique. Sa formule mathématique est C = \dfrac{m}{V} avec C la concentration en g/L, m la masse de soluté en g et V en L.
1. Pour une masse de soluté donnée, comment varie la concentration d'une solution lorsque le volume augmente ?
2. Quelle est la transformation physique qui consiste à augmenter le volume d'une solution ?
3. Comment varie la concentration de la solution si tu y ajoutes du soluté sans ajouter de solvant ?
4. L'acide acétylsalicylique est connu sous le nom d'aspirine. Un comprimé classique pèse 500 mg. Quelle est la concentration d'acide acétylsalicylique lorsque tu dissous un comprimé dans un grand verre d'eau de 25 cL ?
1. Pour une masse de soluté donnée, comment varie la concentration d'une solution lorsque le volume augmente ?
2. Quelle est la transformation physique qui consiste à augmenter le volume d'une solution ?
3. Comment varie la concentration de la solution si tu y ajoutes du soluté sans ajouter de solvant ?
4. L'acide acétylsalicylique est connu sous le nom d'aspirine. Un comprimé classique pèse 500 mg. Quelle est la concentration d'acide acétylsalicylique lorsque tu dissous un comprimé dans un grand verre d'eau de 25 cL ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je résous un problème
Compétence : Mettre en oeuvre un raisonnement logique simple pour résoudre un problème.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Les dépôts de calcaire sont un problème commun de notre quotidien. Ils apparaissent dans les salles de bain, les toilettes. Ils peuvent boucher des conduits et donnent un aspect sale. Heureusement, on peut éliminer ces dépôts avec des produits communs. Explique pourquoi et quels produits utiliser.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Quelques données sur le calcaire.
Le calcaire est une roche sédimentaire principalement composée de carbonate de calcium. C'est la roche la plus courante en France. Elle est reconnaissable à sa teinte blanche, caractéristique des craies. Elle est très soluble dans l'eau et présente la capacité de réagir avec des acides selon l'équation de réaction suivante :
H+ + HCO3- \rightarrow H2O + CO2.
H+ + HCO3- \rightarrow H2O + CO2.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2pH de quelques produits communs.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercices supplémentaires
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31 Teste tes connaissances.
1. Le pH d'une solution est caractéristique :
2. Pour un volume donné, une solution est dite acide quand :
2. Pour un volume donné, une solution est dite acide quand :
3. L'action de diluer une solution :
4. Une réaction acido-basique est :
5. Lors d'une réaction acido-basique, le pH final dépend :
4. Une réaction acido-basique est :
5. Lors d'une réaction acido-basique, le pH final dépend :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
32 Calcul de masse et de volume.
La réaction chimique entre 2 g de fer et de l'acide chlorhydrique conduit à la formation de 4,54 g de chlorure de fer II (Fe2+ + 2 Cl-) et 0,00086 m3 de dihydrogène gazeux.
1. Quelle serait la masse de chlorure de fer II obtenue en utilisant 6 g de poudre de fer ?
2. Quelle est la masse de fer nécessaire pour obtenir 10 L de dihydrogène gazeux ?
1. Quelle serait la masse de chlorure de fer II obtenue en utilisant 6 g de poudre de fer ?
2. Quelle est la masse de fer nécessaire pour obtenir 10 L de dihydrogène gazeux ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
33 Les types de solutions.
1. À l'aide des notions clés, définis les différents types de solution.
solution acide - ions H+ - ions HO- - quantité - élevée - solution basique - solution neutre - égale - volume
solution acide - ions H+ - ions HO- - quantité - élevée - solution basique - solution neutre - égale - volume
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Parcours de compétences
Compétence : Interpréter des résultats.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Certains métaux ne peuvent pas être utilisés pour conserver des produits acides. Quand on fait l'expérience ci-contre, des bulles de gaz se dégagent et la poudre d'aluminium disparait petit à petit. L'équation de la réaction est : 2 Al + 6 H+ \rightarrow 2 Al3+ + 3 H2.
Explique pourquoi un matériau en aluminium ne peut pas être utilisé pour conserver une espèce acide. Vérifie ensuite que cette équation est écrite correctement.
Explique pourquoi un matériau en aluminium ne peut pas être utilisé pour conserver une espèce acide. Vérifie ensuite que cette équation est écrite correctement.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 1
J'identifie les résultats obtenus.
Coup de pouce
Dans l'équation de réaction, repère les formules chimiques des espèces qui réagissent ensemble, et celles des espèces qui se forment.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 2
Je donne du sens aux résultats.
Coup de pouce
Compare les formules chimiques des espèces qui réagissent ensemble avec les formules de celles qui se forment.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 3
Je présente les idées qui permettent d'expliquer les résultats.
Coup de pouce
Explique comment se forment la molécule de dihydrogène (H2) et l'ion Al3+.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 4
J'interprète mes résultats en structurant mes arguments.
Coup de pouce
Dans cette équation de réaction, les noyaux d'atomes et les électrons sont-ils conservés ?
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

