Chapitre 4
Cours
Évolution temporelle d'une transformation chimique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Transformation chimique lente ou rapide
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ACinétique
La cinétique est un pan de la chimie qui s'intéresse aux vitesses des
réactions chimiques.
La cinétique est l'un des aspects les plus étudiés en vue d'améliorer les conditions de production de composés synthétiques à l'échelle industrielle.
Exemple : l'oxydation des ions fer \text{(II)} \text{Fe}^{2+}(\text{aq}) par le dioxygène dissous \text{O}_2 (\text{aq}) est une réaction plutôt lente, tandis que les réactions acide-base sont des réactions en grande majorité quasi instantanées.
Les transformations chimiques peuvent avoir des vitesses très variées. Certaines nous paraissent instantanées, d'autres extrêmement lentes.
La cinétique est l'un des aspects les plus étudiés en vue d'améliorer les conditions de production de composés synthétiques à l'échelle industrielle.
Exemple : l'oxydation des ions fer \text{(II)} \text{Fe}^{2+}(\text{aq}) par le dioxygène dissous \text{O}_2 (\text{aq}) est une réaction plutôt lente, tandis que les réactions acide-base sont des réactions en grande majorité quasi instantanées.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 Wilhelm Ostwald


Le prix Nobel de chimie a été décerné à Wilhelm Ostwald en 1909 « en reconnaissance de ses travaux sur la catalyse et pour ses recherches touchant les principes fondamentaux gouvernant l'équilibre chimique et les vitesses de
réaction ».
D'après Wikipedia.org.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BCatalyseurs
Les catalyseurs sont des composés chimiques utilisés pour accélérer une réaction chimique.
Le même état final est atteint, mais plus rapidement.
Ils ne sont ni consommés ni produits au bilan de la transformation : ce ne sont donc ni des réactifs ni des produits. Ils n'apparaissent pas dans l'équation‑bilan, ils réagissent au début de la transformation, mais sont reformés ensuite.
Exemple : les pots catalytiques des voitures contiennent des métaux précieux qui accélèrent les transformations des composés d'échappement vers des composés moins toxiques. Les enzymes du corps humain sont de très bons catalyseurs.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Influence de la température

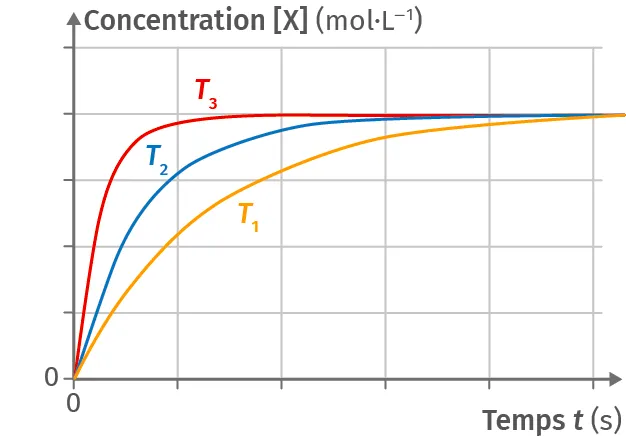
Si la concentration finale de l'espèce chimique en fin de réaction est la même, les cinétiques sont quant à elles différentes (T_1 \lt T_2 \lt T_3).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CFacteurs cinétiques
Certains paramètres expérimentaux modifient la vitesse de réaction, à la hausse ou à la baisse. On les appelle les facteurs cinétiques.
Les plus courants sont la température, le choix du solvant, l'agitation et la concentration en réactif. Dans certains procédés, la pression ou même la lumière peuvent influer, tout comme l'état de division pour un solide (plaque, poudre, etc.).
Le plus souvent, une hausse de la température ou de la concentration augmente la vitesse de réaction.
Exemple : la réaction entre le méthane \text{CH}_4(\text{g}) et le dichlore \text{Cl}_2(\text{g}) est une réaction très lente sans rayonnement électromagnétique. Sa cinétique est fortement accélérée sous une exposition à la lumière ambiante.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Un catalyseur est une substance chimique. Elle n'est pas un facteur cinétique contrairement à la température ou la lumière par exemple.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Évolution des concentrations
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AVitesse volumique
Pour étudier la cinétique d'une transformation, on suit l'évolution
temporelle de la concentration d'une espèce \text{X}(\text{aq}), réactif ou produit.
Expérimentalement, on peut donc approcher la vitesse volumique v_\text{X}(t_\text{i}) à partir de n mesures de la concentration [\text{X}] de l'espèce chimique \text{X}(\text{aq}) :
Pour suivre une cinétique de réaction, on peut réaliser :
v_\text{X}(t) = \begin{vmatrix} \dfrac{\text{d}[\text{X}]}{\text{d}t} \end{vmatrix}
v_\text{X}(t) : vitesse volumique de disparition ou d'apparition de \text{X}(\text{aq}) (mol·L‑1·s‑1)
[\text{X}] : concentration de \text{X}(\text{aq}) (mol·L‑1)
t : temps (s)
[\text{X}] : concentration de \text{X}(\text{aq}) (mol·L‑1)
t : temps (s)
Expérimentalement, on peut donc approcher la vitesse volumique v_\text{X}(t_\text{i}) à partir de n mesures de la concentration [\text{X}] de l'espèce chimique \text{X}(\text{aq}) :
v_\text{X}(t_\text{i}) = \begin{matrix} \dfrac{[\text{X}](t_{\text{i}+1}) - [\text{X}](t_\text{i})}{t_{\text{i}+1} - t_\text{i}} \end{matrix}
Pour suivre une cinétique de réaction, on peut réaliser :
- un suivi conductimétrique dans le cas d'une évolution de la concentration des ions dans le milieu réactionnel ;
- un suivi spectrophotométrique dans le cas d'une évolution de l'absorbance de la solution ;
- un suivi par titrage pH-métrique après trempe dans le cas d'une évolution de la concentration en ion oxonium \text{H}_3\text{O}^+(\text{aq}).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BTemps de demi-réaction
Le temps de demi-réaction t_{1/2} est la durée nécessaire pour atteindre la moitié de l'avancement final.
Dans le cas d'une réaction totale, il s'agit du temps pour que la moitié de la quantité initiale en réactif limitant disparaisse et que la moitié de la quantité finale de produits formés apparaisse lors de la réaction.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3 Suivi expérimental


Ce colorimètre est utilisé pour un suivi cinétique par spectrophotométrie.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4 Temps de demi-réaction

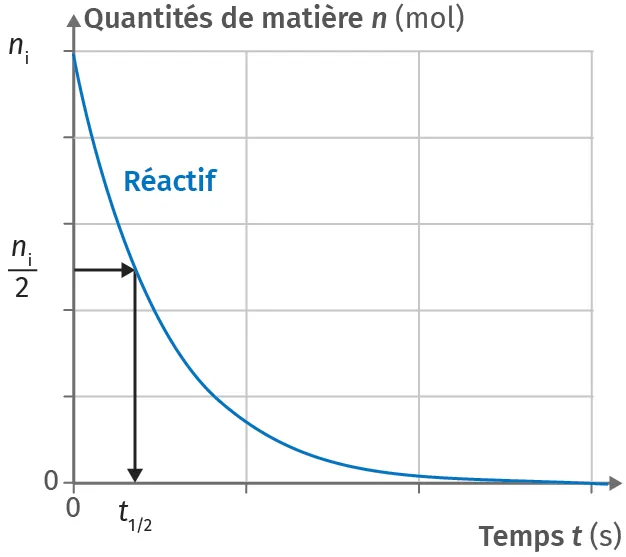
Pour une réaction totale, le temps de demi‑réaction t_{1/2} est obtenu graphiquement en relevant l'abscisse du point où la moitié de la quantité de matière initiale d'un réactif est consommée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CLoi de vitesse d'ordre 1
Pour les réactions dites d'ordre 1 par rapport à un réactif \text{X}(\text{aq}), la vitesse volumique v_\text{X} de disparition est liée à la concentration du r�éactif [\text{X}] par la relation :
Le temps de demi-réaction d'une réaction d'ordre 1 ne dépend que de k, et donc de la température, mais pas de la concentration initiale en réactif.
v_\text{X} = k \cdot [\text{X}]
v_\text{X} : vitesse volumique de disparition de \text{X}(\text{aq}) (mol·L‑1·s‑1)
k : constante de vitesse (s-1)
[\text{X}] : concentration de \text{X}(\text{aq}) (mol·L-1)
k : constante de vitesse (s-1)
[\text{X}] : concentration de \text{X}(\text{aq}) (mol·L-1)
La courbe représentant l'évolution de v en fonction de la concentration [\text{X}] correspond alors à une droite passant par l'origine.
Le temps de demi-réaction d'une réaction d'ordre 1 ne dépend que de k, et donc de la température, mais pas de la concentration initiale en réactif.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 5 Ordre de réaction

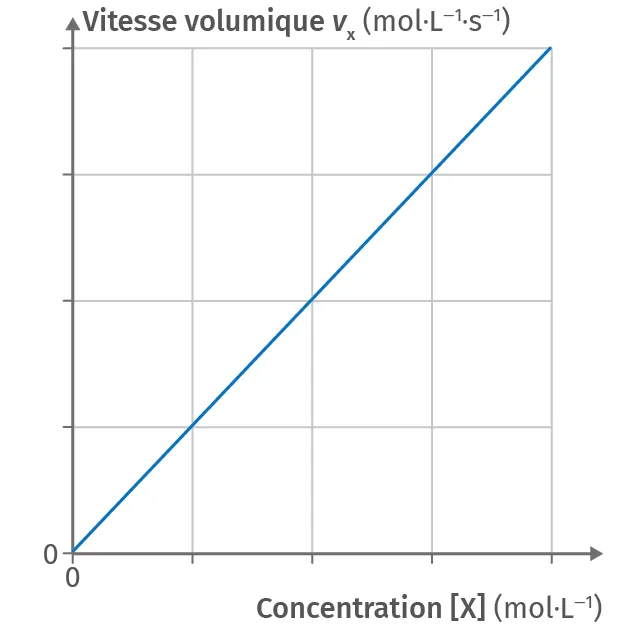
Pour une réaction d'ordre 1 par rapport à un réactif \text{X}, la courbe représentant l'évolution de la vitesse de disparition v_\text{X} en fonction de [\text{X}] est une droite passant par l'origine.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Modélisation microscopique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AMécanismes réactionnels
Une transformation chimique peut être représentée comme la
succession d'actes élémentaires.
Un acte élémentaire est un événement à l'échelle microscopique qui se traduit par un choc entre deux entités. Lors de cette rencontre, des liaisons se brisent, d'autres se forment et de nouvelles espèces chimiques apparaissent.
Les composés formés, puis consommés au cours des différentes
étapes élémentaires sont des intermédiaires réactionnels. Ils
n'apparaissent pas dans l'équation-bilan de la réaction.
Dans le mécanisme réactionnel, les flèches courbes représentent le mouvement des électrons. Ceux-ci sont orientés du site donneur (un doublet d'électrons) vers le site accepteur (un atome portant une charge partielle ou totale positive).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BInfluence d'un catalyseur
L'utilisation d'un catalyseur modifie le mécanisme réactionnel. Une
étape lente est remplacée par plusieurs étapes rapides.
Cette modification du mécanisme réactionnel n'influe pas sur l'équation‑bilan : les catalyseurs consommés se reforment nécessairement au cours du mécanisme.
Cette modification du mécanisme réactionnel n'influe pas sur l'équation‑bilan : les catalyseurs consommés se reforment nécessairement au cours du mécanisme.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Mécanisme
Mécanisme : le mécanisme d'une transformation chimique est le détail des étapes élémentaires la constituant.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 6 Nickel de Raney


Le nickel de Raney est produit en traitant un morceau d'alliage nickel-aluminium par la soude concentrée. Au cours de ce traitement appelé « activation » ou « lixiviation », la majeure partie de l'aluminium de l'alliage [réagit et passe en solution sous forme d'ion aluminium \text{Al}^{3+}(\text{aq})]. La structure poreuse qui en résulte possède une surface spécifique très importante, ce qui contribue à son efficacité en catalyse.
D'après Wikipedia.org.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CThéorie des collisions
Pour qu'il y ait une réaction, il faut des chocs (ou collisions) entre
entités chimiques au niveau microscopique. Chaque collision n'aboutit pas à une réaction. L'efficacité indique le nombre de réactions par rapport au nombre de collisions.
Plus les collisions sont fréquentes, plus la réaction est rapide. Certains paramètres physico-chimiques permettent d'augmenter le nombre de collisions comme la concentration en réactif ou la température.
Plus les collisions sont fréquentes, plus la réaction est rapide. Certains paramètres physico-chimiques permettent d'augmenter le nombre de collisions comme la concentration en réactif ou la température.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Visualisez l'influence des facteurs cinétiques sur .
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
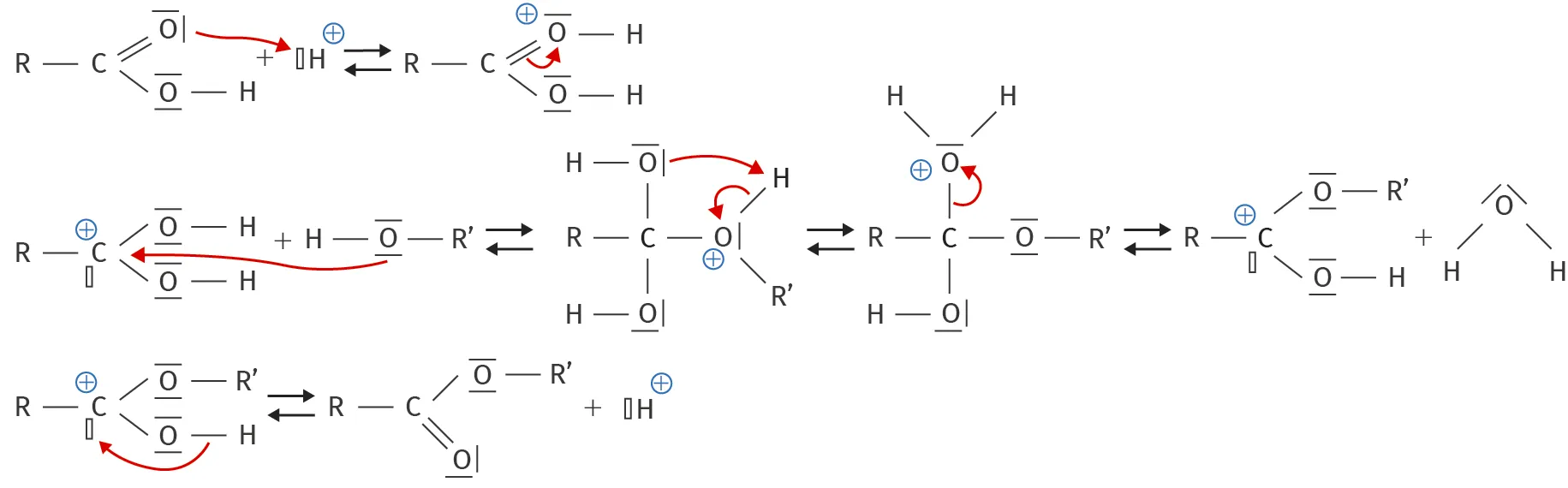
Doc. 7 Mécanisme réactionnel d'une estérification

Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

