Chapitre 2
La Physique-Chimie autrement
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Histoire des sciencesÀ quoi ressemble un atome ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1De l'atome grec à celui de Thomson.
Jusqu'à la fin du XIXe siècle, on imagine l'atome comme une sphère dure uniformément remplie d'une matière mystérieuse…
La vision de l'atome bascule avec la découverte de l'électron par l'Anglais Joseph J. Thomson. Dès lors, l'atome n'est plus la plus petite entité connue puisqu'il contient des particules plus petites. Thomson imagine alors l'atome comme un amas de matière chargée positivement dans laquelle seraient incrustés des grains chargés négativement : les électrons.
La vision de l'atome bascule avec la découverte de l'électron par l'Anglais Joseph J. Thomson. Dès lors, l'atome n'est plus la plus petite entité connue puisqu'il contient des particules plus petites. Thomson imagine alors l'atome comme un amas de matière chargée positivement dans laquelle seraient incrustés des grains chargés négativement : les électrons.


Joseph J. Thomson (1856-1940).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Le modèle de Rutherford.
Le temps passe et le modèle de l'atome s'affine. En 1909, Rutherford mène une expérience célèbre : il parvient à faire passer de petites particules au travers d'atomes d'or. Il fait alors l'hypothèse suivante : s'il peut être traversé, alors l'atome n'est pas plein. Il dessine pour la première fois un noyau autour duquel tourneraient les électrons. Il faut enfin attendre l'avènement de la mécanique quantique, et notamment les travaux de Niels Bohr, pour décrire l'atome plus précisément.


Ernest Rutherford (1871-1937).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Le modèle de Rutherford amélioré par Bohr.

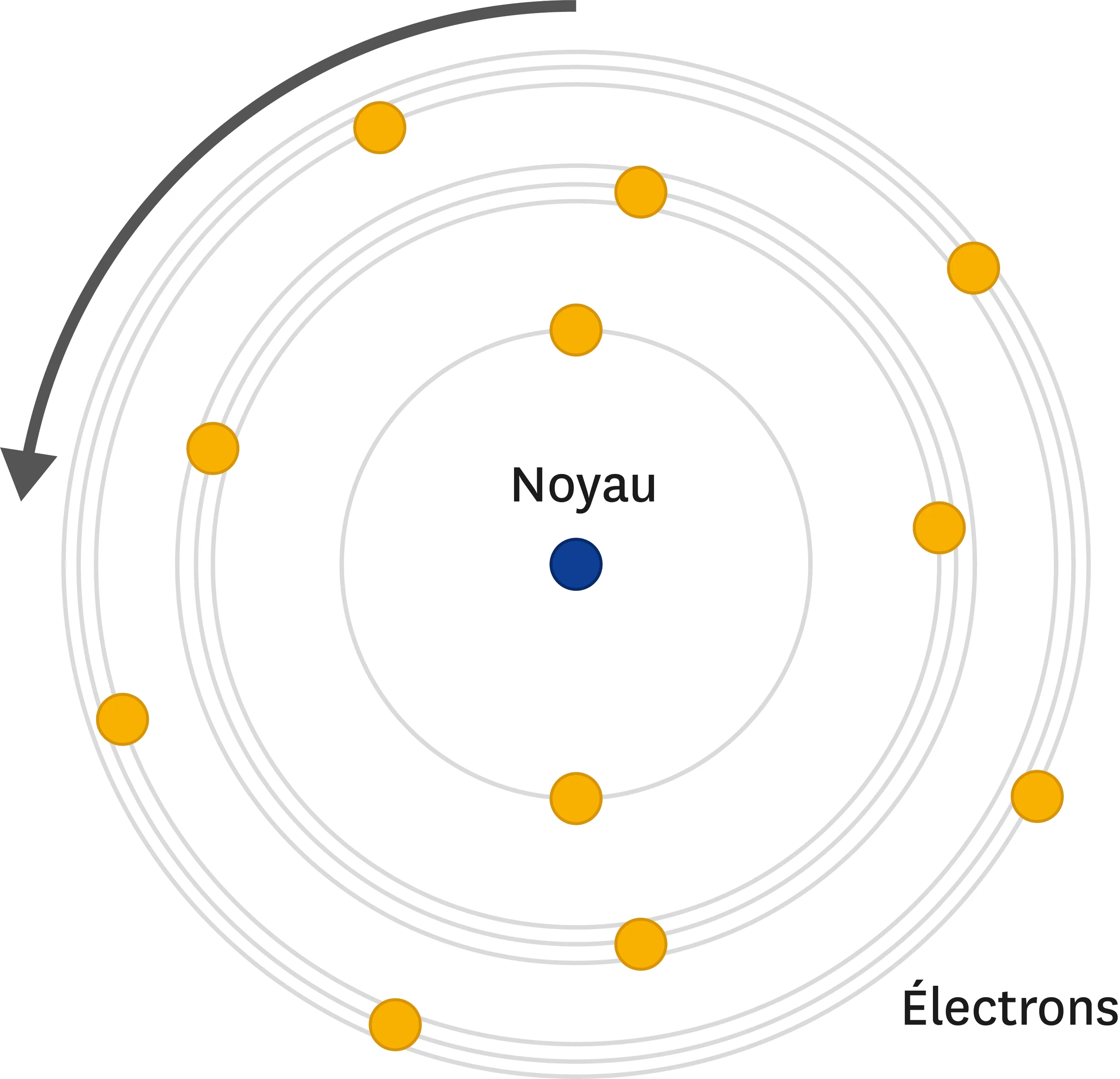
Le modèle de Rutherford amélioré par Bohr.


Niels Bohr (1885-1962).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Le mot atome vient du grec atomos qui signifie « indivisible ». On a très tôt eu l'intuition que la matière était formée par des grains que rien ne pourrait séparer : les atomes. Mais depuis l'Antiquité, les représentations ont changé, notamment avec la découverte des électrons en 1897.
1. Tu as peut-être déjà gouté au pudding anglais… Un des modèles présentés ici était surnommé Plum Pudding. Essaye de traduire ce terme, et de deviner à quel modèle il fait référence !
2. Réaliser trois dessins qui retracent l'évolution du modèle de l'atome depuis la Grèce Antique jusqu'à la modélisation de Bohr.
1. Tu as peut-être déjà gouté au pudding anglais… Un des modèles présentés ici était surnommé Plum Pudding. Essaye de traduire ce terme, et de deviner à quel modèle il fait référence !
2. Réaliser trois dessins qui retracent l'évolution du modèle de l'atome depuis la Grèce Antique jusqu'à la modélisation de Bohr.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Objet d'étudeComment fonctionne un batterie de téléphone portable ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Batterie en phase de charge.

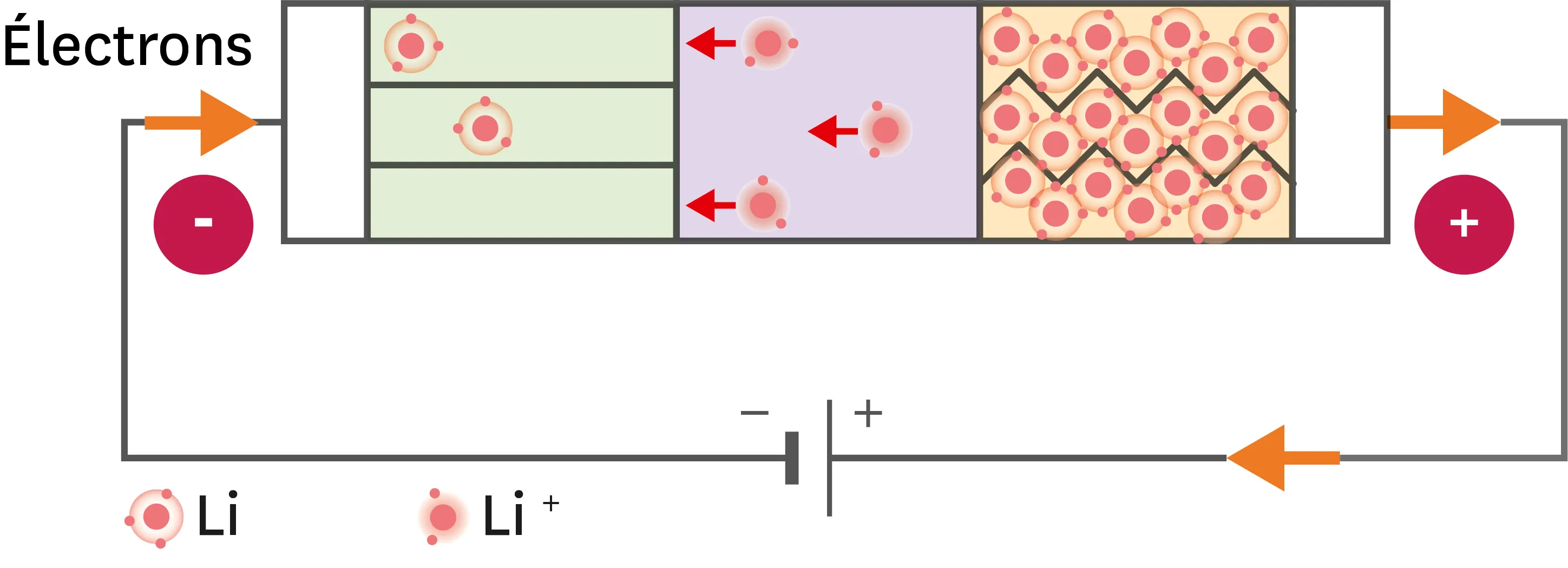
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Charger sa batterie est une préoccupation fréquente des utilisateurs de smartphones. Est-ce pour autant une expression juste électriquement ?
1. Pendant la charge, le sens de circulation des électrons est imposé par le chargeur. Comment la répartition du lithium évolue-t-elle dans la batterie ?
1. Pendant la charge, le sens de circulation des électrons est imposé par le chargeur. Comment la répartition du lithium évolue-t-elle dans la batterie ?
2. Dirais-tu que pendant la charge, la batterie acquiert une charge électrique, ou qu'elle reste neutre ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
La Physique-Chimie au quotidienEsprit scientifique
Quelle espèce chimique est responsable du gout acide ? et du gout salé ? Mène l'enquête !
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Le bicarbonate de sodium est aussi appelé bicarbonate de soude.


Attention ! Le bicarbonate de soude et la soude sont deux produits très différents ! La soude est extrêmement dangereuse et ne doit en aucun cas servir dans cette expérience.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- 4 verres d'eau.
- Du sel.
- Du bicarbonate de sodium alimentaire.
- Du vinaigre.
- Un citron.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Étapes de la fabrication :
- 1er verre : mets un peu de sel et remue.
- 2e verre : mets un peu de bicarbonate de sodium et remue.
- 3e verre : mets un peu de vinaigre.
- 4e verre : presse un peu de jus de citron.
- Goute le contenu de chaque verre !
Des questions à se poser :
1. Parmi les préparations, lesquelles ont un gout salé ? Et acide ?2. En comparant leur composition ionique, retrouve les ions responsables de ces gouts.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Quelques ingrédients et leurs ions.
| Ingrédients | Sel de table | Bicarbonate de soude | Vinaigre | Jus de citron |
| Ions associés | Na+ ; Cl- | Na+ ; HCO3- | H+ ; CH3CO2- | H+ ; C6H707- |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Les verres 1 et 2 ont tous les deux un gout salé et ont en commun l'ion sodium Na+. C'est donc probablement lui qui est responsable du gout salé. Par ailleurs, les verres et ont un gout acide et ont en commun l'ion hydrogène H+. On peut supposer que c'est lui qui est responsable du gout acide.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- La carte des saveurs qui voudrait que les papilles sensibles aux différentes soient réparties dans différentes zones sur la langue est fausse.
- Une des spécificités du goût salé par rapport aux autres saveurs est que la concentration de sel entraîne chez nous deux comportements opposés : nous sommes attirés par des faibles concentrations de sel alors que nous rejetons un aliment trop riche en sel.
- La saveur acide signale la présence d'acides pouvant être dangereux pour notre corps : elle permet notamment d'éviter la consommation de fruits non mûrs ou d'aliments contaminés par des micro-organismes qui produisent des acides lors de la fermentation.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

