Chapitre 8
Cours
Transformations chimiques forcées
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Électrolyse
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
APrincipe général
Une réaction d'oxydoréduction spontanée a lieu dans un sens bien déterminé entre l'oxydant d'un couple et le réducteur d'un autre couple. Le système chimique se rapprochant de son état d'équilibre, cette réaction ne peut pas s'inverser naturellement.
Si un générateur de courant continu est branché correctement, il peut inverser les transformations ayant lieu dans le système, permettant ainsi la conversion d'énergie électrique en énergie chimique. Cette technique est appelée électrolyse.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Carlisle et Nicholson


L'électrolyse en courant continu a vu le jour en 1800, grâce aux chimistes britanniques William Nicholson et Sir Anthony Carlisle juste après l'invention de la pile par Alessandro Volta.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BTransformation chimique forcée
Pour inverser une réaction d'oxydoréduction, il faut que le transfert d'électrons entre les couples change de sens. Cette inversion du sens de la réaction est rendue possible grâce à un générateur.
Exemple :
Pour les couples \text{I}_2(\text{aq})/\text{I}^-(\text{aq}) et \text{Zn}^{2+}(\text{aq})/\text{Zn(s)} :
Sens de la réaction spontanée : \text{Zn(s)} + \text{I}_2(\text{aq}) \rightarrow 2\ \text{I}^-(\text{aq}) + \text{Zn}^{2+}(\text{aq})
Sens de la réaction forcée : 2\ \text{I}^-(\text{aq}) + \text{Zn}^{2+}(\text{aq}) \rightarrow \text{Zn(s)} + \text{I}_2(\text{aq})
Ce qui implique les réactions aux électrodes :
2\ \text{I}^-(\text{aq}) \rightarrow \text{I}_2(\text{aq}) + 2\ \text{e}^- (sens de l'oxydation)
\text{Zn}^{2+}(\text{aq}) + 2\ \text{e}^- \rightarrow \text{Zn(s)} (sens de la réduction)
L'équation de la réaction réalisée lors d'une électrolyse est obtenue par la combinaison des demi-équations de réactions d'oxydation et de réduction faites aux électrodes.
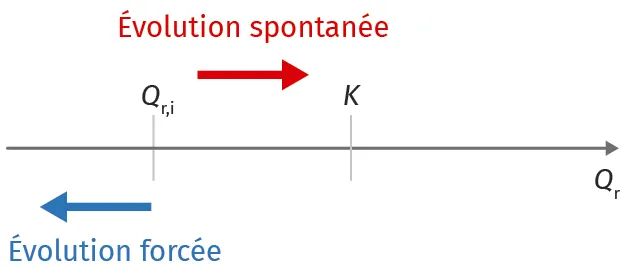
Lors d'une réaction spontanée, la proportion des produits augmente au cours de l'évolution, donc le quotient de réaction Q_\text{r} augmente et tend vers la constante d'équilibre K.
Dans le cas d'une réaction forcée dans le sens inverse, selon ce même quotient Q_\text{r}, la proportion des produits diminue, donc Q_\text{r} diminue et s'éloigne de K.
Lors d'une réaction spontanée, la proportion des produits augmente au cours de l'évolution, donc le quotient de réaction Q_\text{r} augmente et tend vers la constante d'équilibre K.
Dans le cas d'une réaction forcée dans le sens inverse, selon ce même quotient Q_\text{r}, la proportion des produits diminue, donc Q_\text{r} diminue et s'éloigne de K.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Une oxydation a lieu à l'anode (les deux mots commencent par une voyelle).
- Une réduction a lieu à la cathode (les deux mots commencent par une consonne).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Évolution chimique forcée

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
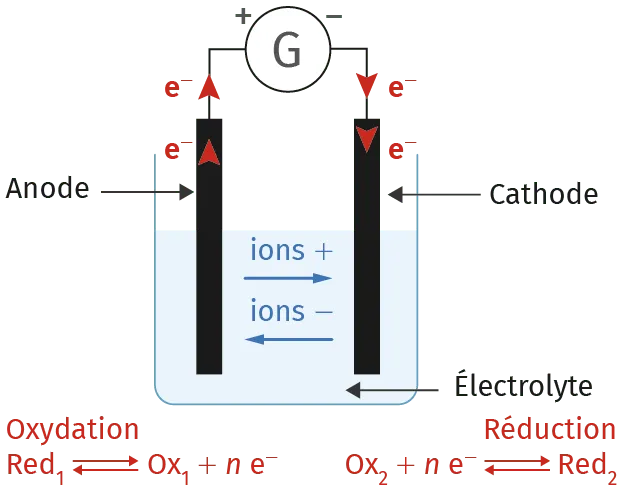
CConstitution d'un électrolyseur
Un électrolyseur comporte deux électrodes, un électrolyte ionique et un générateur de courant continu qui impose le sens de circulation des électrons.
L'électrode reliée à la borne positive du générateur capte les électrons libérés à la surface de l'électrode : une oxydation a donc lieu (anode). Pour l'électrode reliée à la borne négative, celle-ci libère les électrons à sa surface : une réduction s'y déroule (cathode).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Électrolyseur

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Bilan de matière
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ACharge électrique et intensité du courant
Durant une électrolyse, le système est traversé par une charge électrique Q, exprimée en coulomb (C), égale à :
Q = I \cdot \Delta t
Q : charge électrique (C)
I : intensité délivrée par le générateur (A)
\Delta t : durée de l'électrolyse (s)
I : intensité délivrée par le générateur (A)
\Delta t : durée de l'électrolyse (s)
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4Électrolyse de l'eau


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BCharge électrique et quantité d'électrons
La charge électrique Q est aussi égale à :
Q = n_\text{e} \cdot F
Q : charge électrique (C)
n_\text{e} : quantité d'électrons échangés (mol)
F : constante de Faraday égale à F = 96\ 500 C·mol-1
n_\text{e} : quantité d'électrons échangés (mol)
F : constante de Faraday égale à F = 96\ 500 C·mol-1
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 5Électrolyseur à production de dihydrogène


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CQuantité de matière des produits formés
Ce sont les coefficients stœchiométriques des demi-équations de réaction aux électrodes qui permettent de faire le lien entre la quantité de matière de produit n_\text{produit} et la quantité d'électrons échangés n_\text{e}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Constante de Faraday
Constante de Faraday : charge en valeur absolue d'une mole d'électrons. Un électron porte la charge -e et une mole d'électrons est constituée de N_\text{A} électrons, donc :
F = N_\text{A} \cdot e
AN : F = 6{,}022 \times 10^{23} \times 1{,}602 \times 10^{-19}
F \approx 9{,}65 \times 10^4 C·mol-1
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Application
On étudie un électrolyseur constitué d'une cathode en zinc baignant dans une solution contenant des ions \text{Zn}^{2+}(\text{aq}). Établir l'expression de la quantité de \text{Zn(s)}.
Corrigé
À la cathode d'un électrolyseur, il se produit la réduction :
Pour produire 1 mol de \text{Zn(s)}, il faut 2 mol d'électrons. On peut alors écrire :
En combinant les deux expressions donnant la charge électrique Q :
n(\text{Zn})_\text{produit} = \dfrac{I \cdot \Delta t}{2\ F}
\text{Zn}^{2+}(\text{aq}) + 2\ \text{e}^- \rightarrow \text{Zn(s)}
Pour produire 1 mol de \text{Zn(s)}, il faut 2 mol d'électrons. On peut alors écrire :
n_\text{e} = 2\ n(\text{Zn})_\text{produit}
En combinant les deux expressions donnant la charge électrique Q :
-
I \cdot \Delta t = n_\text{e} \cdot F
n(\text{Zn})_\text{produit} = \dfrac{I \cdot \Delta t}{2\ F}
Les quantités de matière des produits formés peuvent donc être déterminées. La transformation forcée s'arrête dès que l'un des réactifs est totalement consommé ou si le générateur est coupé.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Les demi-équations électrochimiques aux électrodes s'écrivent avec un signe « \rightarrow » et représentent de façon symbolique le transfert d'électrons à la surface. Il faut toujours les écrire en plaçant à droite le produit obtenu à chaque électrode par électrolyse.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Les électrons ne sont pas libérés dans l'électrolyte, les réactions d'échange (oxydation ou réduction) ont lieu à l'interface entre l'électrode (conductrice) et l'électrolyte.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Découvrez en vidéo le fonctionnement de l'électrolyse et des piles à combustible en cliquant .
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Stockage et conversion d'énergie
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
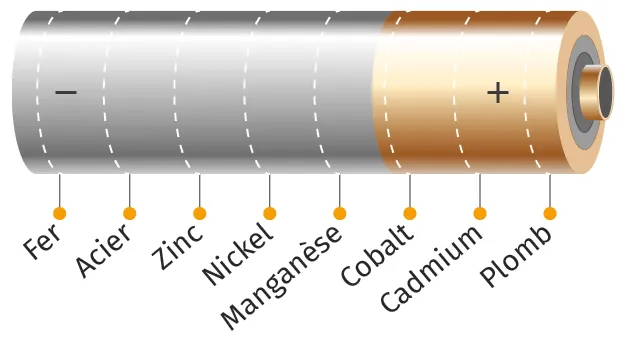
APiles
Lorsqu'elle débite un courant électrique, une pile, qu'elle soit saline, alcaline ou au lithium, convertit l'énergie chimique en énergie électrique grâce à une réaction spontanée d'oxydoréduction.
Retrouvez plus d'informations sur les piles en cliquant .
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 6Composition d'une pile

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BAccumulateurs
Les accumulateurs (souvent appelés piles rechargeables par abus de langage) sont des systèmes électrochimiques rechargeables. Lors de la décharge, une transformation d'oxydoréduction spontanée se produit et, lors de la recharge, la transformation inverse forcée permet de reformer les réactifs.

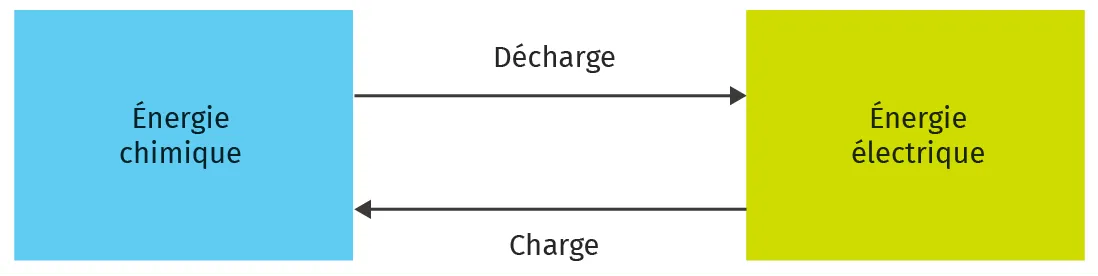
Conversion d'énergie dans un accumulateur.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Application
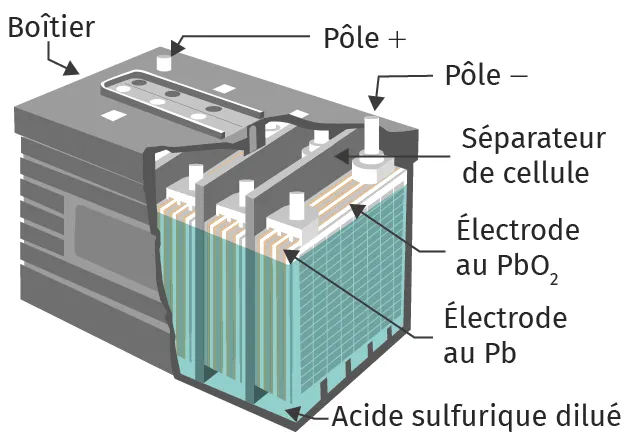
Comment fonctionne un accumulateur au plomb constituant les batteries de voiture ?
Corrigé
En décharge, la réaction spontanée est :
La lame de plomb pur s'oxyde.
En charge, la réaction forcée est :
Le sulfate de plomb se réduit à la surface de la lame de plomb pur.
\text{PbO}_2(\text{s}) + 4\ \text{H}^+(\text{aq}) + \text{Pb(s)} + 2\ \text{SO}_4^{2-}(\text{aq}) \rightarrow 2\ \text{PbSO}_4(\text{s}) + 2\ \text{H}_2\text{O(l)}
La lame de plomb pur s'oxyde.
En charge, la réaction forcée est :
2\ \text{PbSO}_4(\text{s}) + 2\ \text{H}_2\text{O(l)} \rightarrow \text{PbO}_2(\text{s}) + 4\ \text{H}^+(\text{aq}) + \text{Pb(s)} + 2\ \text{SO}_4^{2-}(\text{aq})
Le sulfate de plomb se réduit à la surface de la lame de plomb pur.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 7Schéma d'un accumulateur

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Batterie
Batterie : ensemble constitué de plusieurs accumulateurs en série. Ainsi, les batteries au plomb de voiture 12 V sont composées en général de 6 accumulateurs de 2 V en série.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
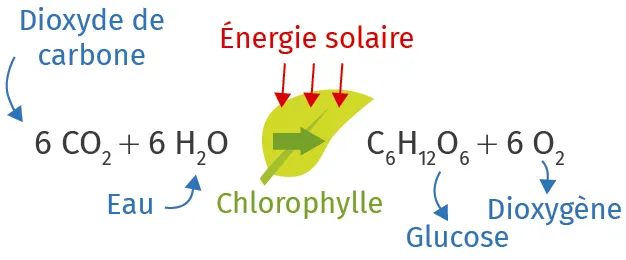
Doc. 8Équation de la photosynthèse

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
COrganismes chlorophylliens
Certaines réactions d'oxydoréduction sont forcées par un facteur extérieur, différent du courant électrique.
Dans le cas des végétaux chlorophylliens, la photosynthèse est réalisée grâce aux photons de la lumière visible. Ainsi, la plante convertit du dioxyde de carbone \text{CO}_2 en présence d'eau \text{H}_2\text{O} en matière organique qui forme une réserve d'énergie chimique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 9Herbier de posidonie


Les herbiers de posidonie, comme l'ensemble des végétaux, participent à la fixation du carbone grâce à la photosynthèse.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Découvrez la photosynthèse en vidéo :
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

