Chapitre 3
Activité 2 - Activité expérimentale
L'électroneutralité à toutes les échelles
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
La préparation de solutions ioniques occupe une part importante du temps de travail d'un technicien de laboratoire au lycée.
Comment comptabiliser les éléments ioniques à partir d'une masse de
composé dissout ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Solides ioniques et solutions électrolytiques sont électriquement neutres. Contiennent-ils autant de cations que d'anions ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 Quelques exemples de solutés
Une solution aqueuse s'obtient en introduisant un soluté (solide, liquide ou gaz) dans de l'eau distillée.
Exemple de solutés :
Cas de la dissolution de \text{CaF}_2 dans l'eau :
Exemple de solutés :
- solide ionique : sel de cuisine (\text{NaCl}) ;
- solide ionique : fluorure de calcium (\text{CaF}_2) ;
- gazeux : chlorure d'hydrogène (\text{HCl}).
Cas de la dissolution de \text{CaF}_2 dans l'eau :
\mathrm{CaF}_{2}(\mathrm{s}) \rightarrow \mathrm{Ca}^{2+}(\mathrm{aq})+2 \, \mathrm{F}^{-}(\mathrm{aq}).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Formules et masses (en 10-26 kg) de quelques cations (ions positifs) :
\text{H}^+ : 0,167 - ion hydrogène ;
\text{Na}^+ : 3,82 - ion sodium ;
\text{Ca}^{2+} : 6,66 - ion calcium.
Formules et masses (en 10-26 kg) de quelques anions (ions négatifs) :
\text{Cl}^-: 5,89 - ion chlorure ;
\text{F}^- : 3,15 - ion fluorure.
Formules et masses (en 10-26 kg) de quelques anions (ions négatifs) :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Le sel à l'échelle microscopique
Les solides ioniques ont très souvent une structure dite cristalline. Un cristal se caractérise par une disposition parfaitement ordonnée des ions qui le constituent.
Cette structure est due aux interactions électriques entre ces ions.
Cette structure est due aux interactions électriques entre ces ions.
Ex : \text{NaCl}.

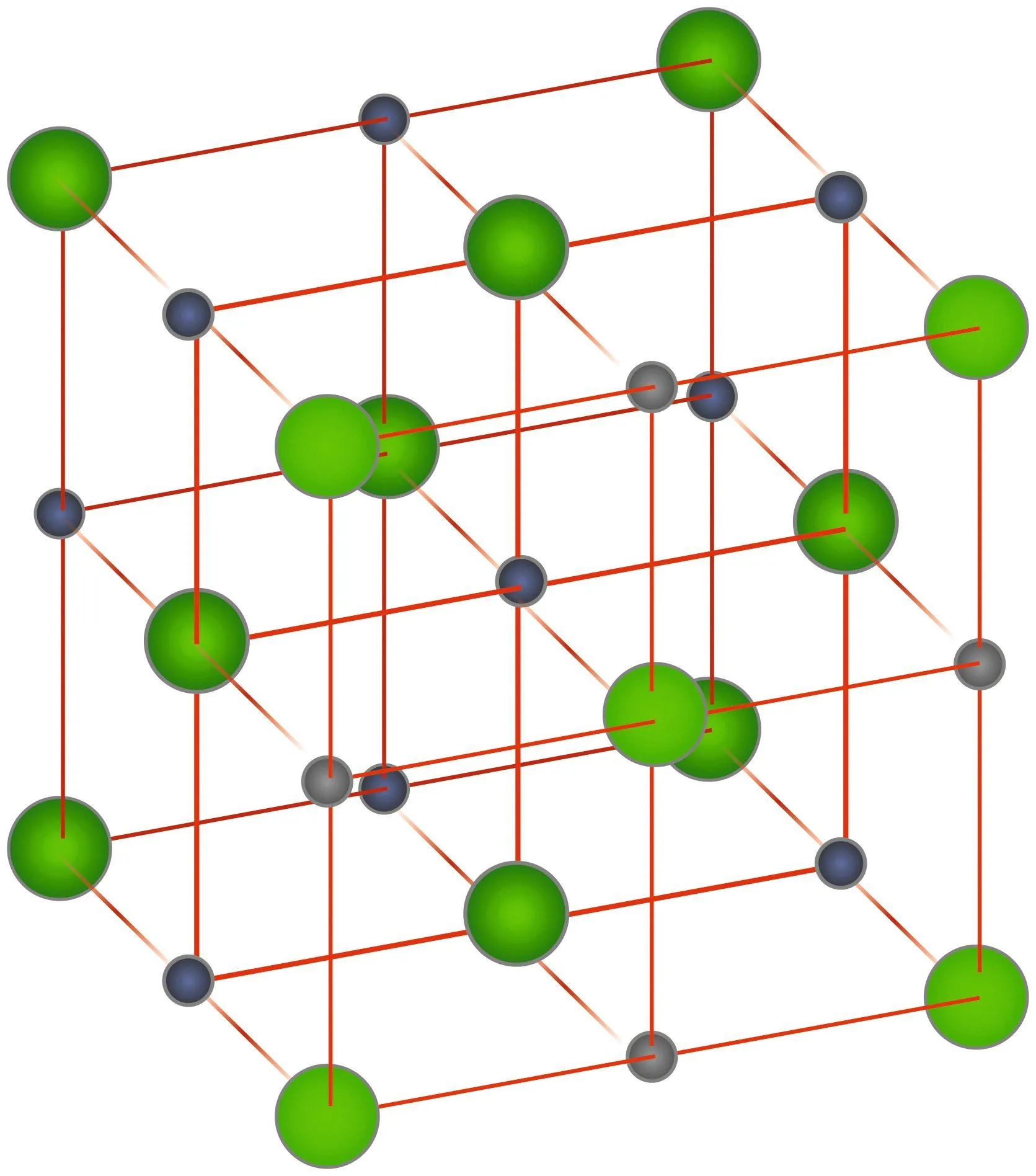
Légende : Na+ : en bleu ; Cl- : en vert.


Légende : Na+ : en bleu ; Cl- : en vert.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3 Matériel nécessaire


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
MATH : Pratiquer le calcul numérique (proportionnalité)
1. Doc. 1 et 2 Écrire l'équation de dissolution du sel de cuisine dans l'eau.
2. Doc. 3 Choisir le matériel nécessaire à la préparation d'une eau salée de concentration 7,0 g/L et justifier le choix.
3. Réaliser la préparation de 100 mL d'eau salée à 7,0 g/L.
4. Déterminer la quantité d'ions chlorure et d'ions sodium qui sont introduits lors de la préparation de 100 mL de solution à 7,0 g/L.
5. Reprendre les questions 1. et 4. pour les autres solutés proposés dans le doc. 1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
La quantité de cations et la quantité d'anions sont-elles identiques pour respecter l'électroneutralité de la solution ? Justifier.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

