Chapitre 3
Cours
Dénombrer les entités
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Constitution de la matière
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AÀ l'échelle microscopique
Depuis le début du XXe
siècle, l'existence des atomes est confirmée. Ils ont même pu être visualisés dès les années 1950 (doc. 1). À l'échelle microscopique, il faut considérer différents types de structures chimiques s'appuyant sur la notion d'atome :
la structure atomique (par exemple le fer : \text{Fe}) ;
la structure moléculaire (par exemple le saccharose : \text{C}_{12}\text{H}_{22}\text{O}_{11}) ;
la structure ionique avec des ions positifs appelés cations et des ions négatifs appelés anions (\text{Na}^+ et \text{Cl}^- dans une eau salée par exemple).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 Essayer de voir les atomes
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B À l'échelle macroscopique
La masse d'une entité chimique est en général de l'ordre de 10-26 kg.
On en compte des milliards de milliards dans le moindre échantillon de matière (environ 30 millions de milliards de milliards de molécules d'eau dans 1 L, par exemple).
Ce qui définit une espèce chimique au niveau macroscopique, c'est-à-dire à notre échelle, dépend intrinsèquement de l'entité microscopique qui la compose
Des paramètres physiques permettent de caractériser ce corps au niveau macroscopique : son état physique à une température donnée (solide, liquide ou gazeux), sa couleur, sa masse volumique, etc.
Ces paramètres sont directement liés aux interactions au niveau microscopique des entités chimiques qui constituent cette espèce chimique.
Exemple : ce qui définit le sel de cuisine, c'est l'entité \text{NaCl}. Sa structure cristalline au niveau microscopique (doc. 2) permet d'expliquer ses caractéristiques macroscopiques observées : son aspect, son état physique, etc.
Ce qui définit une espèce chimique au niveau macroscopique, c'est-à-dire à notre échelle, dépend intrinsèquement de l'entité microscopique qui la compose
Des paramètres physiques permettent de caractériser ce corps au niveau macroscopique : son état physique à une température donnée (solide, liquide ou gazeux), sa couleur, sa masse volumique, etc.
Ces paramètres sont directement liés aux interactions au niveau microscopique des entités chimiques qui constituent cette espèce chimique.
Exemple : ce qui définit le sel de cuisine, c'est l'entité \text{NaCl}. Sa structure cristalline au niveau microscopique (doc. 2) permet d'expliquer ses caractéristiques macroscopiques observées : son aspect, son état physique, etc.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
C Cas particulier des composés ioniques
On appelle composés ioniques des corps constitués d'ions liés entre eux par des interactions électrostatiques.
Mise en solution dans l'eau, ces composés ioniques se dissocient en cations (ions +) et en anions (ions -).
L'électroneutralité est vérifiée en permanence. Un composé ionique apporte donc en solution autant de charges positives que de charges négatives.
Exemple de quelques composés ioniques :\text{NaCl} (sel de cuisine, structure cristalline ordonnée) se dissocie dans l'eau en \text{Na}^+ et \text{Cl}^- ;
\text{Al}_{2}(\text{SO}_{4})_{3} (sulfate d'aluminium) se dissocie dans l'eau en 2 \text{Al}^{3+} et 3 \text{SO}^{2-}_{4}.
Mise en solution dans l'eau, ces composés ioniques se dissocient en cations (ions +) et en anions (ions -).
L'électroneutralité est vérifiée en permanence. Un composé ionique apporte donc en solution autant de charges positives que de charges négatives.
Exemple de quelques composés ioniques :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc.2 Le sel à l'échelle microscopique

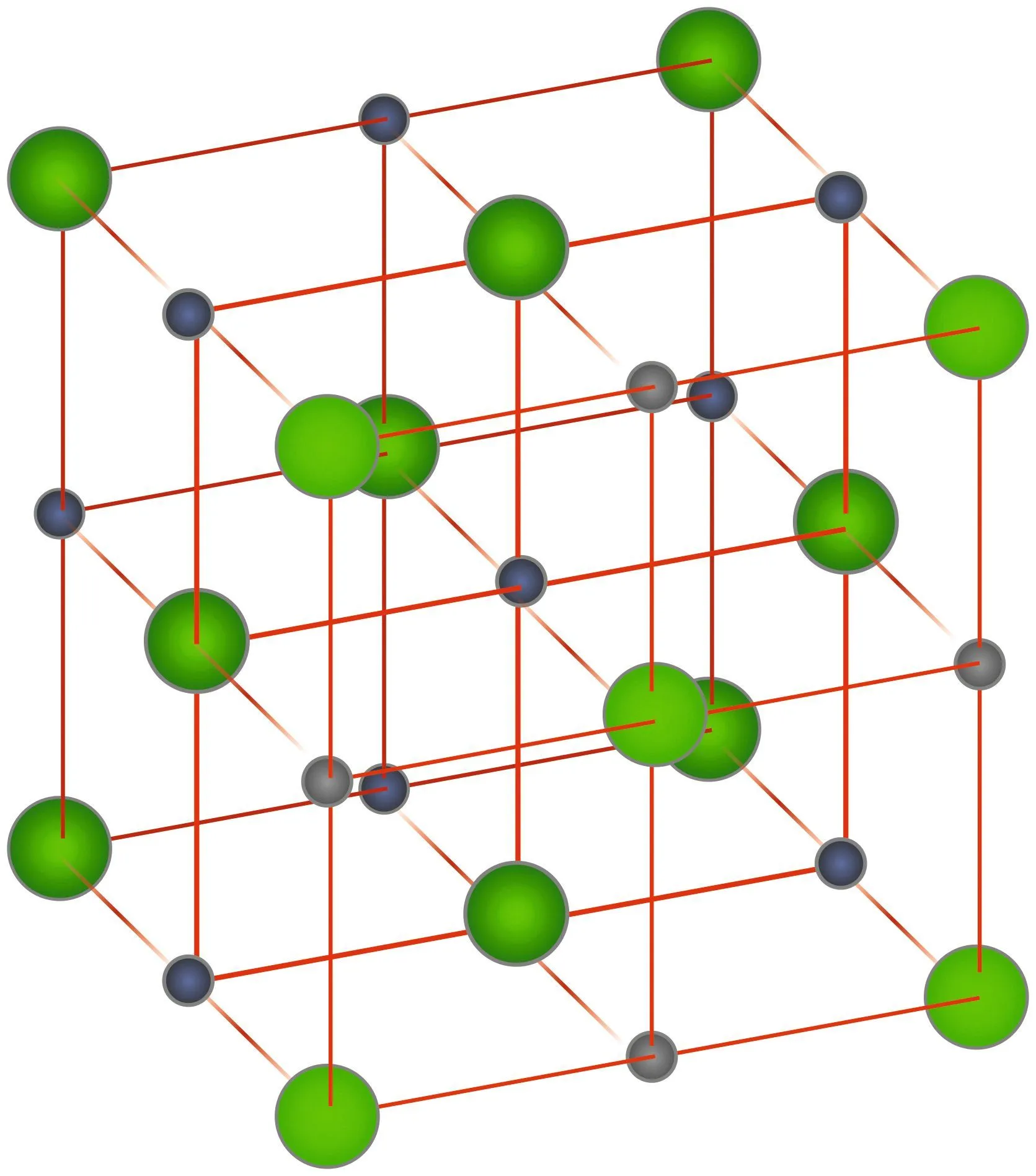
Gris : Na+ ; Vert : Cl-.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Il n'y a pas toujours autant de cations que d'anions
mais il y autant de charges positives que de charges
négatives.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2La quantité de matière
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ADétermination de la masse d'une entité
La masse des molécules est calculée en faisant la somme des
masses des atomes les constituant.
Exemple : la masse d'une molécule d'eau \text{H}_2 \text{O} est égale à la masse de deux atomes d'hydrogène \text{H} plus celle d'un atome d'oxygène \text{O}.
De même pour les ions polyatomiques, leur masse est la somme des masses des atomes les constituant.
Exemple : la masse d'un ion sulfate \mathrm{SO}_{4}^{2-} est égale à la masse d'un atome de soufre \text{S} à laquelle s'ajoute celle de quatre atomes d'oxygène \text{O}. En effet, la masse des électrons est négligeable devant la masse des atomes et elle n'affecte donc pas la masse de l'entité.
Exemple : la masse d'une molécule d'eau \text{H}_2 \text{O} est égale à la masse de deux atomes d'hydrogène \text{H} plus celle d'un atome d'oxygène \text{O}.
De même pour les ions polyatomiques, leur masse est la somme des masses des atomes les constituant.
Exemple : la masse d'un ion sulfate \mathrm{SO}_{4}^{2-} est égale à la masse d'un atome de soufre \text{S} à laquelle s'ajoute celle de quatre atomes d'oxygène \text{O}. En effet, la masse des électrons est négligeable devant la masse des atomes et elle n'affecte donc pas la masse de l'entité.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Bien écrire le nombre d'atomes en indice et les charges en exposant.
Le cœfficient multiplicateur 4 dans \mathrm{SO}_{4}^{2-} ne s'applique qu'à l'atome d'oxygène (\text{O}).
Le cœfficient multiplicateur 4 dans \mathrm{SO}_{4}^{2-} ne s'applique qu'à l'atome d'oxygène (\text{O}).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3 Dune de sable à Abu Dhabi


Quelle unité est adaptée pour compter le nombre de grains de sable constituant une dune ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BNombre d'entités et quantité de matière
La proportionnalité, entre la masse de l'échantillon m_{éch} et le nombre N d'entités chimiques qu'il contient, permet de calculer N à partir de la masse m d'une entité :
1 entité → m ;
N entités → m_{ éch} ;
d'où N = \dfrac{m_{ éch }}{m}.
N étant très élevé (des milliards de milliards !), il est plus simple d'imaginer des boîtes de rangement de ces entités. En chimie, ces boîtes s'appellent des moles. La quantité de matière s'exprime en moles (symbole : mol).
Chaque mole contient un nombre défini d'entités :
N_{A}=6\text{,}022 \times 10^{23} mol-1. Ce nombre s'appelle nombre d'Avogrado.
Comme il y a proportionnalité entre n et N, on a : 1 mol → N_A ;
n mol → N ;
d'où n=\dfrac{N}{N_{\mathrm{A}}}.
N étant très élevé (des milliards de milliards !), il est plus simple d'imaginer des boîtes de rangement de ces entités. En chimie, ces boîtes s'appellent des moles. La quantité de matière s'exprime en moles (symbole : mol).
Chaque mole contient un nombre défini d'entités :
N_{A}=6\text{,}022 \times 10^{23} mol-1. Ce nombre s'appelle nombre d'Avogrado.
Comme il y a proportionnalité entre n et N, on a :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une rédaction appropriée doit éviter d'utiliser laformulation « le nombre de moles est… » ou bien
« la quantité de matière d'ions \text{Zn}^{2+} est de 3,0 mol ».
Il convient d'écrire « la quantité d'ions \text{Zn}^{2+} est de 3,0 mol ».
Il convient d'écrire « la quantité d'ions \text{Zn}^{2+} est de 3,0 mol ».
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Application
Calculer la quantité de matière n correspondante à m_{éch}=10 g de sucre (\text{C}_{12}\text{H}_{22}\text{O}_{11}).
Corrigé
Une molécule de sucre a une masse m égale à :
m =12 m(\mathrm{C})+22 m(\mathrm{H})+11 m(\mathrm{O}) \\ \quad=12 \times 1,99 \times 10^{-26}+22 \times 1,67 \times 10^{-27}+11 \times 2,66 \times 10^{-26} \\ \quad=5,68 \times 10^{-25} \mathrm{~kg} .
Il y a proportionnalité entre m_{éch} et N :
1 molécule → m, d'où N \cdot m=m_{éch} soit N=\dfrac{m_{éch}}{m}
N=\dfrac{0\text{,}010}{5\text{,}68 \times 10^{-25}}=1\text{,}76 \times 10^{22} molécules.
Il y a proportionnalité entre N et n :
N_A molécules → 1 mol d'où N=n \cdot N_{\mathrm{A}} \text { soit } n=\dfrac{N}{N_{\mathrm{A}}}
n=\dfrac{1\text{,}76 \times 10^{22}}{6\text{,}022 \times 10^{23}}=2\text{,}9 \times 10^{-2} mol de molécules.
Remarque : Le résultat a deux chiffres significatifs.
m =12 m(\mathrm{C})+22 m(\mathrm{H})+11 m(\mathrm{O}) \\ \quad=12 \times 1,99 \times 10^{-26}+22 \times 1,67 \times 10^{-27}+11 \times 2,66 \times 10^{-26} \\ \quad=5,68 \times 10^{-25} \mathrm{~kg} .
Il y a proportionnalité entre m_{éch} et N :
1 molécule → m, d'où N \cdot m=m_{éch} soit N=\dfrac{m_{éch}}{m}
N=\dfrac{0\text{,}010}{5\text{,}68 \times 10^{-25}}=1\text{,}76 \times 10^{22} molécules.
Il y a proportionnalité entre N et n :
N_A molécules → 1 mol d'où N=n \cdot N_{\mathrm{A}} \text { soit } n=\dfrac{N}{N_{\mathrm{A}}}
n=\dfrac{1\text{,}76 \times 10^{22}}{6\text{,}022 \times 10^{23}}=2\text{,}9 \times 10^{-2} mol de molécules.
Remarque : Le résultat a deux chiffres significatifs.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Différentes masses d'atomes :
- m(\mathrm{H})=1\text{,}67 \times 10^{-27} kg ;
- m(\mathrm{C})=1\text{,}99 \times 10^{-26} kg ;
- m(\mathrm{O})=2\text{,}66 \times 10^{-26} kg.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Attention à exprimer les masses dans la même unité avant de se lancer dans les calculs.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retrouvez une en anglais sur les méthodes de calcul pour passer de la masse d'un échantillon à la quantité de matière.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

