Chapitre 2
Exercices
Pour aller plus loin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30Mesures de pH
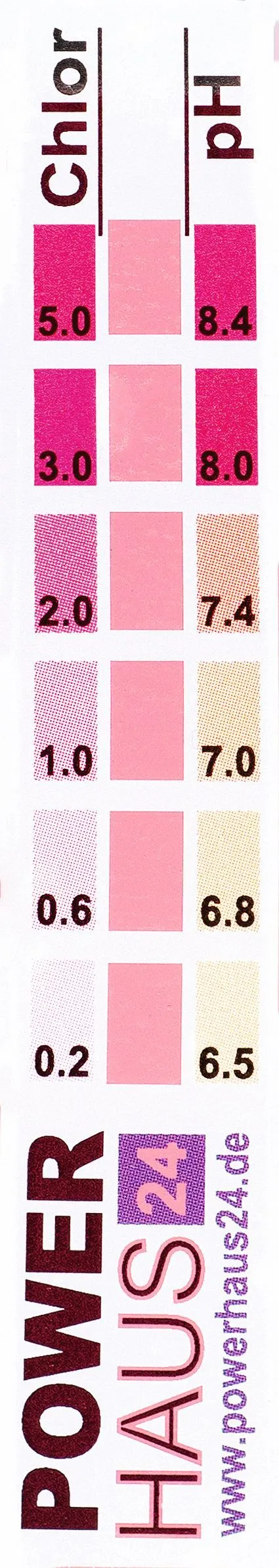
✔ VAL : Précision d'une mesureLe pH indique le niveau de concentration en ions \text{H}_{3}\text{O}^{+}. Il varie de 0 à 14 en solution aqueuse. On peut calculer la valeur de cette concentration notée \gamma (en g/L) en appliquant la formule suivante : \gamma=19 \times 10^{-\mathrm{pH}}. Certains produits permettent de connaître le pH grâce à leur couleur. Il suffit d'en mettre quelques gouttes dans l'eau à tester. Un nuancier permet de relier la couleur de la solution obtenue à la valeur du pH.
1. Donner un encadrement de la valeur du pH de l'eau testée ci-dessus.
2. En déduire un encadrement de la valeur de la concentration en ions \text{H}_{3}\text{O}^{+}. Cette mesure de concentration est-elle précise ?
3. Que fait la concentration en ions oxonium\text{H}_{3}\text{O}^{+} lorsque le pH augmente ? Justifier.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31Magnifique stalagmite
✔ ANA : Faire le lien entre un modèle et la réalité
1. Pourquoi le calcaire se forme-t-il lors du dégazage ?
2. Une stalagmite grandit de seulement 4 cm par siècle. Si son diamètre fait environ 10 cm, combien faut-il de gouttes d'eau pour la faire grandir en un siècle?
3. Combien cela représente-t-il de gouttes en 1 minute ? Est-ce cohérent avec le texte qui parle d'un écoulement lent de l'eau ?
Solubilité du calcaire à 25 °C = 20 mg/L ;
La solubilité du calcaire est supérieure en milieu acide ;
V_{\text {goutte d'eau}} = 0,05 mL ;
\rho_{\text {calcaire}} = 2,77 g/cm3.
1. Pourquoi le calcaire se forme-t-il lors du dégazage ?
2. Une stalagmite grandit de seulement 4 cm par siècle. Si son diamètre fait environ 10 cm, combien faut-il de gouttes d'eau pour la faire grandir en un siècle?
3. Combien cela représente-t-il de gouttes en 1 minute ? Est-ce cohérent avec le texte qui parle d'un écoulement lent de l'eau ?
Données
La solubilité du calcaire est supérieure en milieu acide ;
Formation d'une stalagmite
On appelle stalagmite une concrétion formée à partir des gouttes d'eau tombant sur le sol.


Le terme nous vient du grec stalagmos qui signifie écoulement. Comment se forment les stalagmites ? Lorsque l'eau de pluie traverse lentement le sol, elle se charge en \text{CO}_{2}. Elle devient alors acide et désagrège le calcaire \text{CaCO}_{3}. Lorsqu'elle arrive jusqu'à la voûte d'une grotte, un fin filet d'eau peut s'y s'écouler, toujours très lentement et de manière constante. Les gouttes dégazent alors au contact de l'air. L'eau perd son acidité. Une partie du calcaire va pouvoir se reconstituer, cristalliser ou sédimenter sous la forme d'un anneau de calcite.


Le terme nous vient du grec stalagmos qui signifie écoulement. Comment se forment les stalagmites ? Lorsque l'eau de pluie traverse lentement le sol, elle se charge en \text{CO}_{2}. Elle devient alors acide et désagrège le calcaire \text{CaCO}_{3}. Lorsqu'elle arrive jusqu'à la voûte d'une grotte, un fin filet d'eau peut s'y s'écouler, toujours très lentement et de manière constante. Les gouttes dégazent alors au contact de l'air. L'eau perd son acidité. Une partie du calcaire va pouvoir se reconstituer, cristalliser ou sédimenter sous la forme d'un anneau de calcite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
32Alerte pollution
✔ VAL : Appliquer une relation entre deux grandeurs physiques
✔ COM : Convertir des unités
1. Exprimer cette concentration en ppm. Quelle est l'utilité du ppm ?
2. Quelle quantité minimum de particules fines passerait dans les poumons pendant une balade d'une heure ?
Données
Seuil d'alerte de pollution


La région Ile‑de‑France a été la première à mettre en place (le 25 avril 1994) une procédure d'information et d'alerte du public en cas de dépassement de certains seuils de pollution de l'air. Ces seuils ont été plusieurs fois renforcés. Ils sont mis à jour sur le site d'Airparif. La valeur limite est définie, par polluant, comme le « xniveau maximal de concentration de ce polluant dans l'atmosphère, fixé sur la base des connaissances scientifiques, dans le but d'éviter, de prévenir ou de réduire les effets nocifs de ces substances pour la santé humaine ou pour l'environnement ». [...] Pour les particules fines, le niveau d'information est de recommandations 80 \mug/m3 (en moyenne sur 24 h).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Supplément numérique
Retrouvez plus d'informations sur la qualité de l'air à Paris sur .
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
33Disparition ou pas ?
✔ ANA : Faire le lien entre les grandeurs microscopiques et macroscopiques
Lorsque l'on dissout du sucre dans l'eau, on ne voit plus le sucre dissous. On peut penser que le sucre a disparu. Pourtant, le sucre est bien là, on le sent au goût.
1.
Dans quel état se trouve le sucre dissous ?
2.
À l'aide du modèle microscopique, expliquer pourquoi le sucre n'est plus visible bien que présent.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

