Chapitre 2
Activité 2 - Activité expérimentale
110 min
Le design culinaire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
L'utilisation de colorants alimentaires, tels que les anthocyanes dont le code est E163, est courante dans la pratique du design culinaire et joue un rôle important dans la perception des aliments.
Comment expliquer la couleur d'une solution ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une solution rouge diffuse-t-elle uniquement de la lumière de cette couleur ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 La couleur d'une solution
Une solution colorée absorbe certaines couleurs du spectre visible lorsqu'elle est traversée par une lumière
blanche.
La couleur perçue par l'œil correspond à la synthèse additive des lumières qui ne sont pas absorbées par la solution. La couleur perçue d'une solution est la couleur complémentaire de celle absorbée. Ces couleurs sont diamétralement opposées sur le cercle chromatique.

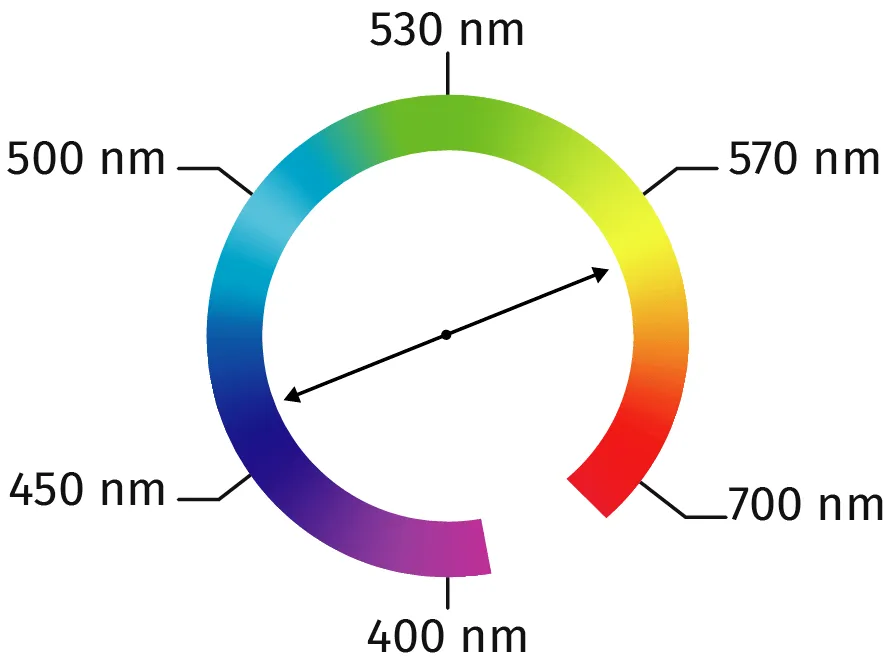
La couleur perçue par l'œil correspond à la synthèse additive des lumières qui ne sont pas absorbées par la solution. La couleur perçue d'une solution est la couleur complémentaire de celle absorbée. Ces couleurs sont diamétralement opposées sur le cercle chromatique.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Les anthocyanes du chou rouge


Les anthocyanes sont des pigments responsables de la coloration de la plupart des fruits et légumes. Ces molécules contiennent des chromophores dont la structure varie en fonction du pH, modifiant ainsi la façon dont elles absorbent la lumière visible.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3 Matériel mis à disposition




Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4 Préparation des solutions
| Tube à essai n° | 1 | 2 | 3 | 4 | 5 |
| Solution de chou rouge (mL) | 3 | 3 | 3 | 3 | 3 |
| Solution aqueuse d'acide chlorhydrique (mL) | 4 | 1 | 0 | 0 | 0 |
| Solution aqueuse d'hydroxyde de sodium (mL) | 0 | 0 | 0 | 1 | 4 |
| Eau distillée (mL) | 3 | 6 | 7 | 6 | 3 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
REA : Effectuer des
mesures
REA : Mettre en œuvre un protocole
REA : Mettre en œuvre un protocole
1. Réaliser les cinq solutions.
2. Choisir deux solutions et réaliser le spectre d'absorption de chacune en relevant l'absorbance pour des longueurs d'onde allant de 400 à 700 nm avec un pas de 30 nm.
3. Pour chaque solution, créer à l'aide du tableur-grapheur (ou de Python), le graphique représentant l'évolution de l'absorbance en fonction de la longueur d'onde \lambda. En déduire la valeur de longueur d'onde \lambda_{\text{max}} pour laquelle l'absorbance est maximale.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
Interpréter la couleur des solutions à partir de leurs spectres d'absorption.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

