Chapitre 4
Problèmes à résoudre
Réactions d'oxydoréduction
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30Éthylotest
✔ RAI/ANA : Construire un raisonnement, communiquer sur les
étapes/Chemin de résolution
Les éthylotests à usage unique sont basés sur une réaction d'oxydoréduction. Ils contiennent du dichromate de potassium \left(2\,\mathrm{K}^{+}(\mathrm{aq})\:;\:\mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}(\mathrm{aq})\right) qui réagit avec l'éthanol \mathrm{C}_{2} \mathrm{H}_{6} \mathrm{O}(\mathrm{aq}) en présence d'acide. On obtient de l'éthanal \mathrm{C}_{2} \mathrm{H}_{4} \mathrm{O}(\mathrm{aq}) et des ions chrome (III) : \mathrm{Cr}^{3+}(\mathrm{aq}).
Le ballon que l'on doit gonfler a un volume de 1 L. Le test est positif si le changement de couleur est observé sur la moitié du tube ou plus.
À l'aide des documents, déterminer la masse de dichromate de potassium minimale pour détecter une alcoolémie trop importante pour un permis probatoire français.
Doc. 1
Définition de l'alcoolémie
L'alcoolémie est la concentration d'éthanol dans le sang, elle s'exprime en \dfrac{g_{\text {\,éthanol }}}{L_{\text {sang }}}.
Son estimation à partir d'une mesure sur l'air expiré est fondée sur la loi de Henry selon laquelle la pression partielle P_{i} d'une substance volatile, qui traduit sa concentration dans l'air au-dessus d'un liquide, est proportionnelle à sa fraction molaire x_i dans le liquide qui la contient : P_{i} = x_{i}\:· H_{i}, où H_{i} est la constante de Henry qui est spécifique de la substance considérée.
Ainsi, l'alcoolémie est exactement proportionnelle à la concentration d'éthanol dans l'air expiré.
Son estimation à partir d'une mesure sur l'air expiré est fondée sur la loi de Henry selon laquelle la pression partielle P_{i} d'une substance volatile, qui traduit sa concentration dans l'air au-dessus d'un liquide, est proportionnelle à sa fraction molaire x_i dans le liquide qui la contient : P_{i} = x_{i}\:· H_{i}, où H_{i} est la constante de Henry qui est spécifique de la substance considérée.
Ainsi, l'alcoolémie est exactement proportionnelle à la concentration d'éthanol dans l'air expiré.
Doc. 2
L'alcool expiréOn sait que la masse d'éthanol contenue dans un litre de sang est deux mille fois supérieure à celle contenue dans un litre d'air expiré.
Doc. 3
Le couple redox en jeu




Dichromate de potassium \mathrm{K}_{2} \mathrm{Cr}_{2} \mathrm{O}_{7}(\mathrm{s}) /Oxyde de chrome (III) \mathrm{Cr}_{2} \mathrm{O}_{3}(\mathrm{s}).
Doc. 4
Éthylotest à usage unique

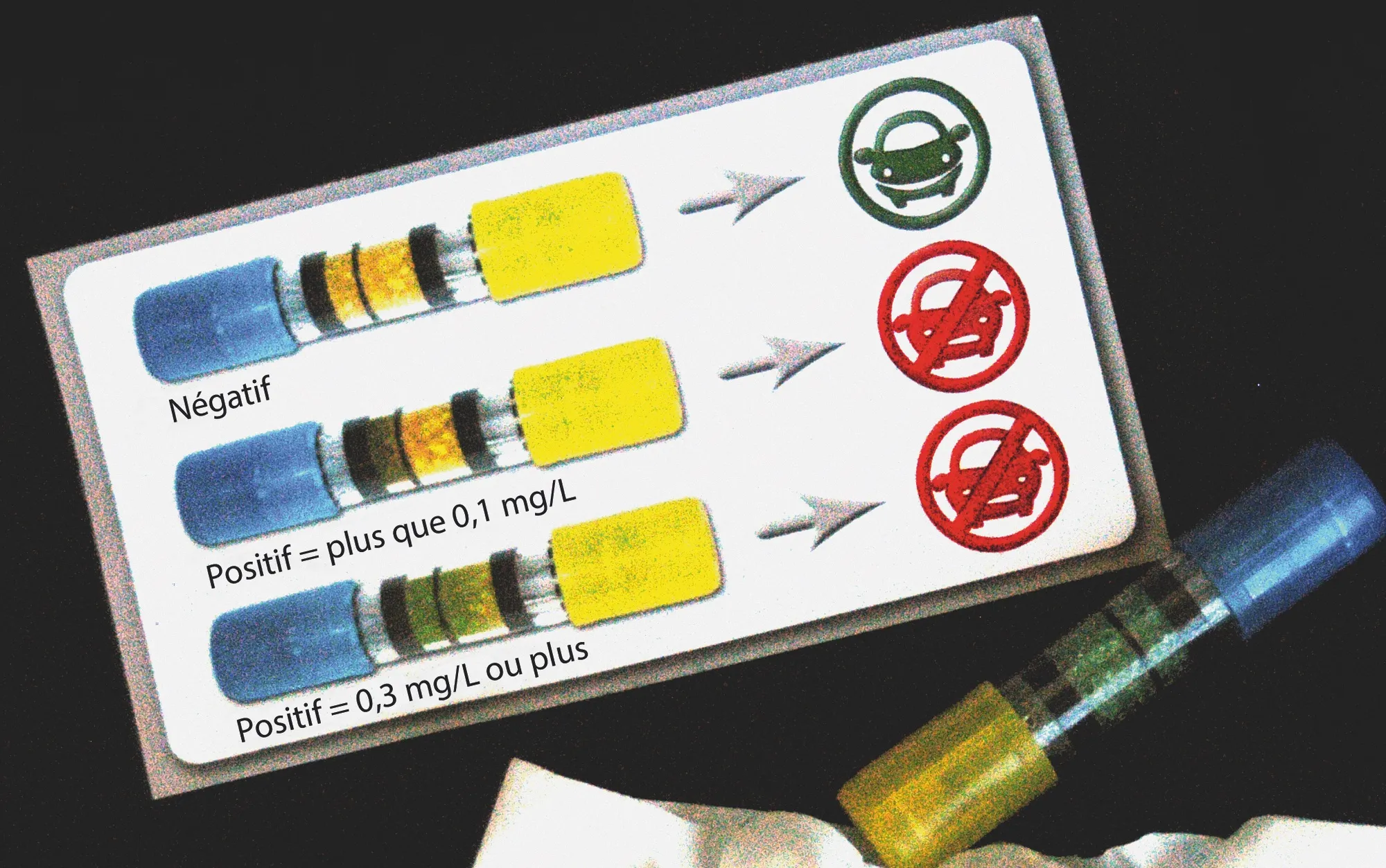
Doc. 5
Le taux d'alcool autoriséDésormais, le taux d'alcool autorisé est 0,2 g·L-1 dans le sang pour tous les permis probatoires. La réglementation s'applique à tous les jeunes conducteurs pendant :
- 3 ans après l'obtention du permis, la perte de 12 points ou l'annulation de son permis ;
- 2 ans si le permis a été obtenu dans le cadre de la conduite accompagnée ;
- 0,2 g·L-1, c'est zéro verre d'alcool car dès le 1er verre, ce seuil peut être dépassé.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retour sur l'ouverture du chapitre (déconstruire les idées fausses)
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31Les acides attaquent-ils tous les métaux ?
✔ APP : Formuler le résultat attendu (hypothèse, etc.)
L'acide chlorhydrique \left(\mathrm{H}^{+}(\mathrm{aq})\:;\:\mathrm{Cl}^{-}(\mathrm{aq})\right) attaque le fer \mathrm{Fe}(\mathrm{s}) et l'aluminium \mathrm{Al}(\mathrm{s}) pour donner des solutions de chlorure de fer (II) \left(\mathrm{Fe}^{2+}(\mathrm{aq})\:;\:2\:\mathrm{Cl}^{-}(\mathrm{aq})\right) et de chlorure
d'aluminium \left(\mathrm{Al}^{3+}(\mathrm{aq})\:;\: 3\: \mathrm{Cl}^{-}(\mathrm{aq})\right), accompagnées dans les deux cas d'un dégagement de dihydrogène.
1. Écrire les demi-équations électroniques des
couples \mathrm{Al}^{3+}(\mathrm{aq}) / \mathrm{Al}(\mathrm{s}), \mathrm{Fe}^{2+}(\mathrm{aq}) / \mathrm{Fe}(\mathrm{s}), \mathrm{H}^{+}(\mathrm{aq}) / \mathrm{H}_{2}(\mathrm{g}).
2. Écrire les équations bilans de la réaction entre ces deux métaux et l'acide chlorhydrique.
Le cuivre \mathrm{Cu}(\mathrm{s}), plongé dans une solution d'acide chlorhydrique, reste intact. Mais, avec l'acide nitrique \left(\mathrm{H}^{+}(\mathrm{aq})\:;\: \mathrm{NO}_{3}^{-}(\mathrm{aq})\right), le cuivre disparaît, la solution devient bleue et un dégagement de monoxyde d'azote \mathrm{NO}(\mathrm{g}) apparaît.
2. Écrire les équations bilans de la réaction entre ces deux métaux et l'acide chlorhydrique.
Le cuivre \mathrm{Cu}(\mathrm{s}), plongé dans une solution d'acide chlorhydrique, reste intact. Mais, avec l'acide nitrique \left(\mathrm{H}^{+}(\mathrm{aq})\:;\: \mathrm{NO}_{3}^{-}(\mathrm{aq})\right), le cuivre disparaît, la solution devient bleue et un dégagement de monoxyde d'azote \mathrm{NO}(\mathrm{g}) apparaît.
3. Écrire les demi-équations des couples \mathrm{Cu}^{2+}(\mathrm{aq}) /\mathrm{Cu}(\mathrm{s}) et \mathrm{NO}_{3}^{-}(\mathrm{aq}) / \mathrm{NO}(\mathrm{g}).
4. Écrire l'équation bilan de la transformation chimique entre le cuivre et l'acide nitrique.
4. Écrire l'équation bilan de la transformation chimique entre le cuivre et l'acide nitrique.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

