Travailler autrement
Histoire des sciences
Une brève histoire des piles
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
A Élaboration des premières piles
Alessandro Volta (1745-1827) met au point la première pile, constituée d'un empilement de zinc, de cuivre et de carton imbibé d'eau salée. Mais la pile Volta présente deux inconvénients : d'une part, elle produit du dihydrogène, dont l'accumulation fait chuter la tension de la pile et d'autre part, la pile n'est pas étanche car le liquide imbibé dans le carton a tendance à couler.
Volta


\mathrm{Zn} \rightarrow \mathrm{Zn}^{2+}+2\,\mathrm{e}^{-}
2\,\mathrm{H}^{+}+2\,\mathrm{e}^{-} \rightarrow \mathrm{H}_{2}
2\,\mathrm{H}^{+}+2\,\mathrm{e}^{-} \rightarrow \mathrm{H}_{2}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B Améliorations de Daniell et Leclanché
Le développement du télégraphe nécessitant des sources de courant constantes, John Daniell (1790-1845) améliore la pile de Volta. Sa pile est constituée d'une électrode en cuivre plongeant dans une solution contenant des ions \text{Cu}^{2+} et d'une électrode en zinc plongeant dans une solution contenant des ions \text{Zn}^{2+}. Les deux solutions sont séparées par une paroi poreuse, permettant le déplacement des
ions. Du dihydrogène parasite se forme, mais cette pile nécessite cependant moins d'entretien que la pile Volta et délivre une tension plus élevée, qui chute moins rapidement.

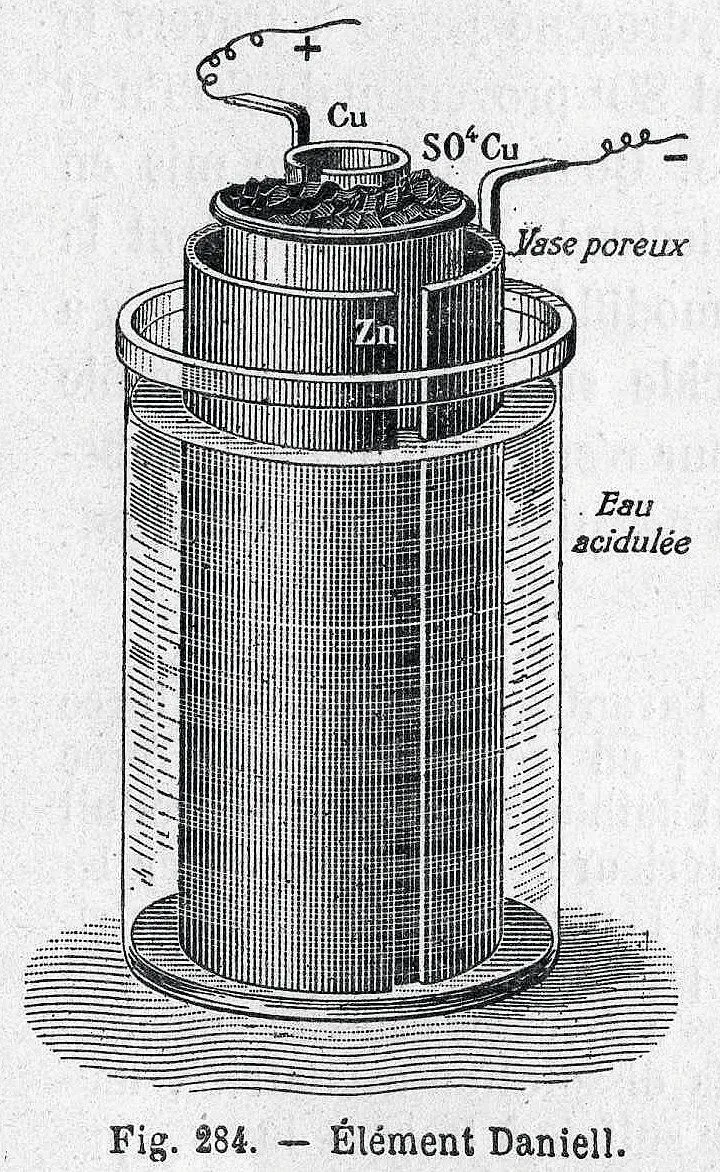
Daniell


\mathrm{Zn} \longrightarrow \mathrm{Zn}^{2+}+2\,\mathrm{e}^{-}
\mathrm{Cu}^{2+}+2\,\mathrm{e}^{-} \rightarrow \mathrm{Cu}
\mathrm{Cu}^{2+}+2\,\mathrm{e}^{-} \rightarrow \mathrm{Cu}
Georges Leclanché (1839-1882) présente à l'Exposition universelle de 1868 une pile zinc-manganèse, rapidement améliorée pour donner la pile saline dont la conception domine le marché durant plus d'un siècle. Elle se présente comme une pile moderne : un cylindre renfermant les réactifs (zinc, dioxyde de manganèse, électrolyte). On observe encore la formation parasite de dihydrogène gazeux, dont l'accumulation risque de faire exploser le cylindre en plus de gêner les réactions. Toute l'astuce de Leclanché réside dans l'emploi du dioxyde de manganèse, qui oxyde \text{H}_{2} en \text{H}^{+} et évite ainsi ces inconvénients. Leclanché parvient de plus à gélifier l'électrolyte, ce qui rend sa pile considérablement plus pratique que les piles type Daniell contenant un électrolyte liquide.

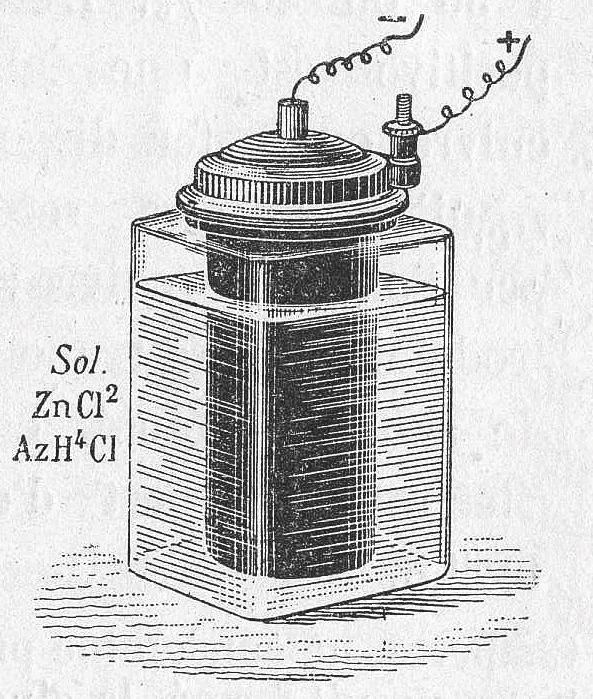
Leclanché


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
C Vers les piles alcalines modernes
Pile alcaline


Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

