Chapitre 6
Exercices
Pour s'entraîner
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22 L'eau de Javel
✔ RAI/MOD : Respecter les conventions en chimiePetite histoire de l'eau de Javel
Claude Louis Berthollet (1748-1822), en étudiant les propriétés décolorantes du chlore, découvre un procédé de blanchiment des toiles utilisant une solution de chlorure et d'hypochlorite de potassium : il vient
d'inventer la lessive de Berthollet, bientôt nommée eau de Javel suite à la localisation de son premier site de production : la manufacture de produits chimiques construite en 1777 dans le village de Javel, à l'ouest de Paris, qui donnera son nom au produit.
En 1820, le pharmacien Antoine Germain Labarraque étudie les qualités désinfectantes des dérivés chlorés et des hypochlorites de potassium et de sodium. Il met au point une solution de chlorure et d'hypochlorite de sodium qu'il appelle liqueur de Labarraque. En 1900, on appelait eau de Javel l'hypochlorite de potassium et eau de Labarraque l'hypochlorite de sodium. Plus tard, le procédé de fabrication a remplacé le potassium par le sodium, sans changement de nom.
À partir du XIXe siècle, l'eau de Javel est couramment utilisée comme désinfectant et pour le traitement de l'eau potable. L'eau de Javel est synthétisée directement par la réaction :
En 1820, le pharmacien Antoine Germain Labarraque étudie les qualités désinfectantes des dérivés chlorés et des hypochlorites de potassium et de sodium. Il met au point une solution de chlorure et d'hypochlorite de sodium qu'il appelle liqueur de Labarraque. En 1900, on appelait eau de Javel l'hypochlorite de potassium et eau de Labarraque l'hypochlorite de sodium. Plus tard, le procédé de fabrication a remplacé le potassium par le sodium, sans changement de nom.
À partir du XIXe siècle, l'eau de Javel est couramment utilisée comme désinfectant et pour le traitement de l'eau potable. L'eau de Javel est synthétisée directement par la réaction :
\mathrm{Cl}_{2}+2 \mathrm{HO}^{-} \rightarrow \mathrm{ClO}^{-}+\mathrm{Cl}^{-}+\mathrm{H}_{2} \mathrm{O}.


1.
Établir la structure de Lewis de la molécule de dichlore.
Cliquez pour accéder à une zone de dessin
2.
Établir la structure de Lewis des ions chlorure, hypochlorite et hydroxyde.
Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23Géométrie et polarité en QCM
✔ APP : Maîtriser le vocabulaire du cours1. La géométrie coudée de la molécule d'eau est :
2. L'heptane, de formule chimique \mathrm{C}_{7}\mathrm{H}_{16}, est une molécule :
3. La molécule de dioxyde de carbone \mathrm{CO}_{2} possède deux liaisons \mathrm{C}=0 polarisées. Cette molécule est donc :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24 Les réactifs de Grignard
✔ RAI/ANA : Utiliser des observations
Le bromure d'éthylmagnésium est un réactif de Grignard dont la formule est la suivante :
Des réactifs stratégiques
Victor Grignard (1871-1935) est un chimiste français, lauréat du prix Nobel de chimie en 1912 pour sa
découverte du réactif qui porte son nom et qui a récemment permis de grandes avancées en chimie organique.
Ses recherches ont porté sur le développement d'une nouvelle méthode de synthèse pour allonger les chaînes carbonées des molécules organiques en utilisant un dérivé contenant du magnésium. La particularité des réactifs de Grignard tient au fait que la polarité de la liaison \mathrm{C}-\mathrm{Mg} est inversée par rapport à celle des liaisons \mathrm{C}-~\mathrm{N} ou \mathrm{C}-\mathrm{O} habituellement rencontrée en chimie organique.
Ses recherches ont porté sur le développement d'une nouvelle méthode de synthèse pour allonger les chaînes carbonées des molécules organiques en utilisant un dérivé contenant du magnésium. La particularité des réactifs de Grignard tient au fait que la polarité de la liaison \mathrm{C}-\mathrm{Mg} est inversée par rapport à celle des liaisons \mathrm{C}-~\mathrm{N} ou \mathrm{C}-\mathrm{O} habituellement rencontrée en chimie organique.

Données
-
Électronégativité \chi des atomes :
\chi(\mathrm{O}) =3\text{,}44 ;
\chi(\mathrm{Mg}) =1\text{,}31 ;
\chi(\mathrm{C}) =2\text{,}55 ;
\chi(\mathrm{N}) =3\text{,}04.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25Comprendre les attendus
Formaldéhyde
✔ RAI/MOD : Respecter les conventions en chimie
Le méthanal est un aldéhyde de formule brute : \mathrm{CH}_{2} \mathrm{O}. En solution aqueuse, il est appelé formol et sert en médecine comme conservateur de certains échantillons biologiques.
Son modèle moléculaire est le suivant :
Son modèle moléculaire est le suivant :

1.
Établir sa représentation de Lewis.
2. Préciser la géométrie adoptée par les atomes autour de l'atome de carbone.
3. Quelle liaison covalente est polarisée au sein de cette molécule ? Justifier.
Cliquez pour accéder à une zone de dessin
2. Préciser la géométrie adoptée par les atomes autour de l'atome de carbone.
3. Quelle liaison covalente est polarisée au sein de cette molécule ? Justifier.
Détails du barème
TOTAL /4,5 pts
1 pt
1.
Proposer une structure de Lewis cohérente avec le modèle moléculaire.1 pt
1.
Respecter des règles du duet et de l'octet pour l'ensemble des atomes de la molécule.0,5 pt
2.
Prévoir la géométrie autour de l'atome de carbone.1 pt
2.
Expliciter la répulsion des doublets pour justifier la géométrie adoptée.1 pt
3.
À partir des électronégativités des atomes, identifier la liaison polarisée.Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26Dérivés chlorés et polarité
✔ RAI/ANA : Utiliser des documents pour répondre à la
problématiqueÀ l'aide des données suivantes, indiquer l'évolution de la polarité au sein des molécules de chlorométhane, de dichlorométhane et de chloroforme.
| Chlorométhane | Dichlorométhane | Chloroforme |
|---|---|---|
| \mathrm{CH}_{3} \mathrm{Cl} |
 |
 |
Donnée
- Numéros atomiques des atomes :
\mathrm{C} (Z=6) ;
\mathrm{Cl} (Z=17). -
Électronégativité \chi des atomes :
\chi(\mathrm{C}) =2\text{,}55 ;
\chi(\mathrm{Cl}) =3\text{,}16.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27La dopamine, entre prise de risque et bien-être
✔ RAI/MOD : Respecter les conventions en chimieDoc. 1
Formule semi-développée de la dopamine

Doc. 2
La dopamine
Synthétisée dès 1910, par Georges Barger et James Ewens, la dopamine est une neurohormone produite par l'hypothalamus. Sa principale fonction est d'inhiber la libération de prolactine, protéine qui intervient dans la sensation de bien-être. Le plaisir ressenti lors d'un repas est dû à la sécrétion de dopamine, ce que la pratique régulière d'un sport permet aussi d'augmenter.
1.
Établir la représentation de Lewis de la dopamine.
2. Préciser la géométrie adoptée par l'atome d'azote au sein de cette molécule.
3. À l'aide de boîtes de modèles moléculaires, construire cette molécule et préciser la géométrie observée pour les atomes du cycle benzénique.
4. Parmi les liaisons chimiques de cette molécule, préciser celles qui sont polarisées.
Cliquez pour accéder à une zone de dessin
2. Préciser la géométrie adoptée par l'atome d'azote au sein de cette molécule.
3. À l'aide de boîtes de modèles moléculaires, construire cette molécule et préciser la géométrie observée pour les atomes du cycle benzénique.
4. Parmi les liaisons chimiques de cette molécule, préciser celles qui sont polarisées.
Données
- Numéros atomiques des atomes :
\mathrm{H} (Z=1) ;
\mathrm{C} (Z=6) ;
\mathrm{N} (Z=7) ;
\mathrm{O} (Z=8). -
Électronégativité \chi des atomes :
\chi(\mathrm{O}) =3\text{,}44 ;
\chi(\mathrm{N}) =3\text{,}04 ;
\chi(\mathrm{C}) =2\text{,}55 ;
\chi(\mathrm{H}) =2\text{,}20.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
28Copie d'élève à commenter
Proposer une justification pour chaque erreur relevée par le correcteur.
1.
La configuration de l'atome de soufre S est : 1s22s22p63s23p4. Il possède donc 6 électrons de valence.
2. On compare souvent le soufre à l'oxygène car ilsont les mêmes propriétés chimiques.
3. La formule de Lewis du sulfure de dihydrogène est :\color{red}\xcancel{\color{black}{H=S-H}}. Il fait partie de ces molécules qui ne respectent pas la règle de l'octet car c'est un acide de Lewis.
4.La géométrie du sulfure de dihydrogène : elle est linéaire.
2. On compare souvent le soufre à l'oxygène car ils
3. La formule de Lewis du sulfure de dihydrogène est :
4.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
29
La soupe primordiale
✔ RAI/MOD : Respecter les conventions en chimieL'expérience de Miller
Miller souhaitait comprendre si les conditions physicochimiques de la Terre primordiale ont permis l'apparition de la vie. Dans un système de tubes clos et stériles, il place de l'eau liquide, du méthane \mathrm{CH}_{4}, de l'ammoniac \mathrm{NH}_{3} et du dihydrogène \mathrm{H}_{2}. Ce mélange est parcouru d'arcs électriques, reproduisant les conditions d'orage supposées courantes à l'époque. Après quelques jours d'expérience, Miller a pu observer la formation de molécules organiques dans le milieu, dont plusieurs acides aminés et l'urée \mathrm{H}_{2} \mathrm{N}-\mathrm{CO}-\mathrm{NH}_{2}.

1. Établir les structures de Lewis des molécules d'ammoniac et d'urée.
Cliquez pour accéder à une zone de dessin
2. Quelle est la géométrie adoptée par l'atome de carbone dans l'urée ? Construire le modèle moléculaire de l'urée à l'aide d' et valider la géométrie proposée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30 L'alanine, un acide \alpha-aminé
✔ APP : Maîtriser le vocabulaire du cours
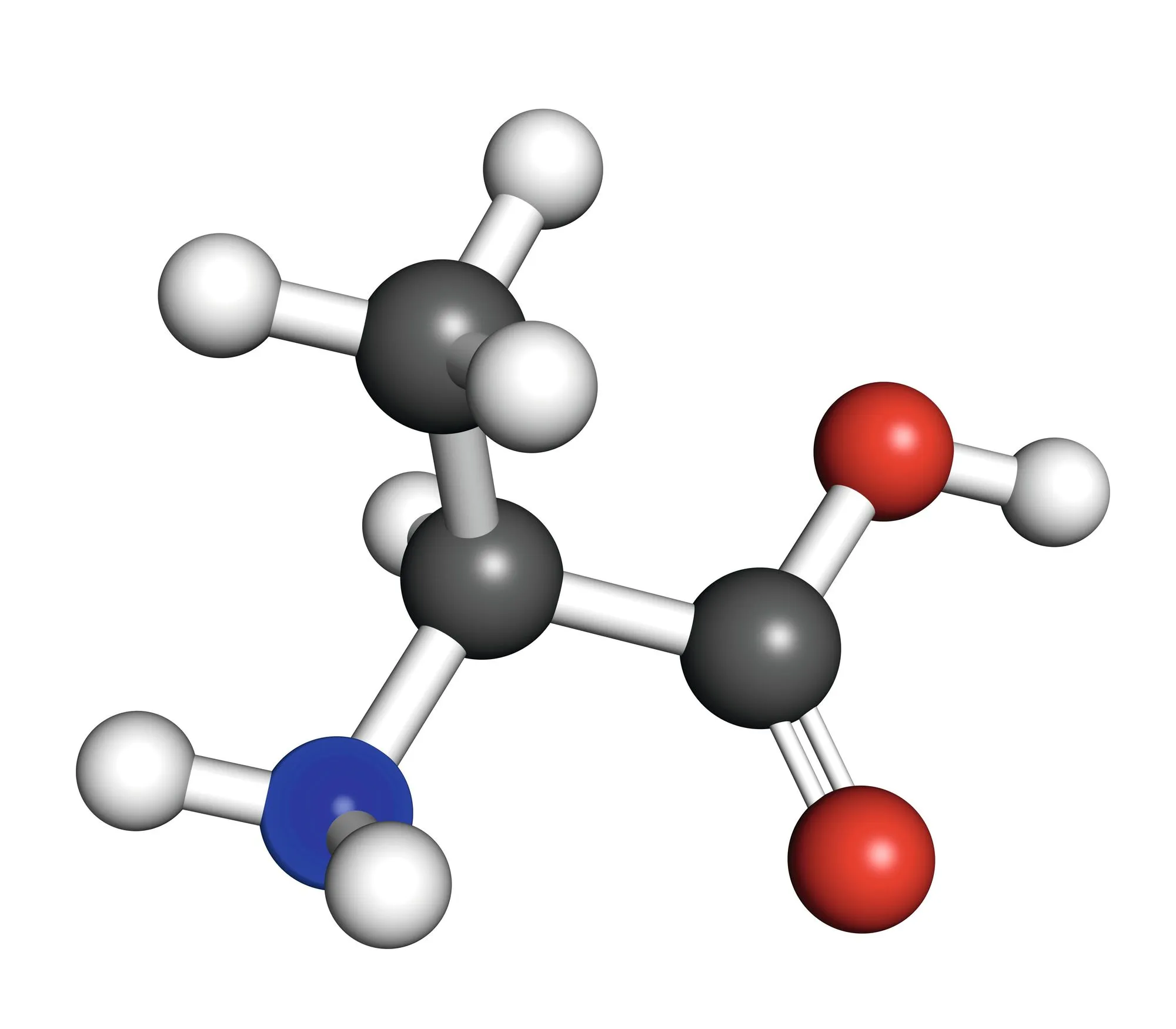
L'alanine est l'un des acides \alpha-aminés les plus présents dans les protéines. Les acides aminés possèdent une fonction amine -\mathrm{NH}_{2} et une fonction acide carboxylique -\mathrm{COOH}.
Cliquez pour accéder à une zone de dessin
2. Rappeler les hypothèses qui permettent de déterminer la géométrie d'une molécule à partir de sa formule de Lewis.
3. Préciser la géométrie observée autour de l'atome de carbone de la fonction acide carboxylique.
4. Préciser la géométrie observée autour de l'atome d'azote de la fonction amine.
5. Préciser les charges partielles présentes sur cette molécule.
Données
- Numéros atomiques des atomes :
\mathrm{H} (Z=1) ;
\mathrm{C} (Z=6) ;
\mathrm{N} (Z=7) ;
\mathrm{O} (Z=8). -
Électronégativité \chi des atomes :
\chi(\mathrm{O}) =3\text{,}44 ;
\chi(\mathrm{N}) =3\text{,}04 ;
\chi(\mathrm{C}) =2\text{,}55 ;
\chi(\mathrm{H}) =2\text{,}20.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31 Le tétrachlorure de carbone
✔ RAI/ANA : Construire un raisonnement 

Notice d'extincteur au \mathrm{CCl}_{4}.
Le tétrachlorure de carbone, de formule brute \mathrm{CCl}_{4}, est une molécule
organique de forte toxicité, autrefois utilisée dans les aérosols. En raison de son action destructrice sur la
couche d'ozone, cette molécule a été interdite au niveau mondial par le protocole de Montréal en 1985.
Cliquez pour accéder à une zone de dessin
2. En déduire sa géométrie.
3. Les liaisons \mathrm{C}-\mathrm{Cl} sont-elles polarisées ? Justifier.
4. La molécule de tétrachlorure de carbone est-elle polaire ? Justifier.
Données
- Numéros atomiques des atomes :
\mathrm{C} (Z=6) ;
\mathrm{Cl} (Z=17). -
Électronégativité \chi des atomes :
\chi(\mathrm{C}) =2\text{,}55 ;
\chi(\mathrm{Cl}) =3\text{,}16.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
32 L'éthanol, un solvant polaire
✔ RAI/ANA : Faire le lien entre un modèle microscopique et des
propriétés macroscopiquesDoc. 1
Extrait de l'étiquette d'une bouteille d'éthanol

Doc. 2
L'éthanol, un solvant polaire
À cause de la nature polaire du groupement hydroxyle, l'éthanol dissout facilement les composés ioniques, comme l'hydroxyde de sodium ou le chlorure de sodium. La partie apolaire de l'éthanol lui permet de dissoudre des substances hydrophobes et notamment des huiles essentielles.
1.
À l'aide des documents ci-dessous, justifier la polarité de l'éthanol.
2. Quelles propriétés macroscopiques s'expliquent par la polarité de la molécule d'éthanol.
2. Quelles propriétés macroscopiques s'expliquent par la polarité de la molécule d'éthanol.
Données
- Numéros atomiques des atomes :
\mathrm{H} (Z=1) ;
\mathrm{C} (Z=6) ;
\mathrm{O} (Z=8). -
Électronégativité \chi des atomes :
\chi(\mathrm{O}) =3\text{,}44 ;
\chi(\mathrm{C}) =2\text{,}55 ;
\chi(\mathrm{H}) =2\text{,}20.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
33 Autoprotolyse de l'eau
✔ RAI/MOD : Respecter les conventions en chimieL'autoprotolyse de l'eau est une réaction chimique au cours de laquelle deux molécules d'eau échangent un proton :
2\,\mathrm{H}_{2} \mathrm{O}(\mathrm{l}) \rightleftarrows \mathrm{H}_{3} \mathrm{O}^{+}(\mathrm{aq})+\mathrm{HO}^{-}(\mathrm{aq}).
C'est cette réaction chimique au sein de l'eau pure qui explique la légère conductivité de la solution.
1.
Établir la représentation de Lewis de la molécule d'eau et en déduire la géométrie de cette molécule.
Cliquez pour accéder à une zone de dessin
2.
Une molécule d'eau perd un proton \mathrm{H}^{+} pour donner l'ion hydroxyde \mathrm{HO}^{-}. Proposer la formule de Lewis de ces deux ions.
Cliquez pour accéder à une zone de dessin
3.
Une molécule d'eau gagne un proton \mathrm{H}^{+} pour donner l'ion oxonium \mathrm{H}_{3} \mathrm{O}^{+}. Proposer la formule de Lewis de ces deux ions.
Cliquez pour accéder à une zone de dessin
Données
- Numéros atomiques des atomes :
\mathrm{H} (Z=1) ;
\mathrm{C} (Z=6) ;
\mathrm{O} (Z=8).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AAcide formique
✔ RAI/MOD : Respecter les conventions en chimie
L'acide méthanoïque (également appelé acide formique) est un acide sécrété notamment par les abeilles et les fourmis. Sa formule est \text{HCO}_2\text{H}.
L'acide méthanoïque (également appelé acide formique) est un acide sécrété notamment par les abeilles et les fourmis. Sa formule est \text{HCO}_2\text{H}.
1. Écrire la représentation de Lewis de l'acide formique et faire apparaître les charges partielles.
Cliquez pour accéder à une zone de dessin
2. Préciser la géométrie autour de l'atome de carbone.
3. Quelles liaisons sont polarisées ?
4. Cette molécule est-elle polaire ?
5. Cette molécule est un acide, c'est-à-dire qu'une liaison avec un hydrogène peut être facilement brisée. Duquel des deux atomes d'hydrogène s'agit-il ?
3. Quelles liaisons sont polarisées ?
4. Cette molécule est-elle polaire ?
5. Cette molécule est un acide, c'est-à-dire qu'une liaison avec un hydrogène peut être facilement brisée. Duquel des deux atomes d'hydrogène s'agit-il ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BPeroxyde d'hydrogène
✔ RAI/MOD : Respecter les conventions en chimie
Le peroxyde d'hydrogène, plus connu sous le nom d'eau oxygénée, est utilisé comme désinfectant. Sa formule brute est : \text{H}_2\text{O}_2.
Le peroxyde d'hydrogène, plus connu sous le nom d'eau oxygénée, est utilisé comme désinfectant. Sa formule brute est : \text{H}_2\text{O}_2.
1. Écrire la représentation de Lewis de l'eau oxygénée et faire apparaître les charges partielles.
Cliquez pour accéder à une zone de dessin
2.
Préciser la géométrie autour des atomes d'oxygène.
3. Quelles liaisons sont polarisées ?
4. Cette molécule est-elle polaire ?
3. Quelles liaisons sont polarisées ?
4. Cette molécule est-elle polaire ?
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

