Chapitre 9
Activité 1 - Activité d'exploration
Quelles écritures pour représenter une molécule ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
Axel lit dans une revue scientifique que l'éthanol a pour formule brute \text{C}_2\text{H}_6\text{O}. Cependant, il remarque qu'une molécule composée exactement des mêmes atomes (\text{C}_2\text{H}_6\text{O}) est appelée méthoxyméthane.
Ces deux molécules qui ont la même formule brute sont-elles identiques ? Sinon, comment représenter leurs différences ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
En quoi deux molécules composées des mêmes atomes pourraient-elles être différentes ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 La liaison covalente
Dans une molécule, les atomes mettent en commun des électrons externes et créent ainsi des liaisons, appelées liaisons covalentes, pour gagner en stabilité. En effet, cette mise en commun permet aux atomes de compléter leurs couches électroniques externes, et d'adopter ainsi la structure électronique du gaz noble le plus proche dans la classification périodique. Les règles de l'octet et du duet vues en seconde sont ainsi respectées. Une liaison covalente correspond à cette liaison entre atomes dans la molécule.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Formules brutes et semi-développées

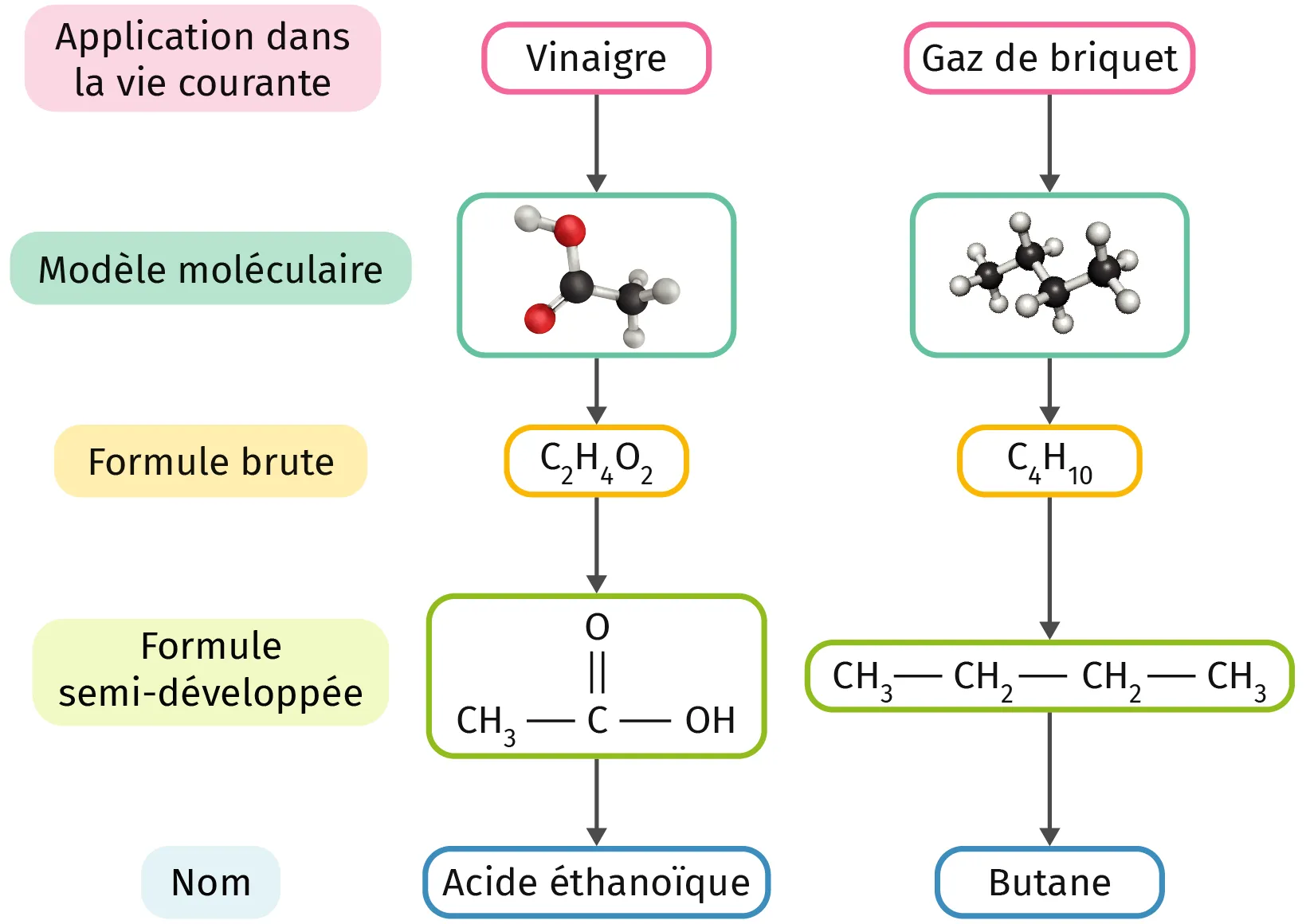
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour comprendre la différence entre l'éthanol et le dimétil-éther, visionnez cette .
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3 Des molécules incomplètes

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence
RAI/MOD : Respecter les conventions en chimie
1. Doc. 1 et 2 À l'aide de leur numéro atomique (donné dans le tableau périodique en rabat de fin de manuel), déterminer le nombre de liaisons formées par les atomes d'hydrogène, de carbone et d'oxygène. Justifier.
2. Doc. 3 Recopier et compléter les formules semi-développées avec les hydrogènes manquants, puis donner la formule brute de chacune des molécules.
Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
Représenter deux formules semi-développées possibles pour la formule brute \text{C}_2\text{H}_6\text{O}.
Cliquez pour accéder à une zone de dessin
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

