Chapitre 10
Exercices
Pour s'échauffer - Pour commencer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour s'échauffer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
4Transformation d'énergie
On brûle 1 L de pétrole.Donner le nom de la transformation chimique qui a lieu et citer les formes d'énergie initiales et finales.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5Équation d'une combustion
L'équation de combustion complète du pentane s'écrit :
\mathrm{C}_{5} \mathrm{H}_{12}(\mathrm{g})+8\, \mathrm{O}_{2}(\mathrm{g}) \rightarrow 5\, \mathrm{CO}_{2}(\mathrm{g})+6\, \mathrm{H}_{2} \mathrm{O}(\mathrm{g})
Calculer la quantité de matière de \text{CO}_{2} produite lors de la combustion d'une mole de pentane.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6Énergie de dissociation
Calculer l'énergie de dissociation du méthane \text{CH}_{4}.Données
- E_{\text{l}}(\text{C}-\text{C})=346 kJ·mol-1 ;
- E_{\text{l}}(\text{C}-\text{O})=358 kJ·mol-1 ;
- E_{\text{l}}(\text{C}-\text{H})=411 kJ·mol-1 ;
- E_{\text{l}}(\text{O}-\text{H})=459 kJ·mol-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7Énergie de dissociation
1. Donner les différents types de liaisons contenues dans le propan-1-ol \mathrm{C}_{3} \mathrm{H}_{8} \mathrm{O}.2. Calculer l'énergie de dissociation du propan-1-ol.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8Énergie libérée
On brûle une bougie contenant 20 g d'acide stéarique.




1. Calculer la quantité de matière contenue dans cette bougie.
2. Calculer l'énergie libérée par la combustion de cette bougie.
2. Calculer l'énergie libérée par la combustion de cette bougie.
Données
- Acide stéarique : M(\text{C}_{18} \text{H}_{36} \text{O}_{2})=284\text{,}5 g·mol-1 ;
- Énergie de réaction molaire : E_{\text{r}}(\text{C}_{18} \text{H}_{36} \text{O}_{2})=-10\,818 kJ·mol-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9Pouvoir calorifique
La combustion de 2\text{,}5 kg de bois de chêne libère 29\, 600 kJ.Calculer le pouvoir calorifique du chêne.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10Pouvoir calorifique
Calculer l'énergie libérée par la combustion de 5\text{,}00 kg d'octane.Données
- Le pouvoir calorifique de l'octane est de 48\text{,}1 MJ·kg-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour commencer
La réaction de combustion
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11Combustions complètes
✔ RAI/MOD : Ajuster une transformation chimiqueAjuster les équations de combustions complètes suivantes.
a. \mathrm{CH}_{4}(\mathrm{g})\,+
b. \text{C}_{3} \text{H}_{8}(\text{g})\,+
c. \mathrm{C}_{3} \mathrm{H}_{8} \mathrm{O}(\mathrm{g})\,+
d. \mathrm{C}_{8} \mathrm{H}_{18}(\mathrm{g})\,+
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12Consommation en \bf{\text{O}_{2}}
✔ RAI/MOD : Décrire l'état initial et final d'une transformation
chimiqueL'équation de combustion complète du butanol s'écrit :
\mathrm{C}_{4} \mathrm{H}_{10} \mathrm{O}(\mathrm{g})+6\, \mathrm{O}_{2}(\mathrm{g}) \rightarrow 4\, \mathrm{CO}_{2}(\mathrm{g})+5\, \mathrm{H}_{2} \mathrm{O}(\mathrm{g}).
Calculer la quantité de matière de \text{O}_{2} consommée lors de la combustion de 2 moles de butanol.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13Des combustibles variés
✔ RAI/MOD : Écrire l'équation d'une transformation chimique
Les combustibles suivants peuvent réagir avec du dioxygène : kérosène \mathrm{C}_{10} \mathrm{H}_{22}, dihydrogène \text{H}_{2} et méthanol \mathrm{CH}_{4} \mathrm{O}.




1.
Écrire pour chaque combustible les demi-équations en milieu acide des couples oxydant/réducteur.
2. En déduire l'équation modélisant la réaction entre le combustible et le dioxygène dans chaque cas.
2. En déduire l'équation modélisant la réaction entre le combustible et le dioxygène dans chaque cas.
Données
Couples oxydant/réducteur :
- \mathrm{O}_{2}(\mathrm{g}) / \mathrm{H}_{2} \mathrm{O}(\mathrm{l}) ;
- \mathrm{CO}_{2}(\mathrm{g}) / \mathrm{C}_{10} \mathrm{H}_{22}(\mathrm{aq}) ;
- \mathrm{CO}_{2}(\mathrm{g}) / \mathrm{CH}_{4} \mathrm{O}(\mathrm{aq}) ;
- \mathrm{H}_{2} \mathrm{O}(\mathrm{l}) / \mathrm{H}_{2}(\mathrm{g}).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14Pots catalytiques
✔ REA : Respecter les règles de sécuritéDepuis 1993, les voitures à essence doivent être équipées d'un pot catalytique. Ce pot catalytique, placé entre le moteur et le pot d'échappement, assure la combustion complète des gaz d'échappement imbrûlés.
1. Écrire les combustions complète et incomplète (formant du monoxyde de carbone \text{CO}) de l'heptane \text{C}_{7}\text{H}_{16}, composant principal de l'essence.
2. Donner les significations des pictogrammes de sécurité des 2 produits carbonés formés.
|
Composés chimiques |
Sécurité |
|
Monoxyde de carbone \bf{\text{CO}} |
    |
|
Dioxyde de carbone \bf{\text{CO}_{2}} |  |
3. En déduire l'intérêt des pots catalytiques.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ACombustions complètes et incomplètes
✔ MOD : Ajuster une transformation chimique
a. \mathrm{C}_{4} \mathrm{H}_{10}(\mathrm{g})\,+ \text{O}_{2}(\text{g}) \rightarrow
\mathrm{CO}(\mathrm{g})\,+ \mathrm{H}_{2} \mathrm{O}(\mathrm{g}).
b. \mathrm{C}_{2} \mathrm{H}_{6}\mathrm{O}(\mathrm{g})\,+ \text{O}_{2}(\text{g}) \rightarrow
\mathrm{CO}(\mathrm{g})\,+ \mathrm{H}_{2} \mathrm{O}(\mathrm{g}).
c. \mathrm{C}_{6} \mathrm{H}_{14}\mathrm{O}(\mathrm{g})\,+ \text{O}_{2}(\text{g}) \rightarrow
\mathrm{CO}(\mathrm{g})\,+ \mathrm{H}_{2} \mathrm{O}(\mathrm{g}).
d. \mathrm{C}_{18} \mathrm{H}_{36}\mathrm{O}_{2}(\mathrm{g})\,+ \text{O}_{2}(\text{g}) \rightarrow
\mathrm{CO}_{2}(\mathrm{g})\,+ \mathrm{H}_{2} \mathrm{O}(\mathrm{g}).
a. \mathrm{C}_{4} \mathrm{H}_{10}(\mathrm{g})\,+
b. \mathrm{C}_{2} \mathrm{H}_{6}\mathrm{O}(\mathrm{g})\,+
c. \mathrm{C}_{6} \mathrm{H}_{14}\mathrm{O}(\mathrm{g})\,+
d. \mathrm{C}_{18} \mathrm{H}_{36}\mathrm{O}_{2}(\mathrm{g})\,+
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Énergie d'une réaction
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15Choisir son bois
✔ VAL : Effectuer une analyse comparativeChaque année, 5 % des Français se chauffent au bois. La commande de stères de bois est un moment important pour choisir le type de bois à utiliser.


1. Calculer l'énergie libérée par un stère de chaque bois.
2. Conclure sur le bois à choisir.
Données
- 1 stère = 1 m3 ;
- \rho_{\text {hêtre}}=0\text{,}710 kg·L-1 ;
- \rho_{\text {bouleau}}=0\text{,}650 kg·L-1 ;
- Pouvoir calorifique du bouleau : 18\text{,}1 MJ·kg-1 ;
- Pouvoir calorifique du hêtre : 18\text{,}6 MJ·kg-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BFour à pyrolyse
✔ MOD : Appliquer le principe de conservation de l'énergie
Certains fours sont dotés d'une fonction pyrolyse. Cette méthode permet d'éliminer les sucres et les graisses sur les parois du four tel que l'acide caprique (\text{C}_{10}\text{H}_{20}\text{O}_2), acide gras saturé. Pour cela il faut élever la température du four au-dessus de 500 °C, ce qui donne l'énergie suffisante à cet acide pour casser ses liaisons et former des gaz qui s'échappent du four.
1. Cette réaction est-elle exothermique ou endothermique ? En déduire s'il s'agit d'une réaction de combustion.
2. Calculer l'énergie qu'il faut fournir à l'acide caprique pour obtenir des atomes isolés.
Certains fours sont dotés d'une fonction pyrolyse. Cette méthode permet d'éliminer les sucres et les graisses sur les parois du four tel que l'acide caprique (\text{C}_{10}\text{H}_{20}\text{O}_2), acide gras saturé. Pour cela il faut élever la température du four au-dessus de 500 °C, ce qui donne l'énergie suffisante à cet acide pour casser ses liaisons et former des gaz qui s'échappent du four.
1. Cette réaction est-elle exothermique ou endothermique ? En déduire s'il s'agit d'une réaction de combustion.
2. Calculer l'énergie qu'il faut fournir à l'acide caprique pour obtenir des atomes isolés.
Données
- \text{El(C-C) = 347} kJ·mol-1 .
- \text{El(C-H) = 414} kJ·mol-1
- \text{El(O-H) = 464} kJ·mol-1
- \text{El(C=O) = 730} kJ·mol-1
- \text{El(C-O) = 351} kJ·mol-1
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Savoir‑faire : Déterminer le pouvoir calorifique d'un combustible
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16 Pouvoir calorifique de l'heptane
✔RAI/MOD : Appliquer le principe de conservation de l'énergie
1.
Calculer la quantité de matière contenue dans 2 kg d'heptane.
2.
Calculer l'énergie libérée lors de cette combustion.
3.
Calculer le pouvoir calorifique de l'heptane.
Données
- E_{\text{r}}(\text{C}_{7} \text{H}_{16})=-4\,877 kJ·mol-1 ;
- M(\mathrm{C}_{7} \mathrm{H}_{16})= 100\text{,}2 g·mol-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17 Pouvoir calorifique du butanol
✔ RAI/MOD : Appliquer le principe de conservation de l'énergie
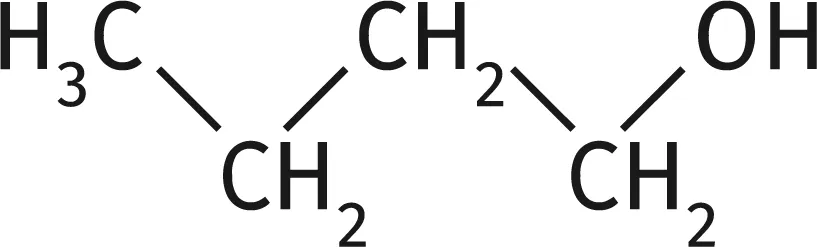
1.
Quelle est la fonction chimique présente dans la molécule de butanol (\text{C}_{4} \text{H}_{10} \text{O}) ?
2. Écrire l'équation de combustion complète du butanol.
2. Écrire l'équation de combustion complète du butanol.
3.
Calculer l'énergie de dissociation des réactifs de cette
réaction.
4. Calculer l'énergie de formation des produits de cette réaction.
5. Calculer l'énergie molaire de réaction de la combustion du butanol. Justifier le signe de cette énergie.
6. En déduire le pouvoir calorifique du butanol.
4. Calculer l'énergie de formation des produits de cette réaction.
5. Calculer l'énergie molaire de réaction de la combustion du butanol. Justifier le signe de cette énergie.
6. En déduire le pouvoir calorifique du butanol.
Données
- M(\text{C}_{4} \text{H}_{10} \text{O})=74\text{,}1 g·mol‑1 ;
- E_{\text{l}}(\text{O}=\text{O})=494 kJ·mol-1 ;
- E_{\text{l}}(\text{C}-\text{C})=346 kJ·mol-1 ;
- E_{\text{l}}(\text{O}-\text{H})=459 kJ·mol-1 ;
- E_{\text{l}}(\text{C}-\text{H})=411 kJ·mol-1 ;
- E_{\text{l}}(\text{C}-\text{O})=358 kJ·mol-1 ;
- E_{\text{l}}(\text{C}=\text{O})=795 kJ·mol-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18 Pouvoir calorifique du benzène
✔ RAI/MOD : Appliquer le principe de conservation de l'énergie✔ RAI/ANA : Construire un raisonnement
Le benzène est un composé organique appartenant à la famille des aromatiques.
Déterminer le pouvoir calorifique du benzène.

Données
- M(\text{C}_{6} \mathrm{H}_{6})=78\text{,}1 g·mol-1 ;
- E_{\text{l}}(\text{C}-\text{C})=346 kJ·mol-1 ;
- E_{\text{l}}(\text{C}-\text{H})=411 kJ·mol-1 ;
- E_{\text{l}}(\text{O}=\text{O})=494 kJ·mol-1 ;
- E_{\text{l}}(\text{C}=\text{O})=795 kJ·mol-1 ;
- E_{\text{l}}(\text{O}-\text{H})=459 kJ·mol-1 ;
- E_{\text{l}}(\text{C}=\text{C})=602 kJ·mol-1.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

