Chapitre 18
Exercices
Pour s'échauffer - Pour commencer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
| Pour commencer | Différenciation | Pour s'entraîner | Pour aller plus loin | |
|---|---|---|---|---|
| Savoir identifier un domaine spectral à l'aide d'une échelle de fréquences ou de longueurs d'onde : | ||||
| Connaître et utiliser l'expression donnant l'énergie d'un photon : | ||||
| Mettre en œuvre un protocole expérimental permettant d'obtenir un spectre d'émission : | ||||
| Exploiter un diagramme de niveaux d'énergie en utilisant les relations \lambda=\dfrac{c}{\nu} et \Delta E=h \cdot \nu : |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour s'échauffer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Donnée
- Constante de Planck : h=6\text{,}63 \times 10^{-34} J·s ;
- 1 eV =1\text{,}60 \times 10^{-19} J ;
- Célérité de la lumière dans le vide : c=3\text{,}00 \times 10^{8} m·s-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ARelation entre longueur d'onde, célérité et fréquence
Annabelle vient d'installer un routeur Wi-Fi à son domicile. La fréquence d'utilisation est une onde hertzienne de 2,4 GHz.
Calculer la longueur d'onde de l'onde en mètre (m).
Calculer la longueur d'onde de l'onde en mètre (m).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5Expression de l'énergie d'un photon (1)
Un lecteur Blu-ray utilise un laser de fréquence 7\text{,}41 \times 10^{5} GHz.Calculer l'énergie (J) et la longueur d'onde (nm) du photon correspondant.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6Domaine spectral
Indiquer à quel domaine spectral appartiennent les ondes utilisées par les appareils suivants : routeur Wi‑Fi, scanner de bagages à l'aéroport, phare de voiture et télécommande de télévision.Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7Expression de l'énergie d'un photon (2)
Calculer l'énergie en joule (J) puis en électron-volt (eV) d'un photon issu d'un pointeur laser de longueur d'onde \lambda=650 nm.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BExpression de l'énergie d'un photon
Jean possède un pointeur laser sur lequel est écrit \lambda= 532 nm.
Calculer la fréquence et l'énergie des photons associées exprimées toutes deux dans leur unité officielle respective.
Calculer la fréquence et l'énergie des photons associées exprimées toutes deux dans leur unité officielle respective.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8Exploiter un diagramme d'énergie
Préciser l'état dans lequel se trouve l'électron pour
chaque niveau d'énergie du doc. 1.Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9Expression de l'énergie d'un photon (3)
Doc. 1 Calculer la variation d'énergie \Delta E entre les niveaux E_{\mathrm{a}} à E_{\mathrm{c}}. Puis, convertir et exprimer sa valeur en joule. Enfin, préciser quels sont les deux phénomènes
possibles liés à cette différence d'énergie.Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1
Diagramme des niveaux d'énergie de l'atome de potassium 
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CExploiter un diagramme d'énergie
Avec le doc 1, préciser la nature de la transition et la représenter sur le diagramme quand l'électron passe du niveau : (a) Ea à Ed ; (b) du niveau Ec à Eb .
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour commencer
Le modèle ondulatoire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10La photodiode
✔ APP : Extraire une information utileUne photodiode est un composant semi-conducteur capable de générer un courant électrique à partir d'un rayonnement électromagnétique.

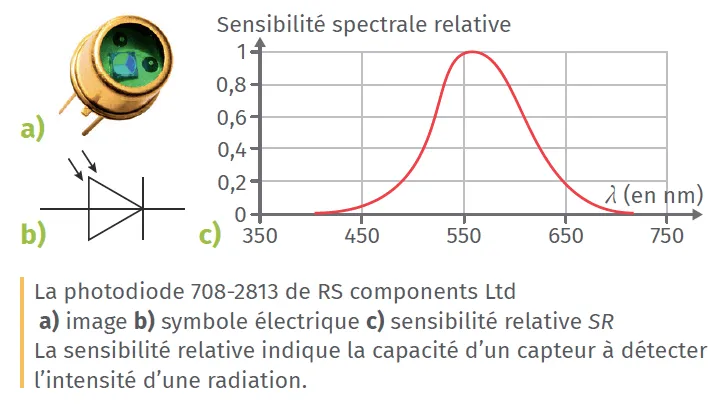
1. À l'aide du graphique de la sensibilité relative S_{\mathrm{R}}=\mathrm{f}(\lambda), indiquer pour quelle longueur d'onde la photodiode est la plus efficace. Indiquer le domaine auquel elle appartient.
2. La photodiode peut-elle détecter les radiations infrarouges ? ultraviolettes ? Expliquer.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11Le laser chirurgical au dioxyde de carbone
\bf{\mathrm{CO}_{2}}
✔ APP : Formuler un résultat attenduLe laser au \mathrm{CO}_{2} existe depuis 1964. Sa puissance pouvant atteindre un kilowatt, on l'utilise pour le découpage et les soudures industrielles. Toutefois, il est également utilisé en chirurgie médicale car il opère à une longueur d'onde très bien absorbée par la peau.
Déterminer la longueur d'onde et le domaine auquel il appartient sachant que le laser fonctionne à une fréquence de 28\text{,}3 THz.
Données
- Constante de Planck : h=6\text{,}63 \times 10^{-34} J·s ;
- 1 eV =1\text{,}60 \times 10^{-19} J ;
- Célérité de la lumière dans le vide : c=3\text{,}00 \times 10^{8} m·s-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
DLa communication Wi-Fi
✔ APP : Formuler un résultat attendu
Les appareils Wi-Fi communiquent avec deux fréquences hertziennes ou ondes submillimétriques de valeur 2,4 GHz ou 5,0 GHz.
1. À quel domaine ces deux ondes appartiennent-elles ?
2. La vitesse de propagation (dans le vide) dépend-elle de leur fréquence ? Justifier.
3. Calculer les deux longueurs d'ondes \lambda_{inf} et \lambda_{sup} correspondantes aux deux fréquences utilisées.
Les appareils Wi-Fi communiquent avec deux fréquences hertziennes ou ondes submillimétriques de valeur 2,4 GHz ou 5,0 GHz.
1. À quel domaine ces deux ondes appartiennent-elles ?
2. La vitesse de propagation (dans le vide) dépend-elle de leur fréquence ? Justifier.
3. Calculer les deux longueurs d'ondes \lambda_{inf} et \lambda_{sup} correspondantes aux deux fréquences utilisées.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Le modèle particulaire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12La thermographie (infrarouge)
✔ RAI/ANA : Associer les unités de mesure à leurs grandeurs
correspondantesUtilisée dans de nombreux domaines, la thermographie permet de visualiser à distance la température d'un objet ou d'une personne. En médecine, l'imageur transforme le rayonnement infrarouge mesuré dans une bande spectrale comprise entre 2 et 5 \mum en un signal électrique pour le coder ensuite en fausse couleur.


Calculer la bande de fréquence et d'énergie du photon détecté.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13La radiothérapie
✔ RAI/ANA : Associer les unités de mesure à leurs grandeurs
correspondantesLa radiothérapie est un traitement local contre le cancer. Avec l'aide d'un accélérateur linéaire, on expose une personne à un rayonnement ionisant d'une fréquence voisine de 3 \times 10^{20} Hz pour bloquer la capacité des cellules cancérigènes à se multiplier.


1. Calculer l'énergie transportée par le photon en MeV.
2. Comparer sa valeur avec celle du visible (2 eV en moyenne) et l'infrarouge (exercice ). Conclure.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
La quantification d'énergie
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ELe lithium
✔ Compétence
Bien que très utilisé dans la production d'accumulateurs rechargeables, ce métal alcalin n'existe pas à l'état natif car il s'oxyde très rapidement. C. Gmelin a observé dès 1818 que ses sels donnent une flamme rouge et intense.
1. Donner une explication à l'existence de niveaux d'énergie dans un atome tel que le lithium.
2. Calculer l'écart d'énergie \Delta E correspondant à la transition entre le premier état excité et le fondamental.
3. Après avoir calculé, en joules, l'énergie E_r du photon émis, vérifier si la longueur d'onde \Delta_r est cohérente avec la couleur observée.
Niveaux d'énergie de l'atome de lithium (eV)
Bien que très utilisé dans la production d'accumulateurs rechargeables, ce métal alcalin n'existe pas à l'état natif car il s'oxyde très rapidement. C. Gmelin a observé dès 1818 que ses sels donnent une flamme rouge et intense.
1. Donner une explication à l'existence de niveaux d'énergie dans un atome tel que le lithium.
2. Calculer l'écart d'énergie \Delta E correspondant à la transition entre le premier état excité et le fondamental.
3. Après avoir calculé, en joules, l'énergie E_r du photon émis, vérifier si la longueur d'onde \Delta_r est cohérente avec la couleur observée.
Données
Niveaux d'énergie de l'atome de lithium (eV)
- E1 = -5{,}39
- E2 = -3{,}54
- E3 = -2{,}01
- E4 = -1{,}55
- E5 = -1{,}51
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Savoir‑faire : Exploiter un diagramme de niveaux d'énergie en utilisant les relations \lambda=\dfrac{c}{\nu} et \Delta E=h \cdot \nu
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
L'hydrogène est l'élément majeur de l'Univers. Tandis que le gaz dihydrogène est très utilisé dans
l'industrie du pétrole pour ses propriétés chimiques, on utilise l'atome d'hydrogène en laboratoire afin de
régler précisément d'autres appareils à l'aide d'une lampe à décharge.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14
L'atome d'hydrogène : série de Paschen
✔ APP : Extraire une information utile1. Déterminer la différence d'énergie \Delta E, en eV, associée au passage de l'électron du niveau d'énergie 7 au niveau d'énergie 3.
2. Exprimer cette différence \Delta E en joule.
3. Que devient cette énergie cédée par l'atome ?
4. Déterminer la fréquence, puis la longueur d'onde de la radiation associée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15L'atome d'hydrogène : série de Balmer
✔ APP : Maîtriser le vocabulaire1. Déterminer la différence d'énergie \Delta E, en joule, associée à la transition d'énergie entre les niveaux 3 et 2.
2. Déterminer la fréquence, puis la longueur d'onde de la radiation émise.
3. À quel domaine appartient la radiation émise ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16
L'atome d'hydrogène : série de Lyman
✔ RAI/ANA : Construire un raisonnement, communiquer sur les
étapes
Certaines galaxies émettent une raie dite « Lyman-alpha » de longueur d'onde \lambda=121\text{,}6 nm (doc. 1).
Déterminer la transition responsable de cette émission.
Certaines galaxies émettent une raie dite « Lyman-alpha » de longueur d'onde \lambda=121\text{,}6 nm (doc. 1).
Déterminer la transition responsable de cette émission.
Doc. 1
Diagramme des niveaux d'énergie de l'atome d'hydrogène

Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

