Chapitre 1
Cours
Modélisation des transformations acide‑base
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Notions d'acides et de bases
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ADéfinition
Selon Brönsted, un acide est une espèce chimique capable de céder un ou plusieurs ions hydrogène \text{H}^+. Une base, quant à elle, est une espèce capable de capter un ou plusieurs ion(s) hydrogène.
Exemples :
Le sulfure de dihydrogène \text{H}_2\text{S} () est un acide car il peut libérer un ion hydrogène selon la réaction d'équation :
L'ammoniac \text{NH}_3 est une base car elle peut capter un proton :
Une espèce amphotère est une espèce possédant à la fois des propriétés acides et basiques.
Exemple :
\text{H}_2\text{O} est un acide car \text{H}_2\text{O}\text{(l)} \rightleftarrows \text{HO}^-\text{(aq)} + \text{H}^+, mais aussi une base car \text{H}_2\text{O}\text{(l)} + \text{H}^+ \rightleftarrows \text{H}_3\text{O}^+\text{(aq)} donc \text{H}_2\text{O} est une espèce amphotère.
Exemples :
Le sulfure de dihydrogène \text{H}_2\text{S} () est un acide car il peut libérer un ion hydrogène selon la réaction d'équation :
\text{H}_2\text{S}\text{(aq)} \rightleftarrows \text{HS}^-\text{(aq)} + \text{H}^+
L'ammoniac \text{NH}_3 est une base car elle peut capter un proton :
\text{NH}_3 \text{(aq)} + \text{H}^+ \rightleftarrows \text{NH}^{+}_4\text{(aq)}
Une espèce amphotère est une espèce possédant à la fois des propriétés acides et basiques.
Exemple :
\text{H}_2\text{O} est un acide car \text{H}_2\text{O}\text{(l)} \rightleftarrows \text{HO}^-\text{(aq)} + \text{H}^+, mais aussi une base car \text{H}_2\text{O}\text{(l)} + \text{H}^+ \rightleftarrows \text{H}_3\text{O}^+\text{(aq)} donc \text{H}_2\text{O} est une espèce amphotère.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BCouple acide‑base
Un acide et une base sont dits « conjugués » s'ils sont reliés par une équation de la forme :
\text{AH}\text{(aq)} \rightleftarrows \text{A}^-\text{(aq)} + \text{H}^+
Un acide conjugué et une base conjuguée forment un couple acide-base. Le couple est noté : \text{AH}\text{(aq)}/\text{A}^-\text{(aq)}.
Exemples de couples :
\text{H}_2\text{S}\text{(g)/HS}^-\text{(aq)}, \text{H}_2\text{O(l)/HO}^-\text{(aq)} et \text{H}_3\text{O}^+\text{(aq)/H}_2\text{O(l)}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CModélisation d'une réaction acide‑base
Une réaction acide-base est un échange de protons entre une espèce acide d'un couple et une espèce basique d'un autre couple.
La réaction acide-base met donc en jeu deux couples acide-base.
Exemple de la réaction limitée entre l'eau \text{H}_2\text{O} et l'ammoniac \text{NH}_3 :
\text{H}_2\text{O(l)/HO}^-\text{(aq) : H}_2\text{O (l)} \rightleftarrows \text{HO}^- \text{(aq) }+ \text{H}^+
\text{NH}^+_4 \text{(aq) /NH}_3\text{(aq) : NH}_3 \text{(aq)} + \text{H}^+ \rightleftarrows \text{NH}^+_4 \text{(aq)}
La réaction acide-base a pour équation :
\text{H}_2\text{O(l)} + \text{NH}_3 \text{(aq)} \rightleftarrows \text{HO}^-\text{(aq)} + \text{NH}^+_4\text{(aq)}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retrouvez une explication des transformations acido-basique en vidéo :
Matthieu Colombel,
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 Sources chaudes


Les sources chaudes d'origine volcanique sont acidifiées par les émanations soufrées.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Acide
Amphotère
Base
Réaction acide-base
Acide : espèce capable de céder un (ou plusieurs) proton(s).
Amphotère : possédant un caractère acide et basique.
Base : espèce capable de capter un (ou plusieurs) proton(s).
Réaction acide-base : réaction impliquant un échange de protons entre l'acide et la base.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Galeries acides


Roches calcaires creusées par le passage des eaux acides.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Structure et caractère acide ou basique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ALibération des ions \text{H}^+
Pour libérer un ion \text{H}^+, la liaison entre un atome d'hydrogène et le reste de la molécule doit être fortement polarisée et l'atome d'hydrogène doit porter une charge partielle positive.
Plus la liaison \text{R} - \text{H} est polarisée, plus l'atome d'hydrogène peut être facilement libéré et capté par une base.
Exemples de liaisons polarisées :
\text{H} - \text{O} \:; \text{H} - \text{N} \:; \text{H} - \text{Cl} \:; \text{H} - \text{Br} \:; \text{H} - \text{I}
Plus la liaison \text{R} - \text{H} est polarisée, plus l'atome d'hydrogène peut être facilement libéré et capté par une base.
Exemples de liaisons polarisées :
\text{H} - \text{O} \:; \text{H} - \text{N} \:; \text{H} - \text{Cl} \:; \text{H} - \text{Br} \:; \text{H} - \text{I}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BCas des acides carboxyliques
Les acides carboxyliques sont des molécules organiques possédant un groupe carboxyle.
Le groupe carboxyle possède un atome d'hydrogène mobile qui lui confère un caractère acide.
La demi-équation acide-base est :
\text{R} - \text{COOH(aq)} \rightleftarrows \text{R}-\text{COO}^-\text{(aq)} + \text{H}^+
où \text{R} - \text{COO}^-\text{(aq)} (ion carboxylate) est la base conjuguée de \text{R} - \text{COOH(aq)} (acide carboxylique).


Exemple :
\text{CH}_3\text{COOH(aq)}/\text{CH}_3\text{COO}^-\text{(aq)} : acide éthanoïque/ion éthanoate
Le groupe carboxyle possède un atome d'hydrogène mobile qui lui confère un caractère acide.
La demi-équation acide-base est :
\text{R} - \text{COOH(aq)} \rightleftarrows \text{R}-\text{COO}^-\text{(aq)} + \text{H}^+
où \text{R} - \text{COO}^-\text{(aq)} (ion carboxylate) est la base conjuguée de \text{R} - \text{COOH(aq)} (acide carboxylique).


Exemple :
\text{CH}_3\text{COOH(aq)}/\text{CH}_3\text{COO}^-\text{(aq)} : acide éthanoïque/ion éthanoate
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
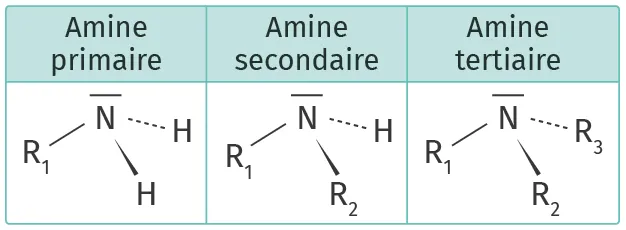
CCas des amines
Une amine est un composé organique dérivé de l'ammoniac dont au moins un atome d'hydrogène a été remplacé par un groupe carboné.
Exemple : la méthylamine
La liaison \text{N} - \text{H} est polarisée : les amines peuvent donc être acides. Or, cet aspect acide est peu prononcé. En revanche, l'atome d'azote électronégatif possède un doublet non liant susceptible de capter un ion \text{H}^+ pour former un ion ammonium.

Les amines sont donc surtout des bases.
Exemple :
Ion méthylammonium/méthylamine

Exemple : la méthylamine
La liaison \text{N} - \text{H} est polarisée : les amines peuvent donc être acides. Or, cet aspect acide est peu prononcé. En revanche, l'atome d'azote électronégatif possède un doublet non liant susceptible de capter un ion \text{H}^+ pour former un ion ammonium.

Les amines sont donc surtout des bases.
Exemple :
Ion méthylammonium/méthylamine

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3 Polarisation d'une liaison

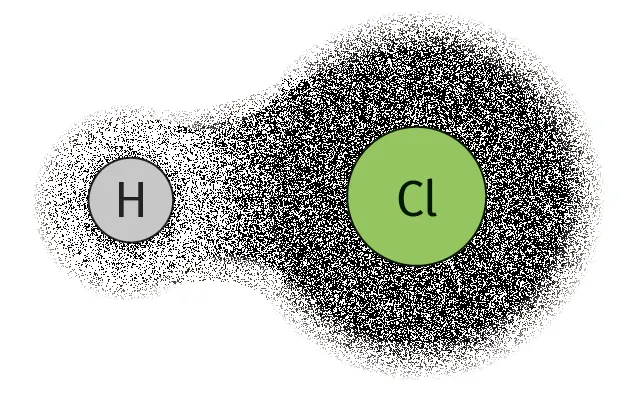
Les zones les plus grises représentent les régions de l'espace où les électrons de la liason covalente ont la plus grande probabilité de se trouver.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Un atome d'hydrogène lié à un atome de carbone n'a pas de caractère acide car la liaison \text{C} - \text{H} est très faiblement polarisée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4 Acide formique


L'acide méthanoïque \text{HCOOH}, dit acide formique, est produit par les fourmis. Sa base conjuguée est l'ion méthanoate \text{HCOO}^-. Le second atome d'hydrogène, lié à l'atome de carbone, n'est pas susceptible d'être libéré.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Dans une formule, \text{R} représente une chaîne carbonée quelconque qui prolonge la molécule.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Lien entre acidité et \textbf{pH}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ADéfinition du \textbf{pH}
En solution aqueuse, le \text{pH} est défini à partir de la relation suivante :
\text{pH}=-\log \left(\dfrac{\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]}{c^{\circ}}\right)
Réciproquement, on a donc toujours :
[\text{H}_3\text{O}^+] = c°· 10^{-\text{pH}}
Plus la concentration en ion oxonium est élevée, et plus le \text{pH} est faible.

\text{pH}=-\log \left(\dfrac{\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]}{c^{\circ}}\right)
[\text{H}_3\text{O}^+] : concentration en ion oxonium (mol·L-1)
c° : concentration standard égale à c° = 1 mol·L-1
c° : concentration standard égale à c° = 1 mol·L-1
Réciproquement, on a donc toujours :
[\text{H}_3\text{O}^+] = c°· 10^{-\text{pH}}
Plus la concentration en ion oxonium est élevée, et plus le \text{pH} est faible.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B\textbf{pH} et dilution
Lors d'une dilution, on note F le facteur de dilution correspondant au rapport entre les concentrations de la solution mère c_\text{mère} et de la solution fille c_\text{fille}, exprimées en (mol·L-1) :
Pour une solution d'acide fort, en considérant les concentrations en ion oxonium \text{H}_3\text{O}^+(\text{aq}) et une dilution raisonnable, on a :
\text{pH}_{\text{fille}} = -\log \left(\frac{\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]_{\mathrm{fille}}}{c^{\circ}}\right)
\mathrm{pH}_{\mathrm{fille}}=-\log \left(\frac{\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]_{\mathrm{mère}}}{F \cdot c^{\circ}}\right)
\mathrm{pH}_{\mathrm{fille}}=\log (F)-\log \left(\frac{\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]_{\mathrm{mère}}}{c^{\circ}}\right)
\mathrm{pH}_{\mathrm{fille}}=\log (F)+\mathrm{pH}_{\mathrm{mère}}
Exemple :
Si F = 10, alors :
\text{pH}_{\text{fille}} = \text{log}(F) + \text{pH}_{\text{mère}}
\text{pH}_{\text{fille}} = 1 + \text{pH}_{\text{mère}}
F = \dfrac{c_{\text{mère}}} {c_{\text{fille}}}
Pour une solution d'acide fort, en considérant les concentrations en ion oxonium \text{H}_3\text{O}^+(\text{aq}) et une dilution raisonnable, on a :
\text{pH}_{\text{fille}} = -\log \left(\frac{\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]_{\mathrm{fille}}}{c^{\circ}}\right)
\mathrm{pH}_{\mathrm{fille}}=-\log \left(\frac{\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]_{\mathrm{mère}}}{F \cdot c^{\circ}}\right)
\mathrm{pH}_{\mathrm{fille}}=\log (F)-\log \left(\frac{\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]_{\mathrm{mère}}}{c^{\circ}}\right)
\mathrm{pH}_{\mathrm{fille}}=\log (F)+\mathrm{pH}_{\mathrm{mère}}
Exemple :
Si F = 10, alors :
\text{pH}_{\text{fille}} = \text{log}(F) + \text{pH}_{\text{mère}}
\text{pH}_{\text{fille}} = 1 + \text{pH}_{\text{mère}}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CSécurité lors de dilutions
La réaction entre un acide et une base est exothermique : elle dégage de la chaleur (). Pour éviter les projections corrosives lors d'une dilution, il est préférable de verser d'abord le solvant puis l'acide (ou la base) concentré(e).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 5 Soda acide


Le \text{pH} de ce soda est égal à 2,6. On en conclut que :
[\text{H}_3\text{O}^+] = c° \cdot 10^{-\text{pH}}
AN : [\text{H}_3\text{O}^+] = 1 \times 10^{-2{,}6}
[\text{H}_3\text{O}^+] = 2{,}5 \times 10^{-3} mol·L-1
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
« log » représente la fonction logarithme décimal. Sur la calculatrice, ne pas la confondre avec le logarithme népérien « ln ».


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Les ions \text{H}^+ n'existent pas seuls en solution aqueuse. Ils s'associent avec \text{H}_2\text{O(l)} au cours d'une réaction pour former \text{H}_3\text{O}^+\text{(aq)} selon la demi-équation :
\text{H}_2\text{O}(\text{l}) + \text{H}^+ \leftrightarrows \text{H}_3\text{O}^+(\text{aq})
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 6 Mélange exothermique


La photographie montre un mélange d'une solution basique d'hydroxyde de sodium et d'acide chlorhydrique. La réaction entre les ions \text{H}_3\text{O}^+\text{(aq)} et \text{HO}^-\text{(aq)} qui s'y produit est exothermique, c'est-à-dire qu'elle libère de l'énergie.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

