Chapitre 9
Cours
Structure et optimisation en chimie organique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Nom et représentation des molécules
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AFormule topologique et isomérie
Pour identifier une molécule, il est nécessaire de connaître :
Pour simplifier les représentations et rendre compte de l'agencement spatial, on peut aussi représenter la formule topologique de la molécule.
- sa formule brute. Elle indique la nature et le nombre des atomes qui la constituent ;
- son schéma de Lewis ou sa formule semi-développée. Ils indiquent des liaisons entre les différents atomes constituant une molécule.
Pour simplifier les représentations et rendre compte de l'agencement spatial, on peut aussi représenter la formule topologique de la molécule.
Dans une formule topologique, les atomes de carbone et d'hydrogène de la chaîne carbonée ne sont pas représentés. Seules les liaisons carbone‑carbone sont schématisées par des traits. Les autres atomes sont représentés à l'aide de leur symbole.
Lorsque deux molécules ont la même formule brute, mais des formules semi‑développées ou topologiques différentes, on parle d'isomères de constitution
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Formule topologique
Formule brute : \text{C}_7\text{H}_{11}\text{O}_2\text{Cl}
Formule semi‑développée :
 Formule topologique :
Formule topologique :
 Un isomère de constitution :
Un isomère de constitution :

Formule semi‑développée :



Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Sur la formule topologique, il faut représenter les atomes d'hydrogène portés par tous les atomes qui ne sont pas des atomes de carbone.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BSquelette carboné insaturé/cyclique
Le squelette carboné constitue la « charpente » d'une molécule organique. Ce squelette peut s'organiser de différentes façons :
La structure du squelette carboné explique certaines propriétés chimiques et physiques des molécules.
Exemple : molécules avec six atomes de carbone.
- la chaîne carbonée la plus longue peut présenter des doubles liaisons \mathrm{C}=\mathrm{C} ou des liaisons triples \mathrm{C} \equiv \mathrm{C} on dit alors que la molécule est insaturée ou qu'elle présente des insaturations.
- la chaîne carbonée peut se fermer sur elle‑même : la molécule est dite cyclique.
- la chaîne carbonée la plus longue présente des ramifications : la molécule est dite ramifiée.
- la chaîne carbonée la plus longue ne présente ni ramification ni cycle ; la molécule est dite linéaire.
La structure du squelette carboné explique certaines propriétés chimiques et physiques des molécules.
Exemple : molécules avec six atomes de carbone.
| Formule brute \textbf{C}_{\bold 6}\textbf{H}_{\bold{14}} | Formule brute \textbf{C}_{\bold 6}\textbf{H}_{\bold{12}} | ||
 |
 |
 |
 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Représentation du benzène
La formule topologique du benzène de formule brute \text{C}_6\text{H}_6 possède deux formes différentes dites formes mésomères :
 Les doubles liaisons sur ces cycles n'étant
pas localisées, c'est‑à‑dire qu'elles peuvent
être permutées avec les liaisons simples du
cycle, il est possible de représenter la
molécule de la façon suivante :
Les doubles liaisons sur ces cycles n'étant
pas localisées, c'est‑à‑dire qu'elles peuvent
être permutées avec les liaisons simples du
cycle, il est possible de représenter la
molécule de la façon suivante :
 Les atomes forment des structures
cycliques et planes particulièrement
stables.
Les atomes forment des structures
cycliques et planes particulièrement
stables.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CFamilles fonctionnelles
Certains groupes d'atomes appelés groupes caractéristiques confèrent
aux molécules des propriétés chimiques particulières. Cet ensemble
de molécules possédant un même groupe caractéristique constitue
une famille fonctionnelle.
| Groupe d'atomes |
 |
 |
 |
 |
| Nom du groupe | Hydroxyle | Carbonyle | Carbonyle | Carboxyle |
| Famille | Alcool | Aldéhyde | Cétone | Acide carboxylique |
| Groupe d'atomes |
 |
 |
 |
 |
| Nom du groupe | Ester | Amine | Amide | Halogéno |
| Famille | Ester | Amine | Amide | Halogénoalcane |
La notation \text{R} désigne une suite d'atomes commençant par un atome de carbone ou un atome d'hydrogène. La notation \text{R}' désigne uniquement une suite commençant par un atome de carbone. La notation \text{X} désigne quant à elle un atome halogène (fluor \text{F}, chlore \text{Cl}, brome \text{Br}, etc.).
Les molécules sont dites polyfonctionnelles lorsqu'elles possèdent plusieurs groupes caractéristiques.
Exemple : l'acide lactique (ou acide 2-hydroxypropanoïque) est une molécule polyfonctionnelle.


➜ Fiche méthode 14,
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Méthodologie
Pour déterminer l'ensemble des molécules
isomères à partir d'une formule
brute, il faut :
- choisir un groupe caractéristique (si présence d'atome d'oxygène, d'azote ou de chlore, etc.) ;
- vérifier la présence d'insaturations ou non ;
- y associer une chaîne carbonée la plus longue possible ;
- réduire cette chaîne carbonée avec des ramifications ;
- recommencer si un autre groupe caractéristiques est possible.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4Acide lactique

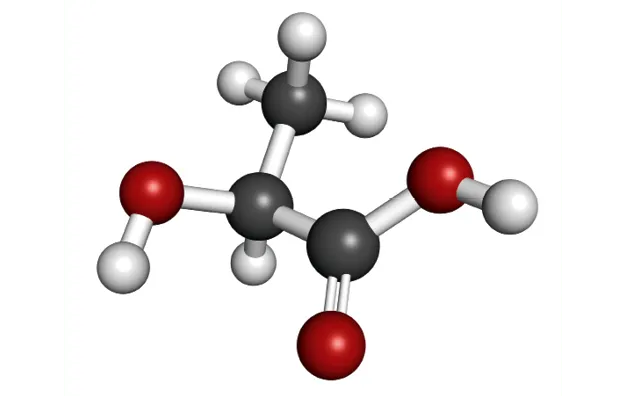
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retrouvez une explication des groupes caractéristiques en vidéo :
Matthieu Colombel,
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Le terme de macromolécule est plutôt utilisé par les biologistes pour des molécules naturelles issues du vivant, alors que le terme de polymère est préféré pour des molécules synthétiques. Dans le manuel, on utilisera ces deux termes indistinctement.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Polymères
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AMotif d'un polymère
Une macromolécule ou polymère est une grande molécule (sa masse
molaire est de l'ordre de grandeur est de 10^5 g·mol-1) résultant de l'assemblage d'un grand nombre de motifs, via des liaisons covalentes.
Les molécules dont sont issus les motifs se nomment des monomères.
La polymérisation est la transformation chimique qui permet l'assemblage des monomères pour former une macromolécule.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 5Billes de polystyrène


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BPolymères naturels, polymères synthétiques
Depuis près d'un siècle, de nombreuses recherches ont permis la synthèse
de différents types de polymères avec des propriétés chimiques,
physiques ou biologiques remarquables.
L'industrie du plastique est intimement liée à l'essor de la chimie des
polymères. Leur production ne cesse de croître, car ils sont présents
dans de nombreux domaines. Dépendante, l'humanité se préoccupe
de cette croissance, première cause de pollution de son environnement.
Désormais, la législation européenne interdit certains objets
tels que les pailles en plastique (à partir de 2021). Les bioplastiques,
élaborés à partir de la biomasse, seront des alternatives aux plastiques
issus du pétrole, malgré un coût plus élevé.

Retrouvez plus d'informations sur les bioplastiques en vidéo en .
Qu'ils soient naturels ou synthétiques, certains polymères sont à
l'origine des évolutions sociétales et environnementales (matériaux
biosourcés, fibres textiles, revêtements, etc.).

Retrouvez plus d'informations sur les bioplastiques en vidéo en .
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 6Représentation d'un polymère
Pour représenter la structure d'un
polymère :
Exemple : molécule de polypropylène

- mettre entre parenthèses le motif ;
- apposer en indice \text{n}.
Exemple : molécule de polypropylène

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Polymères naturels ou biopolymères
Polymères synthétiques
Polymères naturels ou biopolymères : polymères issus de la nature, de matériaux vivants.
Polymères synthétiques : polymères élaborés par les chimistes.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CAutour de nous


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 7Récolte du latex


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 8Quelques dates‑clés
- 1919 : Hermann Staudinger est à l'initiative des premières polymérisations.
- 1943 : L'entreprise Bayer synthétise les premiers polyuréthanes.
- 1953 : Karl Ziegler et Giulio Natta mettent au point des réactions de polymérisation catalysées.
- 1970‑1980 : Pierre‑Gilles de Gennes, lauréat du prix Nobel de physique, s'intéresse aux propriétés physico‑chimiques des polymères.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Optimisation d'une étape de synthèse
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Le graphique ci-contre (doc. 9) représente la concentration d'un produit en fonction du temps.
Afin d'optimiser la transformation (I), le chimiste peut faire varier
les conditions opératoires pour améliorer :
- la vitesse de formation des produits (II) ;
- le rendement de la transformation (III) ;
- les deux
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 9Évolution de la concentration

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AOptimisation de la vitesse de la réaction
L'augmentation de la température ou des concentrations des réactifs est un facteur cinétique sur lequel le chimiste peut s'appuyer pour modifier la vitesse d'une transformation chimique.
Dans cette perspective, la réflexion autour des catalyseurs est fondamentale.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- D'autres facteurs cinétiques existent, comme la pression, le choix du solvant, le \text{pH} du milieu réactionnel, la lumière, etc.
- Attention, certaines transformations sont athermiques.
Elles ne nécessitent pas d'apport d'énergie thermique pour s'effectuer et ne dégagent pas d'énergie (ni endothermique ni exothermique). Cela ne signifie pas que l'apport d'énergie thermique ne modifie pas le bilan de la transformation en elle‑même.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Catalyseur
Catalyseur : espèce chimique qui permet d'augmenter la vitesse d'une transformation chimique, mais qui n'intervient pas dans l'équation‑bilan de cette réaction.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BOptimisation du rendement de la réaction
Dans le modèle de l'équilibre dynamique, le sens d'évolution d'une transformation chimique dépend de la valeur du quotient de réaction Q_{r} et de la valeur de la constante d'équilibre K à une température donnée. Or, le principe de Le Chatelier (1884) à propos des déplacements d'équilibre énonce :
« Un système chimique en équilibre soumis à une perturbation (introduction d'un réactif, élimination d'un produit, variation de la pression, de la température, etc.) tend à s'opposer à cette perturbation, le déplacement de l'équilibre tendant à restituer les conditions initiales. »
« Un système chimique en équilibre soumis à une perturbation (introduction d'un réactif, élimination d'un produit, variation de la pression, de la température, etc.) tend à s'opposer à cette perturbation, le déplacement de l'équilibre tendant à restituer les conditions initiales. »
Ainsi, mettre en excès un des réactifs ou éliminer un des produits formés conduit à déplacer l'équilibre chimique dans le sens de formation des produits et donc à augmenter le rendement de la transformation chimique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Découvrez plus d'informations sur l'optimisation des rendements :
Retrouvez une explication du rendement d'une synthèse en vidéo :
Retrouvez une explication du rendement d'une synthèse en vidéo :
Matthieu Colombel,
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Les facteurs cinétiques peuvent aussi augmenter ou diminuer la vitesse volumique d'apparition d'un produit.


Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

