Chapitre 1
Exercices
Pour aller plus loin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
33Le radium caractérisé par Marie Curie
✔ VAL : Identifier et évaluer les sources d'erreurs
Pierre et Marie Curie découvrent en 1898 deux nouveaux éléments : le polonium et le radium. Cette fiche cartonnée datant de 1902 montre comment ils ont réussi à trouver la masse atomique du radium. Le bilan de la transformation chimique étudiée est :
\text{RaCl}_2 + 2 \text{AgNO}_3 \rightarrow \text{Ra}(\text{NO}_3)_2 + 2 \text{AgCl}.
Lors de cette transformation, la disparition d'1 mol de \text{RaCl}_2 forme 2 mol de \text{AgCl}.
\text{RaCl}_2 + 2 \text{AgNO}_3 \rightarrow \text{Ra}(\text{NO}_3)_2 + 2 \text{AgCl}.
Lors de cette transformation, la disparition d'1 mol de \text{RaCl}_2 forme 2 mol de \text{AgCl}.

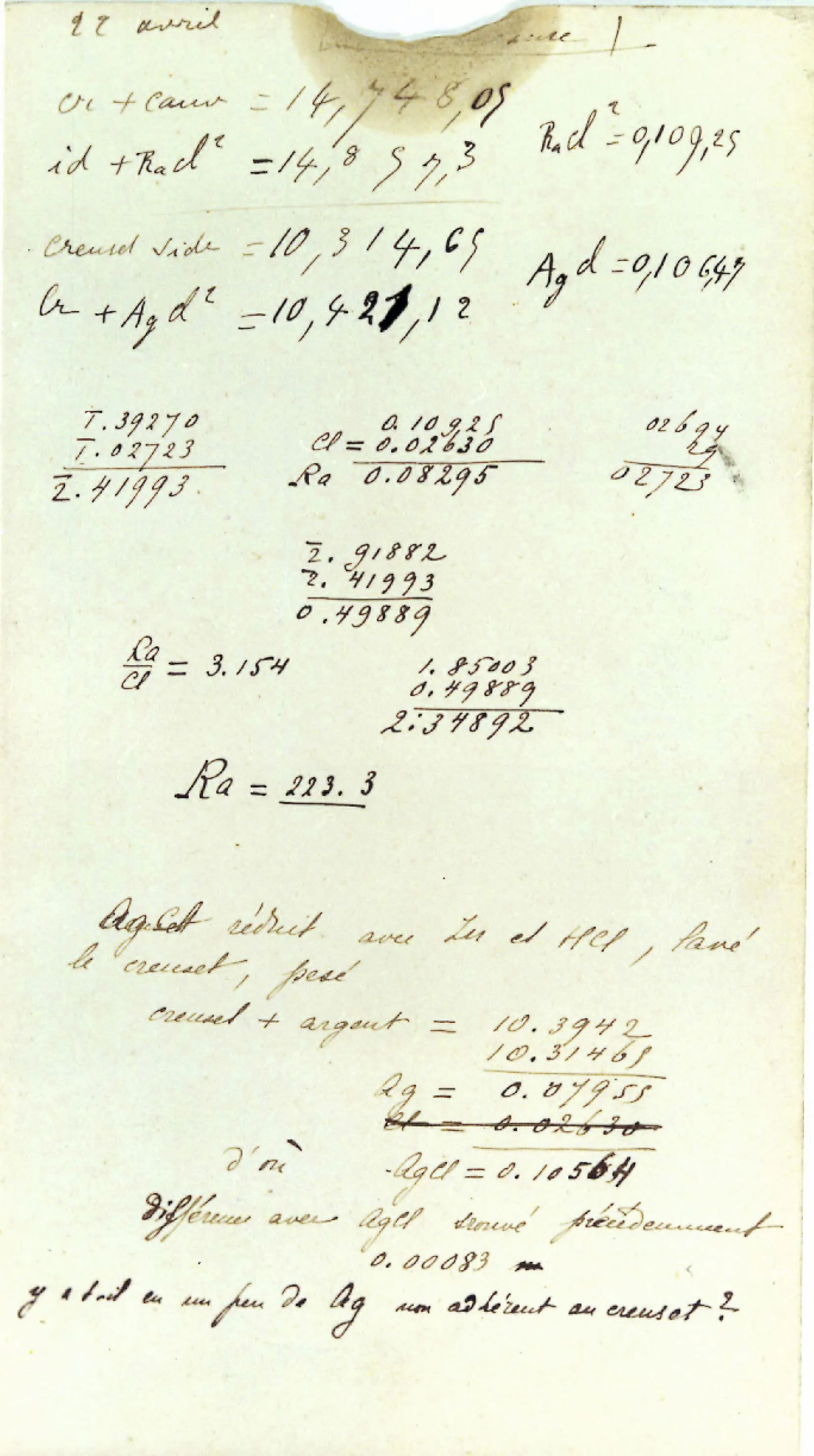
1.
Calculer la quantité de matière obtenue de \text{AgCl}.
2. En déduire la quantité de matière de \text{RaCl}_2 ayant réagi.
3. En déduire la masse molaire atomique du radium \text{Ra}.
4. Expliquer la différence entre la valeur trouvée et la valeur actuelle de M(\text{Ra}) = 226 g·mol-1.
2. En déduire la quantité de matière de \text{RaCl}_2 ayant réagi.
3. En déduire la masse molaire atomique du radium \text{Ra}.
4. Expliquer la différence entre la valeur trouvée et la valeur actuelle de M(\text{Ra}) = 226 g·mol-1.
Données
- Masses initiales des réactifs de la réaction :
m_{\mathrm{i}}\left(\mathrm{RaCl}_{2}\right)= 0\text{,}109\,25 g ;
m_{\mathrm{i}}\left(\mathrm{AgNO}_{3}\right)= 0\text{,}126\,28 g ; - Masses finales des produits de réaction :
m_{\mathrm{f}}(\mathrm{Ag} \mathrm{Cl})= 0\text{,}106\,54 g ;
m_{\mathrm{f}}\left(\mathrm{Ra}(\mathrm{NO_{3}})_{2}\right) = 0\text{,}128\,99 g.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
34 Bac
Mesure expérimentale du volume molaire
✔ RAI/ANA : Utiliser une analyse dimensionnelle La réaction entre un acide et du magnésium \text{Mg} forme du dihydrogène \text{H}_2. Pour s'assurer que tout le magnésium ait réagi, on conseille un mélange de 5,0 à 7,0 cm de magnésium en ruban avec 100 mL d'acide chlorhydrique à 0,50 mol·L-1. Il se forme 1 mol de gaz pour 1 mol de magnésium disparu.
1. Proposer un protocole expérimental permettant la mesure du volume de gaz formé.
2. Après validation par le professeur, réaliser le protocole proposé. Relever la valeur du volume de \text{H}_2.
3. À l'aide d'une analyse dimensionnelle, montrer que la quantité d'acide chlorhydrique initiale est de 5{,}0 \times 10^{-2} mol.
4. Déterminer la quantité de magnésium maximale introduite.
5. En déduire la composition initiale du système chimique.
6. Calculer la valeur du volume molaire dans les conditions de cette expérience.
Donnée
- Masse linéique du ruban de magnésium : 1,0 g par mètre.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
35Expérience de Lavoisier
✔ RAI/ANA : Associer les unités de mesure à leurs grandeurs
correspondantes

Lavoisier met à bouillir 4 onces de mercure \text{Hg} pur dans 50 pouces cubiques d'air. Au bout de 12 jours, il récupère 43 pouces cubiques d'air et il se forme un solide rouge de \text{HgO} d'une masse de 46 grains. Le gaz récupéré ne permet plus la respiration des animaux.
1. Expliquer la diminution du volume d'air.
2. Calculer la quantité de matière de dioxygène disparu.
3. Sachant que 1 mol de \text{O}_2 forme 2 mol de \text{HgO}, calculer la masse de \text{HgO} formé.
4. Comparer avec le résultat expérimental obtenu par Lavoisier.
Données
- Volume molaire : V_\text{m} = 24,0 L·mol-1;
- 1 pouce cubique = 19,8 mL ;
- 1 once = 30,56 g ;
- 1 grain = 53,3 mg.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
36L'araignée tisserande d'eau
✔ RAI/ANA : Faire le lien entre les modèles microscopiques et
les grandeurs macroscopiques

Si une araignée était capable de créer un fil en alignant les molécules d'eau d'une simple goutte, calculer la longueur du fil obtenu.
Données
- Volume d'une goutte d'eau : V_\text{goutte} = 0,05 ml ;
- Taille d'une molécule d'eau : d_\text{eau} = 0,43 nm ;
- Masse volumique de l'eau : \rho_\text{eau} = 1 000 g·L-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AEau oxygénée
✔ MOD : Modéliser une transformation chimique
L'eau oxygénée \text{H}_2\text{O}_2, est utilisée comme désinfectant. Cependant, elle n'est pas stable . Elle réagit lentement avec elle-même (on dit qu'elle se dismute) pour donner de l'eau et du dioxygène. On considère une bouteille d'eau oxygénée de concentration « 10 volumes ». Ce qui signifie que si 1 L de la solution se dismute complètement, il se formera 10 L de dioxygène (à pression et température standards).
1. Écrire et ajuster l'équation de la réaction.
2. À quelle concentration en masse d'eau oxygénée correspond l'indication « 10 volumes » ?
L'eau oxygénée \text{H}_2\text{O}_2, est utilisée comme désinfectant. Cependant, elle n'est pas stable . Elle réagit lentement avec elle-même (on dit qu'elle se dismute) pour donner de l'eau et du dioxygène. On considère une bouteille d'eau oxygénée de concentration « 10 volumes ». Ce qui signifie que si 1 L de la solution se dismute complètement, il se formera 10 L de dioxygène (à pression et température standards).
1. Écrire et ajuster l'équation de la réaction.
2. À quelle concentration en masse d'eau oxygénée correspond l'indication « 10 volumes » ?
Donnée
- Volume molaire : V_m = 24{,}0 L·mol-1
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BSynthèse du paracétamol
✔ RAI/ANA : Construire un raisonnement
Une des voies possible pour synthétiser le paracétamol est d'effectuer la réaction suivante :
1. Vérifier que l'équation de la réaction est ajustée.
2. Quelle masse de paracétamol peut-on obtenir à partir de 100 g de para-aminophénol ?
Une des voies possible pour synthétiser le paracétamol est d'effectuer la réaction suivante :
| \mathrm{C}_{6} \mathrm{H}_{7} \mathrm{NO} | + | \mathrm{C}_{4} \mathrm{H}_{6} \mathrm{O}_{3} | \rightarrow | \mathrm{C}_{8} \mathrm{H}_{9} \mathrm{NO}_{2} | + | \mathrm{C}_{2} \mathrm{H}_{4} \mathrm{O}_{2} |
| para-aminophénol | anhydride acétique | paracétamol | acide acétique |
1. Vérifier que l'équation de la réaction est ajustée.
2. Quelle masse de paracétamol peut-on obtenir à partir de 100 g de para-aminophénol ?
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

