Chapitre 3
Problèmes à résoudre
Évolution d'un système chimique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
36L'acide acétique
✔ RAI/ANA : Construire un chemin de résolution
L'acide acétique de formule brute \text{C}_2\text{H}_4\text{O}_2 est le principal élément chimique responsable de l'acidité d'un vinaigre. La réaction de cet acide avec l'eau conduit à deux produits, l'ion acétate \text{C}_2\text{H}_3\text{O}^-_2 et l'ion oxonium \text{H}_3\text{O}^+. On introduit une masse de 3,8 \times 10-1 g d'acide acétique glacial (pur à 96 %) dans 1 L d'eau. La mesure du pH avec une sonde pH-métrique indique une valeur de 3,5.
La réaction de cet acide avec l'eau est-elle totale ? Justifier en dressant un tableau d'avancement de la réaction.
L'acide acétique de formule brute \text{C}_2\text{H}_4\text{O}_2 est le principal élément chimique responsable de l'acidité d'un vinaigre. La réaction de cet acide avec l'eau conduit à deux produits, l'ion acétate \text{C}_2\text{H}_3\text{O}^-_2 et l'ion oxonium \text{H}_3\text{O}^+. On introduit une masse de 3,8 \times 10-1 g d'acide acétique glacial (pur à 96 %) dans 1 L d'eau. La mesure du pH avec une sonde pH-métrique indique une valeur de 3,5.
La réaction de cet acide avec l'eau est-elle totale ? Justifier en dressant un tableau d'avancement de la réaction.
Cliquez pour accéder à une zone de dessin
Le pH d'une solution


Le pH indique le niveau d'acidité ou de basicité d'une solution. La mesure du pH permet de connaître la concentration de la solution en ions oxonium \text{H}_3\text{O}^+, le lien entre les deux grandeurs étant donné par la relation : [\text{H}_3\text{O}^+] = 10-pH mol·L-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
37Chimie verte : recyclage du CO2
✔ RAI/MOD : Modéliser une transformation
En 2011, le CEA met au point un nouveau procédé pour la valorisation du \text{CO}_{2}. Il s'agit de produire des formamides, jusqu'ici issus de dérivés du pétrole.


1. En quoi la synthèse proposée dans le doc. 2 répond-elle aux contraintes de la chimie verte ?
2. Quels intérêts peut-il y avoir à valoriser ainsi le \text{CO}_2 ?
3. On étudie le cas de la formation d'un formamide particulier, le \text{N}{,}\text{N}-diéthylformamide de formule \text{HCO}\text{\textendash} \text{N}(\text{C}_{2} \text{H}_{5})_{2}. Donner la formule de l'amine permettant sa formation.
4. Quelles masses d'amine et de \text{CO}_2 seront nécessaires à la production de 750 kg de formamide ?
En 2011, le CEA met au point un nouveau procédé pour la valorisation du \text{CO}_{2}. Il s'agit de produire des formamides, jusqu'ici issus de dérivés du pétrole.


1. En quoi la synthèse proposée dans le doc. 2 répond-elle aux contraintes de la chimie verte ?
2. Quels intérêts peut-il y avoir à valoriser ainsi le \text{CO}_2 ?
3. On étudie le cas de la formation d'un formamide particulier, le \text{N}{,}\text{N}-diéthylformamide de formule \text{HCO}\text{\textendash} \text{N}(\text{C}_{2} \text{H}_{5})_{2}. Donner la formule de l'amine permettant sa formation.
4. Quelles masses d'amine et de \text{CO}_2 seront nécessaires à la production de 750 kg de formamide ?
Données
Doc. 1
Définitions
Doc. 2
Synthèse des formadides

R : groupement alkyle de type -(\text{C}_{n} \text{H}_{2 n+1}). On suppose le silane
en excès.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
C Lavoisier et la composition de l'air
✔ VAL : Analyser un résultat numérique
En 1775, Lavoisier a mis en évidence que l'air était un mélange de gaz et qu'il contenait du dioxygène (air dit « respirable »). Il a fait bouillir 122 g de mercure Hg dans une cornue reliée à une cloche contenant 0,80 L d'air (doc 1). Douze jours plus tard, le mercure se recouvre d'une couche rouge (c'est de l'oxyde de mercure de formule HgO, il en a obtenu 2,38 g) et le volume d'air a diminué de 0,14 L.
1. On sait aujourd'hui que le dioxygène compose 21 % de l'air que nous respirons. Comparer avec les résultats de l'expérience de Lavoisier.
2. À partir des documents fournis et en menant un raisonnement adapté, déterminer par le calcul la masse d'oxyde de mercure attendue.
3. Comparer avec la valeur obtenue par Lavoisier.
En 1775, Lavoisier a mis en évidence que l'air était un mélange de gaz et qu'il contenait du dioxygène (air dit « respirable »). Il a fait bouillir 122 g de mercure Hg dans une cornue reliée à une cloche contenant 0,80 L d'air (doc 1). Douze jours plus tard, le mercure se recouvre d'une couche rouge (c'est de l'oxyde de mercure de formule HgO, il en a obtenu 2,38 g) et le volume d'air a diminué de 0,14 L.
1. On sait aujourd'hui que le dioxygène compose 21 % de l'air que nous respirons. Comparer avec les résultats de l'expérience de Lavoisier.
2. À partir des documents fournis et en menant un raisonnement adapté, déterminer par le calcul la masse d'oxyde de mercure attendue.
3. Comparer avec la valeur obtenue par Lavoisier.
Données
Doc. 1
Expérience de Lavoisier (1775)

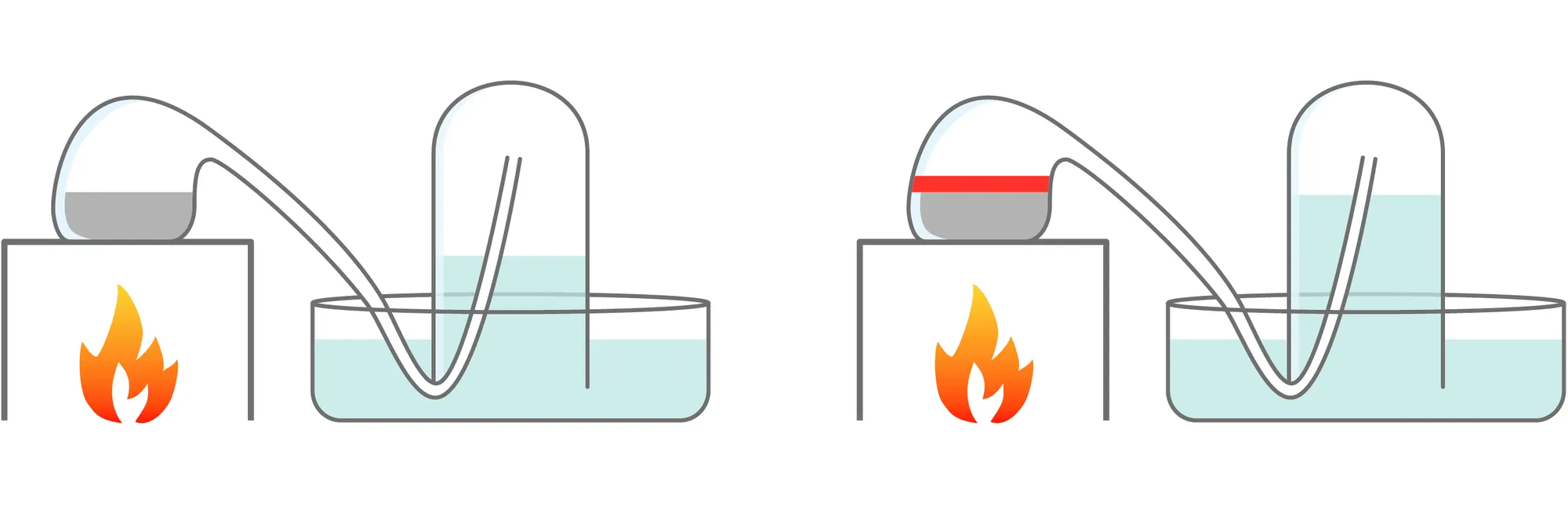
Doc. 2
Calcul d'une erreur relative
\text{Erreur relative} \, = \dfrac{\mid \text{Valeur}_{\text{theorique}}-\text{Valeur}_{\text{experimentale}}\mid}{\text{Valeur}_{\text{theorique}}}
Si l'erreur relative est inférieure à 0,05, on considère que la valeur obtenue est en accord avec la théorie.
Si l'erreur relative est inférieure à 0,05, on considère que la valeur obtenue est en accord avec la théorie.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
DLes gaz peuvent être invisibles !
✔ RAI/MOD : Modéliser une transformation
À la lueur d'une flamme, la bougie semble disparaître. Mais qu'en est-il vraiment ? L'acide stéarique est le principal constituant de la cire qui brûle selon :
\text{C}_{18}\text{H}_{36}\text{O}_2\text{(g)}+26\,\text{O}_2\text{(g)}\rightarrow 18\,\text{CO}_2\text{(g)}+18\,\text{H}_2\text{O(g)}
1. Quel est selon vous le réactif limitant ? Justifier.
2. Quel volume de dioxygène est nécessaire à la combustion d'une bougie de 50 g ?
3. La cire disparaît-elle comme par magie ? Expliquer.
À la lueur d'une flamme, la bougie semble disparaître. Mais qu'en est-il vraiment ? L'acide stéarique est le principal constituant de la cire qui brûle selon :
\text{C}_{18}\text{H}_{36}\text{O}_2\text{(g)}+26\,\text{O}_2\text{(g)}\rightarrow 18\,\text{CO}_2\text{(g)}+18\,\text{H}_2\text{O(g)}
1. Quel est selon vous le réactif limitant ? Justifier.
2. Quel volume de dioxygène est nécessaire à la combustion d'une bougie de 50 g ?
3. La cire disparaît-elle comme par magie ? Expliquer.
Données

Flamme de bougie et ses différentes zones
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retour sur la problématique du chapitre
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
38Les diamants de Lavoisier
✔ RAI/MOD : Modéliser une transformationMême les diamants ne sont pas éternels ! En 1772, Lavoisier réussit à faire disparaître des diamants (constitué d'atomes de carbone) en les amenant à très haute température grâce à une grande lentille concentrant la lumière du Soleil.
1. Quelle réaction peut être à l'origine de cette disparition des diamants à haute température ?
2. En s'appuyant sur cet exemple, justifier qu'en chimie rien ne disparaît jamais vraiment.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

