Chapitre 6
Activité 2 - Activité expérimentale
80 min
Géométrie des molécules
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
Le modèle de Lewis permet de modéliser l'enchaînement des atomes au sein d'une entité chimique, moléculaire ou ionique, mais ne donne aucune information sur la géométrie spatiale de ces entités chimiques.
Comment prévoir la géométrie spatiale des entités chimiques ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Quelles propriétés microscopiques influencent la géométrie des molécules ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 Représentation de Lewis de molécules simples
| Eau | Dioxyde de carbone |
|---|---|
 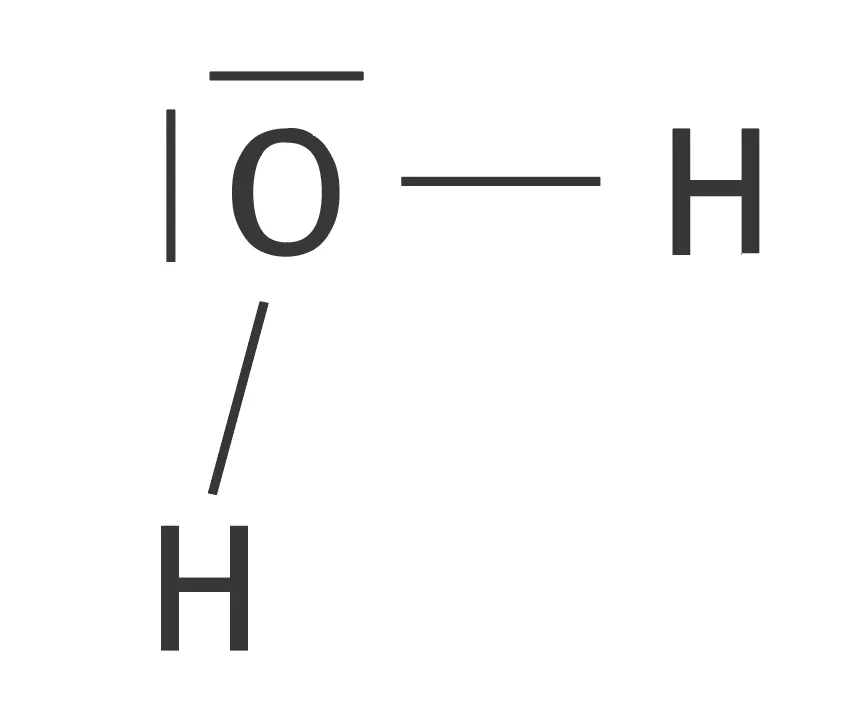 |  |
| Méthane | Amoniaque |
 |
 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Matériel nécessaire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retrouvez « Mirage géométrie des molécules » disponible sur smartphone et tablette en ligne.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3 Répulsion des paires électroniques de la couche de valence ou méthode VSEPR
La méthode VSEPR (sigle de l'anglais valence shell electron pair repulsion - en français RPECV : répulsion des paires électroniques de la couche de valence) s'inscrit dans la poursuite des idées sur les liaisons chimiques de Lewis.
Cette méthode est destinée à prédire la géométrie des entités chimiques (molécules ou ions) en se basant sur les hypothèses suivantes :
Cette méthode est destinée à prédire la géométrie des entités chimiques (molécules ou ions) en se basant sur les hypothèses suivantes :
- les électrons des doublets liants et des doublets non liants exercent les uns sur les autres des forces électrostatiques répulsives ;
- les doublets (liants et non liants) sont donc disposés autour de chaque atome de façon à minimiser les valeurs de ces forces.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
APP : Faire un brouillon comprenant un schéma et des notions
RAI/MOD : Respecter les conventions en chimie
RAI/MOD : Respecter les conventions en chimie
1. Comparer les géométries des molécules d'eau et de dioxyde de carbone. Proposer pour chaque molécule le qualitatif le plus approprié entre : linéaire et coudée.
2. Comparer les géométries des molécules d'ammoniac et de méthane. Proposer pour chacune d'entre elles un qualifi catif rendant compte de la géométrie observée : tétraédrique ou pyramidale.
3. Expliquer, sur l'exemple de la molécule de dioxyde de carbone, comment la répulsion des paires électroniques de la couche de valence peut permettre de prévoir la géométrie de cette molécule.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
En se basant sur la méthode VSEPR, expliquer le passage de la représentation de Lewis d'une molécule à la modélisation de sa géométrie dans l'espace. Rendre compte des propositions sous la forme d'une carte mentale. Vous pouvez utiliser l'application gratuite .
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

