Chapitre 8
Activité 4 - Activité expérimentale
80 min
Choisir le bon solvant
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
Un élève a versé par inadvertance une solution aqueuse de diiode dans un
erlenmeyer contenant une solution de sulfate de cuivre (II).
Comment extraire le diiode de ce mélange ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Est-il possible de
récupérer la solution
de diiode d'origine ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 Utilisation de l'ampoule à décanter
Pour réaliser une extraction liquide-liquide :
- poser l'ampoule dans son support ;
- vérifier que le robinet est fermé ;
- introduire la solution dans l'ampoule à décanter ;
- ajouter le solvant extracteur et boucher l'ampoule ;
- enlever l'ampoule de son support et agiter en retournant plusieurs fois ;
- dégazer régulièrement en ouvrant le robinet, ampoule renversée ;
- poser l'ampoule sur son support ;
- enlever le bouchon et laisser décanter ;
- ouvrir doucement le robinet et faire couler la première phase (la plus dense) dans un bécher ;
- récupérer la deuxième phase dans un autre bécher.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Matériel nécessaire
- Un flacon contenant un mélange constitué d'une solution aqueuse de sulfate de cuivre (II) (c = 0,10 mol·L-1) et du diiode dissous ;
- Une ampoule à décanter sur son support et un bouchon ;
- Un flacon de cyclohexane et un flacon d'acétone ;
- Un flacon d'éther ;
- Une pissette d'eau distillée ;
- Des béchers de 50 mL et une pipette simple.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retrouvez pour comprendre la polarité des molécules.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
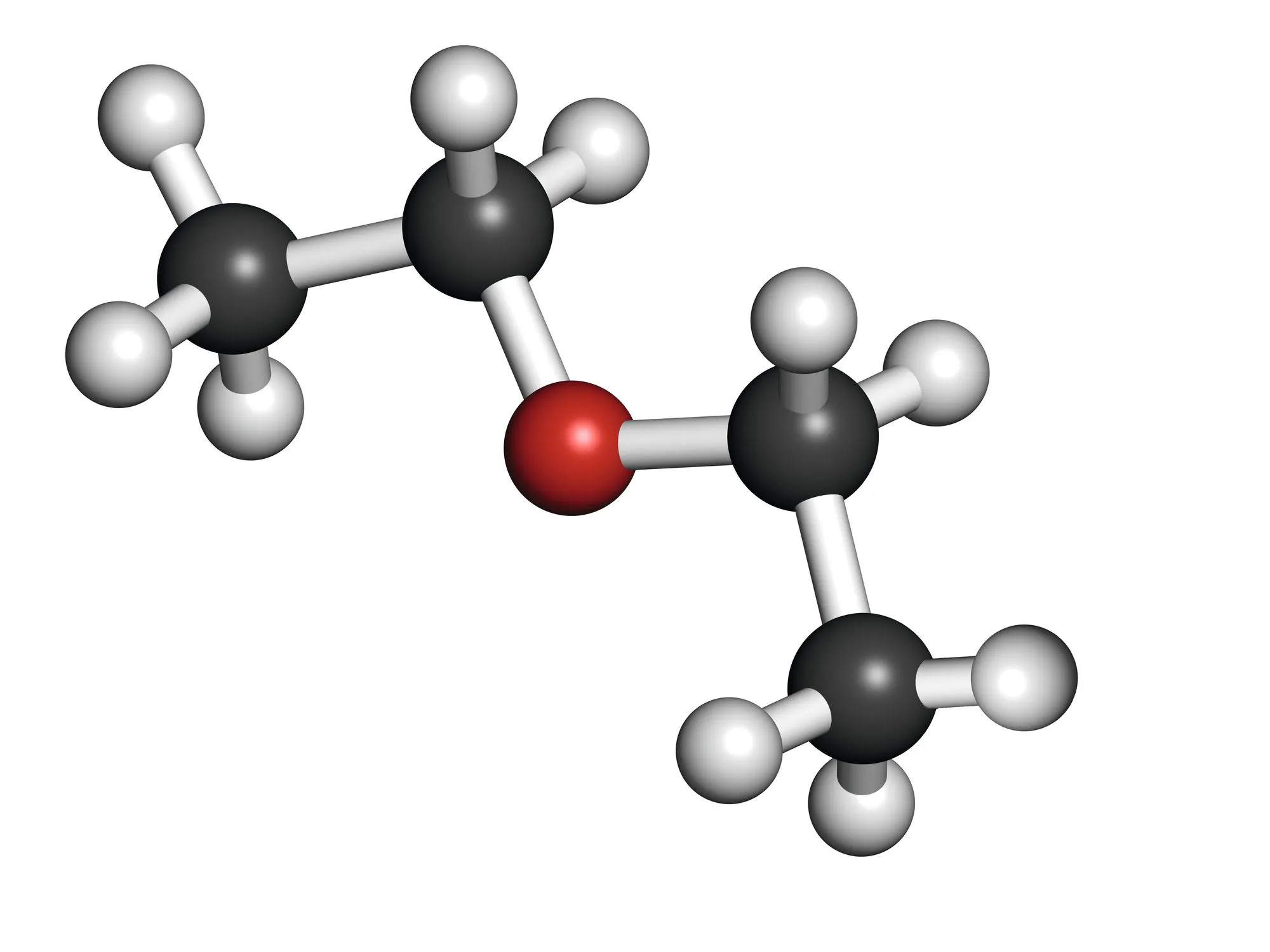
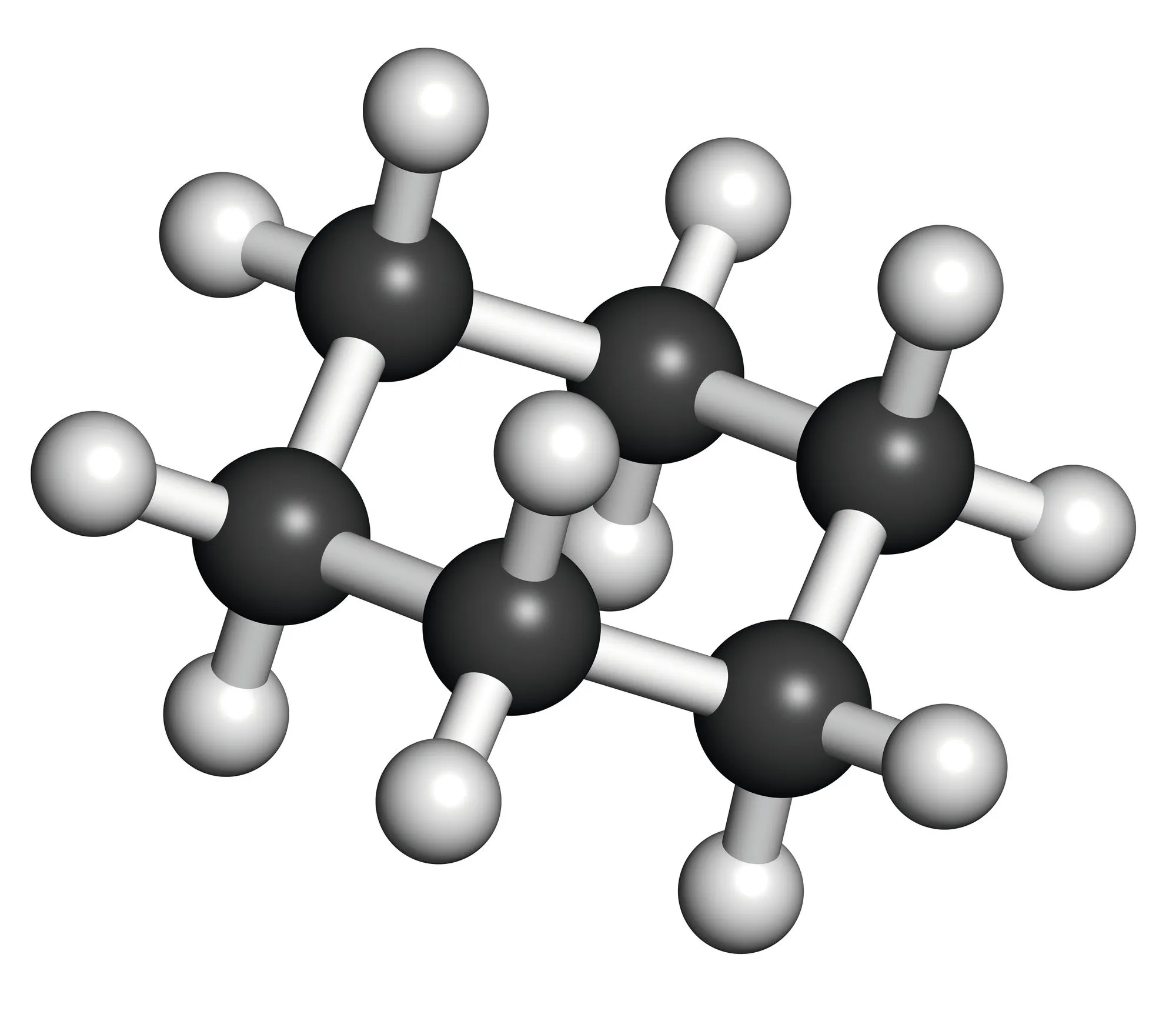
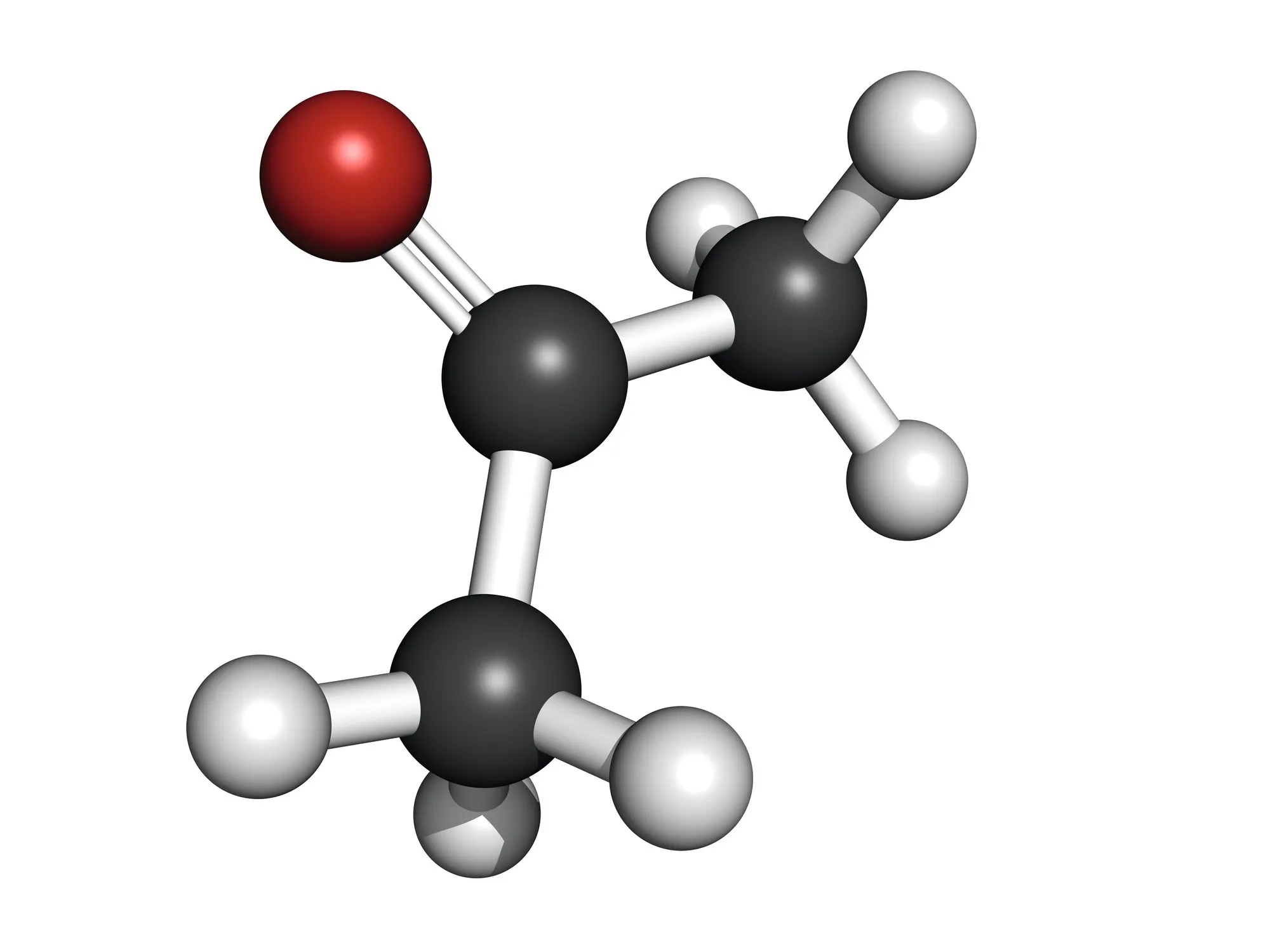
Doc. 3 Modèles moléculaires
  |   |
|---|---|
  |
 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
| Solvant | Eau | Cyclohexane | Acétone | Éther |
| Solubilité du diiode I2 | 330 mg·L-1 | 2,7 g·L-1 | / | 25,2 g·L-1 |
| Solubilité du sulfate de cuivre (II) CuSO4 | Totale | Nulle | Nulle | Nulle |
| Densité | 1,00 | 0,78 | 0,78 | 0,71 |
| Miscibilité avec l'eau | / | Aucune | Totale | Partielle |
| Pictogrammes |
    |
  |
  |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
REA : Mettre en œuvre
un protocole
2. Doc. 1 Réaliser cette extraction après validation du solvant choisi par le professeur.
3. Doc. 3 Étudier la polarité des molécules en jeu (voir électronégativités, ).
4. Étudier les interactions entre les molécules du soluté et celles des différents solvants. L'analyse faite est-elle en accord avec le solvant choisi à la question 1. ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
Comment choisir un solvant extracteur ?
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

