Chapitre 7
Cours
Interpréter les propriétés d'une espèce chimique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Cohésion dans un solide
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ALa cohésion d'un composé solide ionique
Un solide ionique est une structure solide, constituée d'un empilement
compact et régulier de cations (ions chargés positivement) et
d'anions (ions chargés négativement) en proportions invariables.
La cohésion (stabilité) du solide ionique est assurée par les interactions
électriques entre les cations et les anions.
Deux corps qui portent des charges de même signe se repoussent.
Deux corps qui portent des charges de signe opposé s'attirent.
Au sein du solide ionique, les cations se repoussent, les anions se repoussent, et les cations et anions s'attirent. Les distances entre cations et anions étant plus petites qu'entre deux cations ou deux anions, les interactions attractives sont plus intenses que les interactions répulsives, ce qui rend le solide cohérent, avec des ions collés les uns aux autres.
Le solide ionique est électriquement neutre : il contient autant de charges positives que de charges négatives.
La formule statistique d'un solide ionique rend compte des proportions de cations et d'anions dans le solide, en indiquant d'abord le symbole du cation, puis celui de l'anion, sans la charge électrique.
Deux corps qui portent des charges de même signe se repoussent.
Deux corps qui portent des charges de signe opposé s'attirent.
Au sein du solide ionique, les cations se repoussent, les anions se repoussent, et les cations et anions s'attirent. Les distances entre cations et anions étant plus petites qu'entre deux cations ou deux anions, les interactions attractives sont plus intenses que les interactions répulsives, ce qui rend le solide cohérent, avec des ions collés les uns aux autres.
Le solide ionique est électriquement neutre : il contient autant de charges positives que de charges négatives.
La formule statistique d'un solide ionique rend compte des proportions de cations et d'anions dans le solide, en indiquant d'abord le symbole du cation, puis celui de l'anion, sans la charge électrique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 Représentation dans l'espace

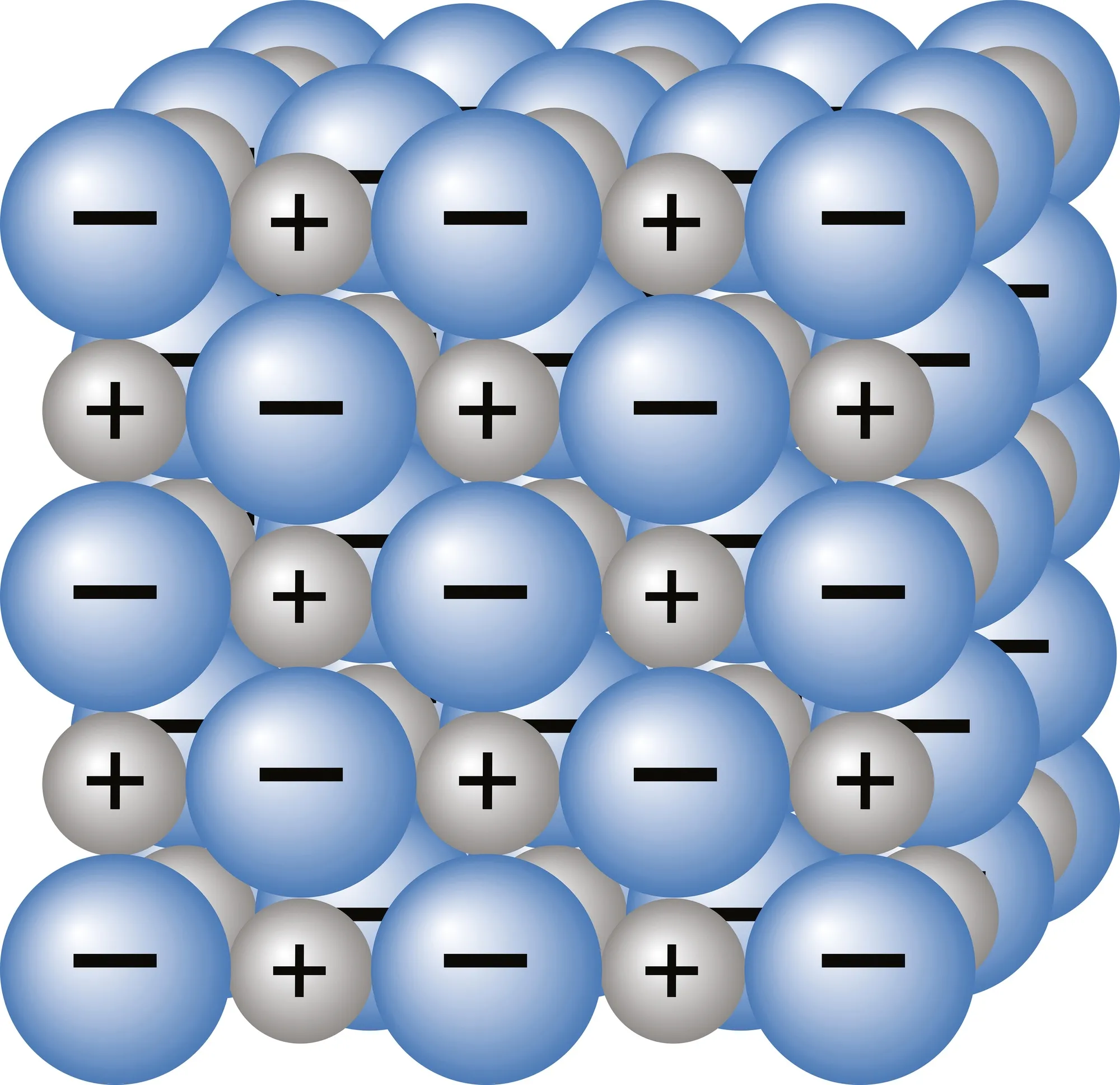
Dans le solide
ionique, les
cations sont
entourés
d'anions, et les
anions sont
entourés de
cations
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Attention, la proportion entre le nombre de cations et le nombre d'anions dépend de leurs charges : ils ne sont pas toujours en nombre égal.
- Le solide ionique étant électriquement neutre, on n'écrit pas de charge électrique même s'il est constitué d'ions.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- La formule statistique traduit la proportion des ions, mais non leur nombre. Un cristal ionique contient des milliards de milliards d'ions.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BLa cohésion d'un composé solide
moléculaire
Le solide moléculaire est constitué d'un empilement compact et
régulier de molécules.
La cohésion des solides moléculaires est assurée par des interactions électrostatiques appelées interactions de Van der Waals. Parfois, des liaisons hydrogène s'ajoutent.
Il existe plusieurs types de forces de Van der Waals :
La cohésion des solides moléculaires est assurée par des interactions électrostatiques appelées interactions de Van der Waals. Parfois, des liaisons hydrogène s'ajoutent.
Il existe plusieurs types de forces de Van der Waals :
- les interactions entre molécules polaires : les zones qui portent des charges partielles opposées s'attirent ;
- les interactions entre molécules apolaires : le nuage électronique fluctue en permanence, à un instant t, une molécule possède une zone chargée positivement et une autre zone chargée négativement. Il peut donc y avoir des interactions électrostatiques entre la zone + d'une molécule et la zone - d'une autre molécule proche.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Dans un solide, les entités ne sont pas parfaitement immobiles, elles vibrent autour d'une position.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Cohésion : interaction qui maintient les atomes, les molécules, les ions « collés » les uns aux autres.
- Pont hydrogène (ou liaison hydrogène) : interaction électrostatique faible entre un atome d'hydrogène portant une charge partielle positive et un atome très électronégatif (\text{O}, \text{N}, \text{Cl}, etc.).

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Dissolution des solides ioniques
dans l'eau
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ALes interactions entre l'eau et les ions
La molécule d'eau est polaire et peut interagir avec les ions du
solide ionique. Ces interactions entre l'eau et les ions permettent
d'expliquer la dissolution d'un solide ionique dans l'eau.
Lorsqu'on dissout un solide ionique dans l'eau, on obtient une solution aqueuse contenant des ions qui se combinent avec les molécules d'eau qui les entourent (doc. 2).
La dissolution d'un solide ionique se déroule en trois étapes :
Lorsqu'on dissout un solide ionique dans l'eau, on obtient une solution aqueuse contenant des ions qui se combinent avec les molécules d'eau qui les entourent (doc. 2).
La dissolution d'un solide ionique se déroule en trois étapes :
- la dissociation du solide ionique : les molécules d'eau s'approchent du solide et fragilisent les interactions électrostatiques qui existent entre les cations et les anions, qui se rompent ;
- la solvatation : les molécules d'eau entourent les ions : on dit qu'ils sont solvatés ou hydratés ;
- la dispersion : les ions solvatés s'éloignent du solide et se dispersent parmi les molécules d'eau.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Solvatation d'une espèce par l'eau

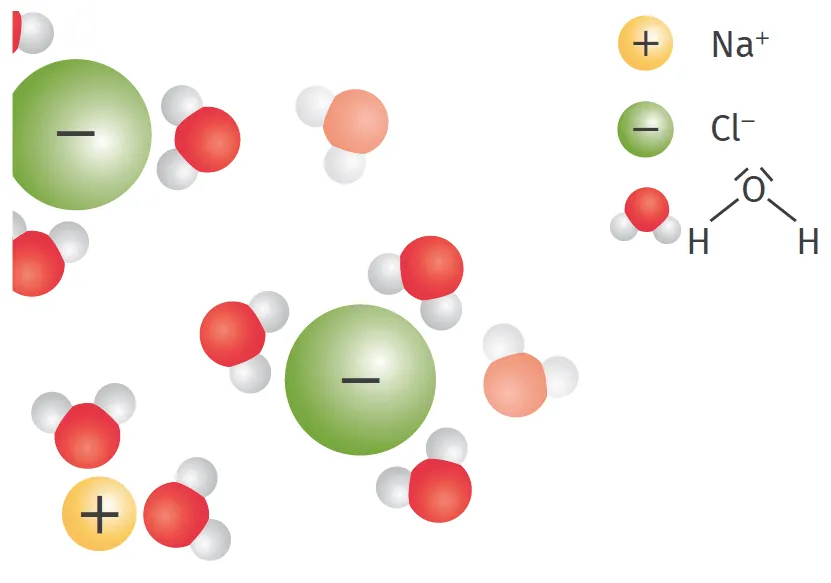
Les molécules de solvant entourent les ions avec la zone portant une charge opposée à
celle de l'ion.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Attention à ne pas confondre dissolution d'un solide ionique et fusion (passage de l'état solide à l'état liquide).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BLa modélisation au niveau macroscopique
La dissolution d'un solide ionique \text{A}_{\text{x}}\text{B}_{\text{y}} se modélise, au niveau
macroscopique, par une équation de réaction.
L'équation de dissolution d'un solide ionique \text{A}_{\text{x}}\text{B}_{\text{y}} dans l'eau s'écrit :
Le symbole (\text{s}) signifie que le solide ionique est à l'état solide. Le cation \text{A}^{\text{m}+} et l'anion \text{B}^{\text{n}-} sont solvatés, on l'indique en écrivant (\text{aq}). L'équation de la réaction est équilibrée en charge. La neutralité de la solution est donc respectée.
L'équation de dissolution d'un solide ionique \text{A}_{\text{x}}\text{B}_{\text{y}} dans l'eau s'écrit :
\text{A}_{\text{x}} \text{B}_{\text{y}}(\text{s}) \stackrel{\text {eau }}{\longrightarrow} x \text{A}^{\text{m}+}(\text{aq})+y\, \text{B}^{\text{n}-}(\text{aq}).
Le symbole (\text{s}) signifie que le solide ionique est à l'état solide. Le cation \text{A}^{\text{m}+} et l'anion \text{B}^{\text{n}-} sont solvatés, on l'indique en écrivant (\text{aq}). L'équation de la réaction est équilibrée en charge. La neutralité de la solution est donc respectée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3 Mise en équation
L'équation de dissolution du chlorure de sodium dans l'eau s'écrit :
L'équation de dissolution de l'iodure de fer s'écrit :
\mathrm{NaCl}(\mathrm{s}) \stackrel{\mathrm{eau}}{\longrightarrow} \mathrm{Na}^{+}(\mathrm{aq})+\mathrm{Cl}^{-}(\mathrm{aq}).
L'équation de dissolution de l'iodure de fer s'écrit :
\mathrm{FeI}_{2}(\mathrm{s}) \stackrel{\mathrm{eau}}{\longrightarrow} \mathrm{Fe}^{2+}(\mathrm{aq})+2\, \mathrm{I}^{-}(\mathrm{aq}).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- L'équation de dissolution et l'équation de formation
du solide ionique traduisent deux sens inverses
d'une transformation. Par exemple : l'équation de
dissolution du chlorure d'argent s'écrit :
\operatorname{Agcl}(\mathrm{s}) \stackrel{\mathrm{eau}}{\longrightarrow} \mathrm{Ag}^{+}(\mathrm{aq})+\mathrm{Cl}^{-}(\mathrm{aq}).
L'équation de la formation du précipité de chlorure d'argent s'écrit : \mathrm{Ag}^{+}(\mathrm{aq})+\mathrm{Cl}^{-}(\mathrm{aq}) \rightarrow \mathrm{AgCl}(\mathrm{s}).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CLa modélisation au niveau macroscopique
La concentration c en soluté apporté (en mol·L-1) d'une solution est
définie par :
avec n : quantité de soluté (mol) ; c : concentration en soluté apporté (mol·L-1) ; V : volume de la solution (L).
La concentration des ions \mathrm{A}^{+} dans la solution est notée [\mathrm{A}^{+}].
Exemple : dans la solution d'iodure de fer (II) de concentration en soluté apporté c, [\mathrm{Fe}^{2+}]=c et [\text{I}^{-}]=2 c.
Le tableau d'évolution du système permet de le vérifier :

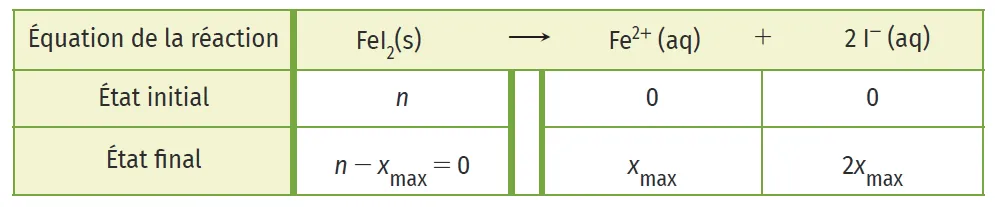
Car [\mathrm{Fe}^{2+}]=\dfrac{x_{\max }}{V} = c et [\text{I}^{-}]=\dfrac{n(\text{I}^{-})}{V}=\dfrac{2 x_{\max }}{V}=2 c.
c = \dfrac{n}{V}
avec n : quantité de soluté (mol) ; c : concentration en soluté apporté (mol·L-1) ; V : volume de la solution (L).
La concentration des ions \mathrm{A}^{+} dans la solution est notée [\mathrm{A}^{+}].
Exemple : dans la solution d'iodure de fer (II) de concentration en soluté apporté c, [\mathrm{Fe}^{2+}]=c et [\text{I}^{-}]=2 c.
Le tableau d'évolution du système permet de le vérifier :


Car [\mathrm{Fe}^{2+}]=\dfrac{x_{\max }}{V} = c et [\text{I}^{-}]=\dfrac{n(\text{I}^{-})}{V}=\dfrac{2 x_{\max }}{V}=2 c.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4 Différentes
concentrations d'ions en solution


Solutions de permanganate de
potassium à des concentrations différentes.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Extraction par un solvant
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ASolubilité dans un solvant
La solubilité d'un soluté dans un solvant traduit sa capacité à se
dissoudre dans ce solvant.
La solubilité, notée s (exprimée en g·L-1), d'une espèce chimique (solide, liquide ou gaz) correspond à la masse maximale de cette espèce que l'on peut dissoudre dans un litre de solvant, généralement de l'eau.
La solubilité dépend de la température et de la nature du solvant, car elle est liée aux interactions, au niveau microscopique entre le soluté (molécule, ion, atome) et le solvant : plus les interactions sont nombreuses et plus le soluté est soluble dans le solvant.
Une espèce chimique peut être insoluble dans un solvant : dans ce cas, le soluté ne se dissout pas.
La solubilité, notée s (exprimée en g·L-1), d'une espèce chimique (solide, liquide ou gaz) correspond à la masse maximale de cette espèce que l'on peut dissoudre dans un litre de solvant, généralement de l'eau.
La solubilité dépend de la température et de la nature du solvant, car elle est liée aux interactions, au niveau microscopique entre le soluté (molécule, ion, atome) et le solvant : plus les interactions sont nombreuses et plus le soluté est soluble dans le solvant.
Une espèce chimique peut être insoluble dans un solvant : dans ce cas, le soluté ne se dissout pas.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 5 Interactions soluté/solvant
Les interactions entre le soluté et le solvant
sont de plusieurs types :
- interactions entre ions et molécules polaires (ex. : le sel dans l'eau) ;
- interaction entre molécules polaires (ex. : le glucose dans l'eau) ;
- interaction entre molécules apolaires (ex. : le diiode dans le cyclohexane) ;
- formation de ponts hydrogène entre le soluté et le solvant (ex. : l'éthanol dans l'eau).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BMiscibilité de deux liquides
Lorsqu'un soluté est liquide, il peut être soluble dans un solvant,
en toutes proportions. Dans ce cas, on dit que les deux liquides sont
miscibles.
Des liquides sont miscibles lorsqu'ils se mélangent l'un avec l'autre pour former un mélange homogène.
Des liquides sont miscibles lorsqu'ils se mélangent l'un avec l'autre pour former un mélange homogène.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- La solubilité correspond à la concentration en g·L-1 (ou en mol·L-1) du soluté dans la solution saturée, c'est-à-dire une solution dans laquelle la concentration en soluté est maximale.
- Ne pas confondre miscibilité et solubilité.
La solubilité concerne un soluté qui se dissout plus ou moins dans un solvant.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CExtraction par un solvant
L'extraction par un solvant (extraction liquide-liquide) est une technique
expérimentale qui permet d'extraire une espèce dissoute dans
une solution.
Le choix du solvant extracteur est lié à ses propriétés physiques :
Pour réaliser l'extraction par solvant, on utilise une ampoule à décanter.

Le choix du solvant extracteur est lié à ses propriétés physiques :
- le soluté doit être plus soluble dans le solvant extracteur que dans le solvant initial ;
- le solvant extracteur ne doit pas être miscible avec le solvant initial.
Pour réaliser l'extraction par solvant, on utilise une ampoule à décanter.
➜ Voir

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retrouvez une sur l'extraction liquide-liquide !
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Solvant initial : liquide dans lequel se trouve l'espèce dissoute à extraire.
- Solvant extracteur : liquide utilisé pour extraire une espèce dissoute dans un autre liquide.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Le solvant extracteur est plus ou moins dense que
le solvant initial : il se place donc au-dessous ou
au-dessus du solvant initial, selon sa densité.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

