Chapitre 7
Exercice corrigé
Séparer des espèces mélangées
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Énoncé
Compétence(s)
RAI/ANA : Construire un raisonnement : communiquer sur les étapes
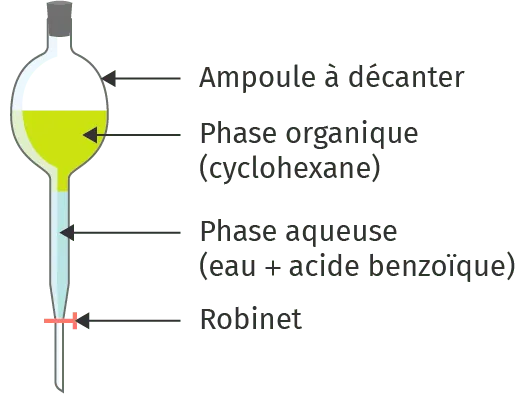
1. Combien de phases ce bidon contient-il ? Quelle est la composition de chacune de ces phases ?
Le technicien verse le mélange dans une ampoule à décanter.
2. Quelle est la position de chacune des phases ?
3. Comment le technicien va-t-il récupérer le solvant organique ? Que contient alors le bidon envoyé à l'entreprise ?
Données
| Espèce chimique | Température de fusion \theta_\text{f} | Température d'ébullition \theta_{\text{éb}} | Densité d |
| Eau | 0 °C | 100 °C | 1,00 |
| Acide benzoïque | 122 °C | 250 °C | 1,27 |
| Cyclohexane | 6,5 °C | 81 °C | 0,78 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Données
- L'acide benzoïque est soluble dans l'eau (s = 2,9 g·L-1 à 20 °C) mais n'est pas soluble dans le cyclohexane.
- L'eau et le cyclohexane ne sont pas miscibles.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Analyse de l'énoncé
1.
L'analyse de la solubilité d'une espèce
chimique dans les solvants (eau/
cyclohexane) permet de savoir dans
quelle phase elle se trouve. Pour savoir
combien il y a de phases, il faut analyser
la miscibilité des liquides entre eux.
2. La position des phases l'une par rapport à l'autre dépend de leur densité.
3. L'ampoule à décanter permet de récupérer séparément chacune des phases : la plus dense coule en premier, la moins dense est récupérée ensuite.
2. La position des phases l'une par rapport à l'autre dépend de leur densité.
3. L'ampoule à décanter permet de récupérer séparément chacune des phases : la plus dense coule en premier, la moins dense est récupérée ensuite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Solution rédigée
1. L'acide benzoïque est dissous dans l'eau car il y est très soluble,
mais insoluble dans le cyclohexane. Il peut rester des traces
d'acide benzoïque à l'état solide (cela dépend de la masse d'acide
introduite). Le mélange est constitué de deux liquides : l'eau et le
cyclohexane. Ces deux liquides ne sont pas miscibles entre eux :
le mélange est donc constitué de deux phases liquides.
2. L'eau (d = 1,00) est plus dense que le cyclohexane (d = 0,78) : la phase aqueuse se trouve sous la phase organique.
2. L'eau (d = 1,00) est plus dense que le cyclohexane (d = 0,78) : la phase aqueuse se trouve sous la phase organique.
3. Le technicien va faire couler
la phase aqueuse inférieure,
et la placer dans un premier
récipient. Ensuite, il va récupérer
la deuxième phase qui
contient le cyclohexane et la
placer dans le bidon de récupération.
Le bidon contient
donc du cyclohexane.



Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour bien répondre
2.
Justifier la réponse en comparant les
densités.
3. Un schéma de l'ampoule à décanter n'est pas exigé mais il est bienvenu pour cette explication.
3. Un schéma de l'ampoule à décanter n'est pas exigé mais il est bienvenu pour cette explication.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20Mise en application
Comment extraire le butan-1-ol d'un mélange contenant de
l'eau (d = 1,00) et du butan-1-ol (d = 0,80) ? On dispose de
trois solvants : eau, éther et éthanol.Données
- L'eau et l'éther sont peu miscibles entre eux.
- L'eau et l'éthanol sont miscibles en toute proportion.
- Solubilité du butan-1-ol : dans l'eau : s = 77 g·L-1 ; complète dans l'éther et l'éthanol.
- Densité de l'éther : d = 0,71.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

