Chapitre 7
Exercices
Pour aller plus loin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30Proposition de protocole
Mayonnaise maison
✔ COM : Compte rendu écrit avec un vocabulaire rigoureux
La lécithine est un émulsifiant présent notamment dans le jaune d'œuf. C'est une protéine qui possède une partie hydrophile et une partie hydrophobe : c'est donc une molécule amphiphile ou tensioactif. Cette expérience permet de montrer le rôle de la lécithine dans l'élaboration d'une mayonnaise.


Première étape :
Dans un tube à essai, introduire 2 mL d'eau distillée et 2 mL d'huile de tournesol. Boucher, agiter, et attendre quelques minutes.

Dans un tube à essai, introduire 2 mL d'eau distillée et 2 mL d'huile de tournesol. Boucher, agiter, et attendre quelques minutes.

Deuxième étape :
Dans le tube à essai, ajouter à l'aide d'une pipette simple quelques gouttes de jaune d'œuf. Boucher, agiter, et attendre quelques minutes.

Dans le tube à essai, ajouter à l'aide d'une pipette simple quelques gouttes de jaune d'œuf. Boucher, agiter, et attendre quelques minutes.

1. Quelle information peut-on tirer de l'expérience réalisée à la première étape ?
2. En étudiant les résultats de la deuxième étape, quelle modification est apportée par l'ajout du tensioactif ?
3. Une vinaigrette est constituée d'un mélange d'huile et de vinaigre (eau + acide acétique dissous). La vinaigrette est-elle stable ? Justifier.
4. Pourquoi une mayonnaise avec du jaune d'œuf est-elle plus stable ?
2. En étudiant les résultats de la deuxième étape, quelle modification est apportée par l'ajout du tensioactif ?
3. Une vinaigrette est constituée d'un mélange d'huile et de vinaigre (eau + acide acétique dissous). La vinaigrette est-elle stable ? Justifier.
4. Pourquoi une mayonnaise avec du jaune d'œuf est-elle plus stable ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31BacHuile essentielle de cannelle
✔ COM : Compte rendu écrit avec un vocabulaire rigoureux
L'huile essentielle (HE) de cannelle est extraite des écorces de cannelier par hydrodistillation. Elle est utilisée, par exemple, pour lutter contre la fatigue et les problèmes intestinaux. Elle contient notamment de l'aldéhyde cinnamique.
On réalise au laboratoire l'hydrodistillation d'un mélange contenant 400 mL d'eau et 200 g d'écorce de cannelier.
On réalise au laboratoire l'hydrodistillation d'un mélange contenant 400 mL d'eau et 200 g d'écorce de cannelier.


1. On recueille 100 mL de distillat. On ajoute 10 g de sel
et on agite. Quel est le rôle du sel ?
2. Le mélange est placé dans une ampoule à décanter. Représenter l'ampoule à décanter et préciser la composition et la position des phases.
2. Le mélange est placé dans une ampoule à décanter. Représenter l'ampoule à décanter et préciser la composition et la position des phases.
Cliquez pour accéder à une zone de dessin
3. On recueille 10 mL d'huile essentielle. Calculer la masse d'huile essentielle obtenue.
4. Pour vérifier que l'huile essentielle contient bien de l'aldéhyde cinnamique, on réalise une chromatographie sur couche mince. La CCM est reproduite ci-dessous. Son analyse permet-elle d'établir que l'huile essentielle contient de l'aldéhyde cinnamique ?
 HE : dépôt d'huile
essentielle ; AC : aldéhyde
cinnamique du commerce.
HE : dépôt d'huile
essentielle ; AC : aldéhyde
cinnamique du commerce.
5. On souhaite extraire l'aldéhyde cinnamique de l'huile essentielle. Proposer un protocole détaillé.
4. Pour vérifier que l'huile essentielle contient bien de l'aldéhyde cinnamique, on réalise une chromatographie sur couche mince. La CCM est reproduite ci-dessous. Son analyse permet-elle d'établir que l'huile essentielle contient de l'aldéhyde cinnamique ?

5. On souhaite extraire l'aldéhyde cinnamique de l'huile essentielle. Proposer un protocole détaillé.
Données
Densités de quelques liquides :
- d_{\mathrm{he}}= 1,06 ;
- d_{\text {eau}}= 1,00 ;
- d_{\text {éthanol}}= 0,79 ;
- d_{\text {chloroforme}}= 1,49.
Tableau de miscibilité
| Espèce chimique |
Eau |
Éthanol |
Chloroforme |
| Eau | / |
Oui |
Non |
| Éthanol |
Oui | / |
Oui |
|
Chloroforme |
Non |
Oui | / |
Info
Une huile essentielle est très peu soluble dans l'eau salée. L'aldéhyde cinnamique est peu soluble
dans l'eau, mais très soluble dans l'éthanol et le chloroforme.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
32Proposition de protocole
La distillation fractionnée
✔ RAI/ANA : Justifier un protocole
La distillation fractionnée permet de séparer les constituants
d'un mélange homogène liquide. Le mélange
est introduit dans un ballon, puis chauffé. Lorsque le
mélange commence à bouillir, les vapeurs du mélange
s'élèvent et circulent dans une colonne de Vigreux.
Une partie des vapeurs se liquéfient et retombent dans
le ballon. Le liquide le plus volatil s'échappe, puis est
liquéfié lorsqu'il rencontre les parois froides du réfrigérant
à eau. Il est récupéré dans une éprouvette graduée.
Pendant la distillation de ce liquide, la température,
mesurée en tête de colonne, est constante. Une fois cette
séparation terminée, la température chute brièvement,
puis augmente à nouveau, jusqu'à atteindre la température
d'ébullition de l'autre liquide.

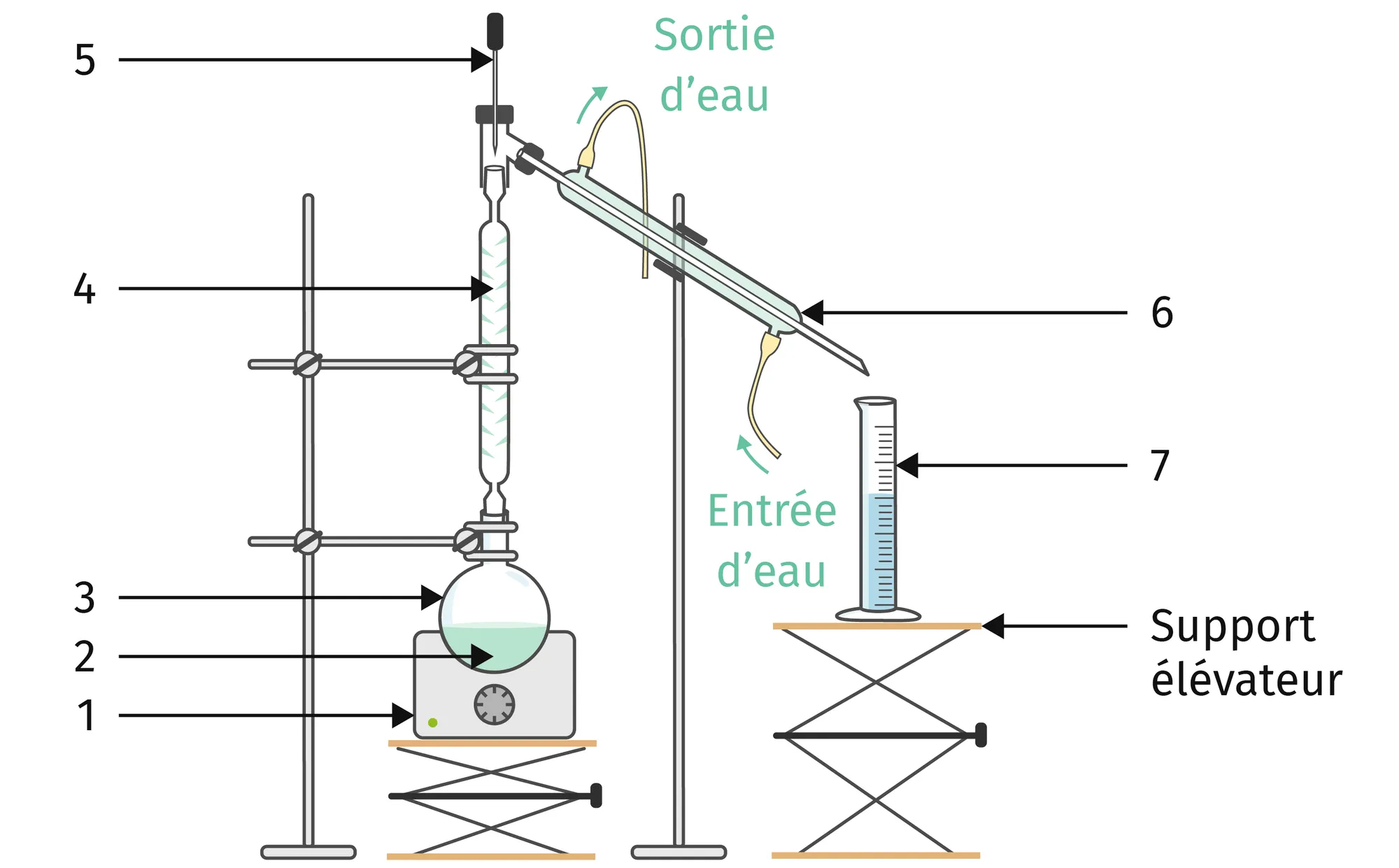
On souhaite séparer un mélange constitué de 25 mL d'eau et 10 mL d'acétone.
1. Légender le schéma de la distillation
fractionnée.
2. Quelles sont les interactions intermoléculaires (entre
molécules) et intramoléculaires (au sein des molécules)
dans l'eau puis dans l'acétone ? Ces interactions
au niveau microscopique permettent-elles d'expliquer
la différence de température d'ébullition de l'eau et
de l'acétone ?
3. Quel est le premier liquide recueilli dans l'éprouvette graduée ? Quelle est la température indiquée par le thermomètre pendant la première partie de la distillation ?
4. Pourquoi est-il plus difficile de séparer l'eau et l'éthanol par distillation ?
3. Quel est le premier liquide recueilli dans l'éprouvette graduée ? Quelle est la température indiquée par le thermomètre pendant la première partie de la distillation ?
4. Pourquoi est-il plus difficile de séparer l'eau et l'éthanol par distillation ?
Données
Température d'ébullition de :- l'eau : \theta_{\text{éb}}= 100 °C ;
- l'acétone : \theta_\text{{éb}}= 56 °C ;
- l'éthanol : \theta_{\text{éb}} = 78 °C.
- l'acétone : \theta_{\text{éb}}= 56 °C ;


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
33Histoire des sciences
La calcite
✔ RAI/ANA : Faire le lien entre le modèle microscopique et les
grandeurs macroscopiques
C'est après avoir fait tomber au sol un morceau de calcite, et intrigué par la régularité de la fracture, que René Just Haüy (1743-1822) se lance dans l'observation et l'étude des cristaux. Ses études le conduisent à conclure que les cristaux sont des composés organisés et il introduit alors la notion de molécule intégrante remplacée plus tard par le terme de maille cristalline.
La calcite pure est un solide ionique translucide et blanchâtre constitué d'ions calcium \text{Ca}^{2+}et d'ions carbonate \text{CO}_{3}^{2-}. Lorsque les eaux de pluie s'écoulent et ruissellent sur les sols riches en calcite, la calcite se dissout dans l'eau qui s'enrichit alors en ions calcium.
La calcite pure est un solide ionique translucide et blanchâtre constitué d'ions calcium \text{Ca}^{2+}et d'ions carbonate \text{CO}_{3}^{2-}. Lorsque les eaux de pluie s'écoulent et ruissellent sur les sols riches en calcite, la calcite se dissout dans l'eau qui s'enrichit alors en ions calcium.


1.
Quelles sont les interactions à l'origine de la cohésion
de la calcite ?
2. Écrire l'équation de dissolution de la calcite dans l'eau.
3. Calculer la concentration maximale, exprimée en g·L-1, des ions calcium \text{Ca}2+ et carbonate \text{CO}_{3}^{2-} dans un litre d'eau douce.
2. Écrire l'équation de dissolution de la calcite dans l'eau.
3. Calculer la concentration maximale, exprimée en g·L-1, des ions calcium \text{Ca}2+ et carbonate \text{CO}_{3}^{2-} dans un litre d'eau douce.
Données
- Solubilité de la calcite : s = 50 ppm environ à 20 °C ;
- Masse volumique de la solution : \rho = 1,0 g·cm‑3.
Info
Une solubilité de 1 ppm (partie par million) signifie que la solubilité est de 1 g dans 1 000 000 g de solution.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
34Déconstruire les idées fausses
Sucré salé
✔ RAI/ANA : Justifier un protocole
Le sucre et le sel sont deux solides blancs aux propriétés physiques bien différentes. Le sel est un solide ionique, constitué d'ions sodium \mathrm{Na}^{+} et chlorure \mathrm{Cl}^{-} organisés dans un cristal cubique face centrée. Le sucre est un solide moléculaire, constitué de molécules de saccharose de formule \text{C}_{12}\text{H}_{22}\text{O}_{11}.
Le sucre et le sel sont deux solides blancs aux propriétés physiques bien différentes. Le sel est un solide ionique, constitué d'ions sodium \mathrm{Na}^{+} et chlorure \mathrm{Cl}^{-} organisés dans un cristal cubique face centrée. Le sucre est un solide moléculaire, constitué de molécules de saccharose de formule \text{C}_{12}\text{H}_{22}\text{O}_{11}.
1. Les interactions à l'origine de la cohésion du sel et du
sucre sont-elles de même nature ?
2. Comment expliquer la très grande différence de température
de fusion entre ces deux corps ?
Données
-
Température de fusion :
- Sel : \theta_{\text{f}}= 801 °C ;
- Saccharose : \theta_{\text{f}} = 185,5 °C.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AZwitterion
✔ RAI/ANA : Faire le lien entre modèle microscopique et observations macroscopiques
La glycine est le plus simple des acides aminés. Sa formule brute est : \text{C}_2\text{H}_5\text{NO}_2. Comme tous les acides aminés, elle peut exister sous deux formes, une forme où tous les atomes sont neutres : \text{H}_2\text{N-CH}_2\text{-COOH} et une autre forme, dite zwitterionique (se dit d'une molécule globalement neutre mais dont certains atomes portent des charges) de formule : \text{H}_3\text{N}^+_-\text{CH}_2\text{-COO}^-.
La glycine est le plus simple des acides aminés. Sa formule brute est : \text{C}_2\text{H}_5\text{NO}_2. Comme tous les acides aminés, elle peut exister sous deux formes, une forme où tous les atomes sont neutres : \text{H}_2\text{N-CH}_2\text{-COOH} et une autre forme, dite zwitterionique (se dit d'une molécule globalement neutre mais dont certains atomes portent des charges) de formule : \text{H}_3\text{N}^+_-\text{CH}_2\text{-COO}^-.
1. Représenter la formule de Lewis de ces deux molécules.
Cliquez pour accéder à une zone de dessin
2. Justifier que la forme zwitterionique est plus stable en solution aqueuse que la forme simple.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BExtraction du limonène
✔ AI/ANA : Faire le lien entre modèle microscopique et observations macroscopiques
Le limonène est la molécule responsable de l'arôme d'orange, sa formule est donnée ci-contre. Lorsque l'on fabrique une huile essentielle d'orange, une petite partie du limonène se retrouve en solution aqueuse, et pas dans l'huile essentielle. On souhaite extraire ce limonène résiduel.

1. Solubilité
a. Le limonène est-il polaire ?
b. Justifier qu'il soit très peu soluble dans l'eau, mais très soluble dans le cyclohexane.
2. Miscibilité
a. Quels types de liaisons inter-moléculaires peuvent exister entre l'eau et l'éthanol ? En faire une représentation schématique.
a. Le limonène est-il polaire ?
b. Justifier qu'il soit très peu soluble dans l'eau, mais très soluble dans le cyclohexane.
2. Miscibilité
a. Quels types de liaisons inter-moléculaires peuvent exister entre l'eau et l'éthanol ? En faire une représentation schématique.
Cliquez pour accéder à une zone de dessin
b. Justifier que l'eau et l'éthanol sont miscibles
3. Quel solvant doit-on utiliser pour réaliser cette extraction ? Faire un schéma légendé de l'ampoule à décanter après agitation.
4. Pour séparer le limonène du solvant extracteur, on veut évaporer le solvant sans évaporer le limonène. À quelle température doit-on se placer ?
3. Quel solvant doit-on utiliser pour réaliser cette extraction ? Faire un schéma légendé de l'ampoule à décanter après agitation.
4. Pour séparer le limonène du solvant extracteur, on veut évaporer le solvant sans évaporer le limonène. À quelle température doit-on se placer ?
Données
| Nom | Formule | Température de vaporisation (°C) | Solubilité du limonène | Miscibilité avec l'eau |
|---|---|---|---|---|
| Limonène | \mathrm{C}_{10} \mathrm{H}_{16} | 176 | ||
| Eau | \mathrm{H}_{2} \mathrm{O} | 100 | Très faible | |
| Cyclohexane | \mathrm{C}_{6} \mathrm{H}_{12} | 81 | Bonne | Non |
| Éthanol | \mathrm{CH}_{3}-\mathrm{CH}_{2}-\mathrm{OH} | 79 | Bonne | Oui |
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

