Chapitre 7
Exercices
Pour s'entraîner
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21Anhydre ou pentahydraté
✔ RAI/MOD : La quantité de matière
Léna et Enzo doivent préparer 50,0 mL d'une solution de sulfate de cuivre (II) dont la concentration en ions cuivre (II) doit être [\text{Cu}^{2+}] = 0,100 mol·L-1. Ils disposent au laboratoire d'un flacon de sulfate de cuivre (II) anhydre blanc (\text{CuSO}_{4}) et d'un flacon de sulfate de cuivre (II) pentahydraté bleu (\text{CuSO}_{4} ; 5\,\text{H}_{2}\text{O}).
Léna et Enzo doivent préparer 50,0 mL d'une solution de sulfate de cuivre (II) dont la concentration en ions cuivre (II) doit être [\text{Cu}^{2+}] = 0,100 mol·L-1. Ils disposent au laboratoire d'un flacon de sulfate de cuivre (II) anhydre blanc (\text{CuSO}_{4}) et d'un flacon de sulfate de cuivre (II) pentahydraté bleu (\text{CuSO}_{4} ; 5\,\text{H}_{2}\text{O}).
1.
Écrire l'équation de la dissolution du sulfate de cuivre
(II) dans l'eau.
2. Calculer la masse de sulfate de cuivre (II) pentahydraté qu'il faut utiliser pour réaliser cette solution.
3. Ils réalisent la solution mais se trompent sur le soluté à utiliser : ils utilisent le sulfate de cuivre (II) anhydre solide. Calculer la concentration en soluté en mol·L-1 de la solution qu'ils ont fabriquée.
2. Calculer la masse de sulfate de cuivre (II) pentahydraté qu'il faut utiliser pour réaliser cette solution.
3. Ils réalisent la solution mais se trompent sur le soluté à utiliser : ils utilisent le sulfate de cuivre (II) anhydre solide. Calculer la concentration en soluté en mol·L-1 de la solution qu'ils ont fabriquée.
4.
En déduire les concentrations des ions en solution.
Données
- Ion sulfate \text{SO}^{2-}_{4} ;
- Ion cuivre (II) \text{Cu}^{2+} ;
- Masses molaires :
M(\text{Cu}) = 63,6 g·mol-1 ;
M(\text{S}) = 32,1 g·mol-1 ;
M(\text{O}) = 16,0 g·mol-1 ;
M(\text{H}) = 1,0 g·mol-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22
Le sulfate d'aluminium en QCM
✔ APP : Maîtriser le vocabulaire du cours
Amina doit préparer 50,0 mL d'une solution de sulfate d'aluminium de concentration en soluté c = 0,100 mol·L-1 pour faire bleuir ses hortensias.
Identifier la ou les bonnes réponses en justifiant le choix.
Identifier la ou les bonnes réponses en justifiant le choix.


1.
La formule du sulfate d'aluminium est :
a.
b.
c.
d.
2. Pour réaliser cette solution, il faut introduire une masse m de sulfate d'aluminium de :
a.
b.
c.
a.
b.
c.
d.
2. Pour réaliser cette solution, il faut introduire une masse m de sulfate d'aluminium de :
a.
b.
c.
3.
L'équation de dissolution s'écrit :
a.
b.
c.
4. L'équation de dissolution s'écrit :
a.
b.
c.
a.
b.
c.
4. L'équation de dissolution s'écrit :
a.
b.
c.
Données
Masses molaires :
- M(\mathrm{Al})= 27,0 g·mol-1 ;
- M(\mathrm{S})= 32,1 g·mol-1 ;
- M(\mathrm{O})= 16,0 g·mol-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23Préparation d'une solution de soude
✔ RAI/MOD : La quantité de matière
La soude industrielle est fabriquée par dissolution des pastilles d'hydroxyde de sodium, solide ionique de formule \text{NaOH}, dans l'eau.


1.
Quelles sont les interactions à l'origine de la cohésion
de l'hydroxyde de sodium à l'état solide ?
2. Écrire l'équation de dissolution de l'hydroxyde de sodium dans l'eau.
2. Écrire l'équation de dissolution de l'hydroxyde de sodium dans l'eau.
3.
Quelle masse de solide faut-il dissoudre pour réaliser
500 mL de soude de concentration en soluté apporté
c = 2,50 \times 10^{-1} mol·L‑1 ?
4. Quelle est la concentration des ions en solution ?
4. Quelle est la concentration des ions en solution ?
Données
Masses molaires :
- M(\mathrm{Na})= 23,0 g·mol-1 ;
- M(\mathrm{O})= 16,0 g·mol-1 ;
- M(\mathrm{H})= 1,0 g·mol-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24Autour du diiode
✔ APP : Maîtriser le vocabulaire du cours
Le diiode est un composé moléculaire de formule \text{I}_2, solide à la température ambiante (20 °C).

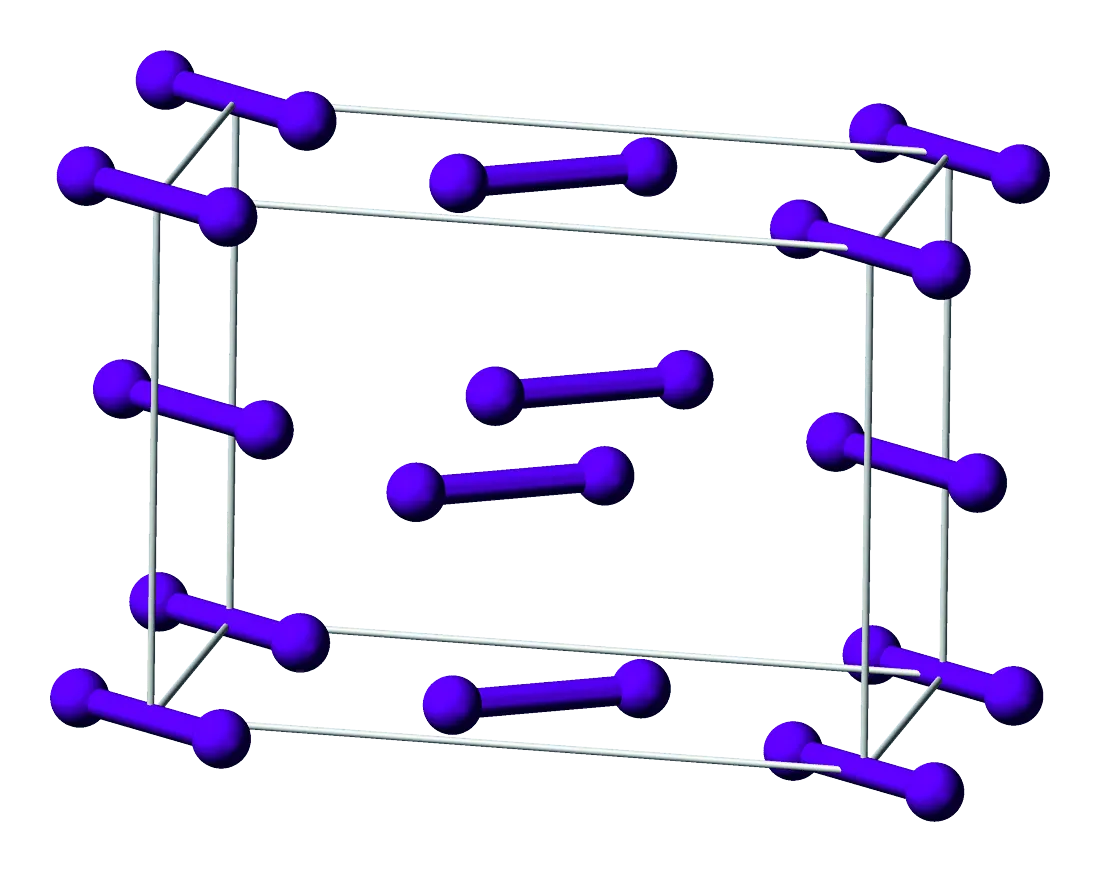 Organisation des molécules de diiode à l'état solide.
Organisation des molécules de diiode à l'état solide.
Le diiode est un composé moléculaire de formule \text{I}_2, solide à la température ambiante (20 °C).


1.
Quelles sont les
interactions à l'origine
de la cohésion
du diiode solide ?
2. Expliquer pourquoi la solubilité du diiode dans l'eau (s = 330 mg·L-1) est beaucoup plus faible que celle dans le cyclohexane (s = 21,2 g·L-1).
3. Quelle masse maximale de diiode peut-on introduire dans 50 mL d'eau et dans 50 mL de cyclohexane ?
2. Expliquer pourquoi la solubilité du diiode dans l'eau (s = 330 mg·L-1) est beaucoup plus faible que celle dans le cyclohexane (s = 21,2 g·L-1).
3. Quelle masse maximale de diiode peut-on introduire dans 50 mL d'eau et dans 50 mL de cyclohexane ?
Détails du barème
TOTAL /6 pts
1 pt
1.
Justifier la nature polaire/apolaire de la molécule
de diiode.1 pt
1.
Justifier la nature des interactions entre les
molécules de diiode pour expliquer la cohésion
du solide.1 pt
2.
Justifier la nature polaire/apolaire des molécules
de solvant (eau/cyclohexane).2 pts
2.
Expliquer la nature des interactions microscopiques
entre les molécules de diiode et l'eau, et entre les
molécules de diiode et le cyclohexane.1 pt
3.
Calculer correctement la masse maximale en
utilisant la définition de la solubilité.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25Extraire le diiode d'une solution aqueuse
✔ RAI/ANA : Justifier un protocole
L'eau iodée, ou Lugol, est un mélange d'eau, d'iodure de potassium (\mathrm{K}^{+}(\mathrm{aq}) \,;\, \mathrm{I}^{-}(\mathrm{aq})) et de diiode \text{I}_{2} dissous, utilisée pour montrer la présence d'amidon.
1. Quel solvant faut-il choisir pour extraire le diiode de l'eau iodée ? Justifier le choix.
L'eau iodée, ou Lugol, est un mélange d'eau, d'iodure de potassium (\mathrm{K}^{+}(\mathrm{aq}) \,;\, \mathrm{I}^{-}(\mathrm{aq})) et de diiode \text{I}_{2} dissous, utilisée pour montrer la présence d'amidon.
1. Quel solvant faut-il choisir pour extraire le diiode de l'eau iodée ? Justifier le choix.
2.
On mélange dans une ampoule à décanter 50 mL d'eau
iodée avec 20 mL du solvant choisi. Dessiner l'ampoule
à décanter avant l'agitation en précisant la composition
des phases et en justifiant leurs positions.
Cliquez pour accéder à une zone de dessin
3.
Dessiner l'ampoule à décanter après agitation et
décantation en précisant la composition des phases.
Cliquez pour accéder à une zone de dessin
Données
| Espèce chimique | Solubilité du diiode | Densité | Miscibilité avec l'eau |
| Eau | Faible | 1,00 | / |
| Cyclohexane | Très bonne | 0,779 | Nulle |
| Éthanol | Très bonne | 0,789 | Totale |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26Extraction du benzaldéhyde
✔ RAI/ANA : Justifier un
protocole
Le lait d'amande est une boisson
au parfum d'amande, qui
contient, entre autres, de l'eau
et du benzaldéhyde. On souhaite
extraire le benzaldéhyde
de cette boisson par solvant.


1.
Quel solvant faut-il choisir ?
Justifier.
2.
Dessiner l'ampoule à décanter avant, puis après l'agitation,
en indiquant la composition des phases.
Cliquez pour accéder à une zone de dessin
Données
| Espèce chimique | Solubilité du benzaldéhyde | Densité | Miscibilité avec l'eau |
| Eau | Faible | 1,00 | / |
| Éthanol | Très soluble | 0,789 | Totale |
| Éther | Très soluble | 0,713 | Partielle |
| Acétone | Très soluble | 0,784 | Grande |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27
Chlorure de fer (III)
✔ RAI/MOD : La quantité de matièreLa solution de chlorure de fer (III) est utilisée en usage pharmaceutique pour ses propriétés hémostatiques.
On prépare un volume V = 100,0 mL d'une solution aqueuse de chlorure de fer (III) en dissolvant une masse m = 8,1 g de chlorure de fer (III) de formule \text{FeCl}^{3}.
1. Que signifie le terme hémostatique ?
2. Écrire l'équation de dissolution du solide ionique dans l'eau.
3. Décrire le protocole de préparation de la solution.
4. Calculer la concentration en soluté apporté (en g·L-1 puis en mol·L‑1).
5. Calculer la concentration des ions dans la solution.
Données
- M(\mathrm{Cl})= 35,5 g·mol-1 ;
- M(\mathrm{Fe})= 55,9 g·mol-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
28Molécule de tensioactif
✔ APP : Maîtriser le vocabulaire du coursLe jaune d'œuf contient une protéine de faible densité, la LDL, qui est soluble à la fois dans l'huile et dans l'eau. Elle se positionne à l'interface entre une goutte d'huile et l'eau et permet ainsi la formation d'un mélange contenant des gouttelettes d'huile stables dans l'eau, appelé émulsion.
D'après le sujet Bac sciences ES/L, 2017.
Dessiner sur le schéma ci-dessus les molécules de LDL et expliquer pourquoi le mélange eau/ huile est stable.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
29Copie d'élève à commenter
Proposer une justification pour chaque erreur
relevée par le correcteur.
1.
L'équation de dissolution du chlorure d'argent en
solution s'écrit : \text{Ag}^{+} (\text{aq}) + \text{Cl}^{-} (\text{aq}) \rightarrow \text{AgCl} (\text{s}).
2. La cohésion de l'éthanol à l'état liquide est liée aux interactions entremolécules apolaires et
aux ponts hydrogène.
3. Dans la solution de nitrate d'argent, la concentration des ions argent estle double de
celle des ions nitrate.
4. Le sel se dissout bien dans l'eau car il forme de nombreusesliaisons hydrogène avec les
molécules d'eau.
5. L'éthanol se dissout facilement dans l'eau car il se forme des ponts hydrogène entre l'atomed'hydrogène du groupe -\text{OH} de l'éthanol et
l'atome d'hydrogène de la molécule d'eau.
6. L'éthanol se dissout facilement dans l'eau car il se forme des ponts hydrogène entre l'atomeest lipophile car elle
contient une zone hydrophile et une zone amphiphile.
2. La cohésion de l'éthanol à l'état liquide est liée aux interactions entre
3. Dans la solution de nitrate d'argent, la concentration des ions argent est
4. Le sel se dissout bien dans l'eau car il forme de nombreuses
5. L'éthanol se dissout facilement dans l'eau car il se forme des ponts hydrogène entre l'atome
6. L'éthanol se dissout facilement dans l'eau car il se forme des ponts hydrogène entre l'atome
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

