Chapitre 8
Activité 2 - Activité expérimentale
90 min
Solubilité de l'acide benzoïque
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
L'acide benzoïque est un additif alimentaire qui est solide à la température
ambiante. Il est peu soluble dans l'eau, et soluble dans l'éthanol et l'acétone.
Quels paramètres influent sur la solubilité d'une espèce chimique ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pourquoi ne pourrait-on
pas dissoudre n'importe
quelle espèce chimique
solide dans n'importe
quel liquide ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 Propriétés physiques de l'acide benzoïque
| Molécule | Acide benzoïque |
| Formule | \mathrm{C}_{7} \mathrm{H}_{6} \mathrm{O}_{2}
 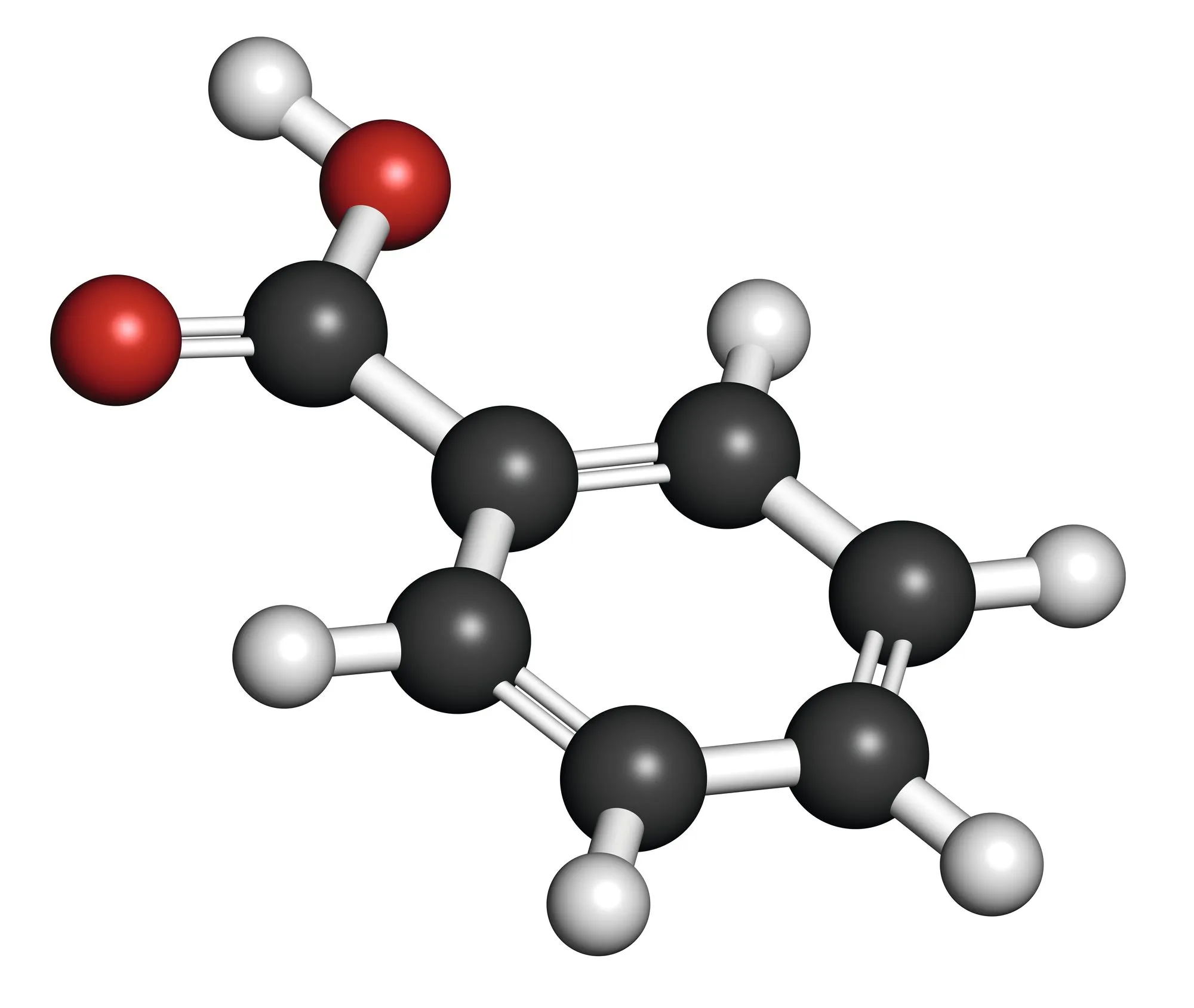 |
| Propriétés physiques |
|
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Vérifier une solubilité dans un solvant
Pour vérifier qu'une espèce chimique est soluble dans
un solvant, on peut procéder ainsi :
- introduire dans un bécher un volume V = 10 mL du solvant à l'aide d'une pipette jaugée ;
- peser précisément une masse m de soluté ;
- ajouter cette masse m de soluté dans le bécher ;
- agiter le contenu du bécher avec un agitateur en verre ou sur agitateur magnétique ;
- observer le contenu du bécher et conclure.
| Observation | Interprétation / conclusion |
| La solution est limpide | Le soluté est soluble dans le solvant |
| La solution est trouble |
Le soluté est soluble, mais on est proche de la limite de solubilité;
|
| Il reste des grains solides au fond du bécher | La solution est saturée : on a dépassé la limite de solubilité de l'espèce dans le solvant |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Matériel nécessaire
- Une balance de précision avec une coupelle et une spatule ;
- Plusieurs béchers de 20 mL et un agitateur en verre ;
- Éthanol ;
- Une pipette jaugée de 10,0 mL ;
- Acide benzoïque en poudre ;
- Pissette d'eau distillée ;
- Acétone (propanone).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Électronégativité des atomes (échelle de Pauling) :
\chi (\text{C}) : 2,55 ;
\chi (\text{H}) : 2,2 ;
\chi (\text{O}) : 3,44.
| Molécule | Formule de Lewis |
| Eau |
 |
| Acétone |
 |
| Éthanol |
 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
REA : Mettre en œuvre
un protocole
2. Doc. 3 Mettre en œuvre le protocole pour l'acide benzoïque dans l'eau et comparer la valeur de solubilité trouvée à la valeur théorique.
3. Refaire l'expérience en remplaçant l'eau par l'éthanol puis par l'acétone.
4. À partir de leurs représentations de Lewis, étudier la polarité de l'acide benzoïque et des solvants
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
Proposer une explication sur la différence de solubilité de l'acide benzoïque dans les
différents solvants.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

