Chapitre 7
Bilan
Interpréter les propriétés d'une espèce chimique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Principales notions
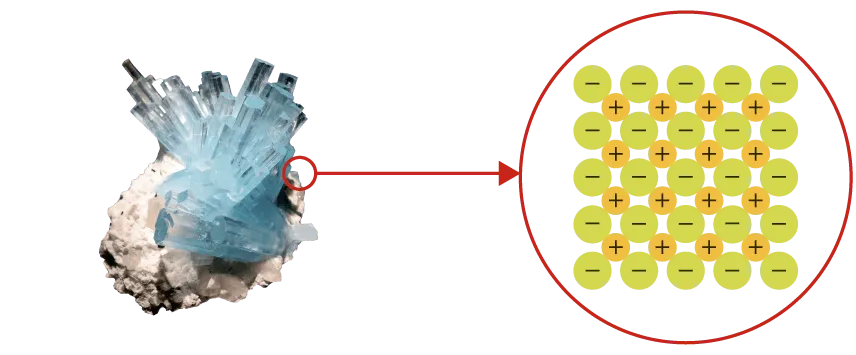
Un solide ionique ou moléculaire contient des entités
chimiques (ions ou molécules) empilées régulièrement
dans l'espace.
Un solide ionique peut généralement se dissoudre dans
l'eau :
\text{A}_{\text{x}} \text{B}_{\text{y}}(\text{s}) \stackrel{\text {eau}}{\longrightarrow} x \text{A}^{\text{m}+}(\text{aq})+y\, \text{B}^{\text{n}-}(\text{aq}).

\text{A}_{\text{x}} \text{B}_{\text{y}}(\text{s}) \stackrel{\text {eau}}{\longrightarrow} x \text{A}^{\text{m}+}(\text{aq})+y\, \text{B}^{\text{n}-}(\text{aq}).


Deux liquides sont miscibles si le mélange qu'ils forment
est homogène.
La solubilité traduit la capacité d'un soluté à se dissoudre dans un solvant. L'extraction par solvant est une technique expérimentale qui consiste à utiliser un solvant pour extraire une espèce dissoute dans un autre solvant en jouant sur les différences de solubilité.

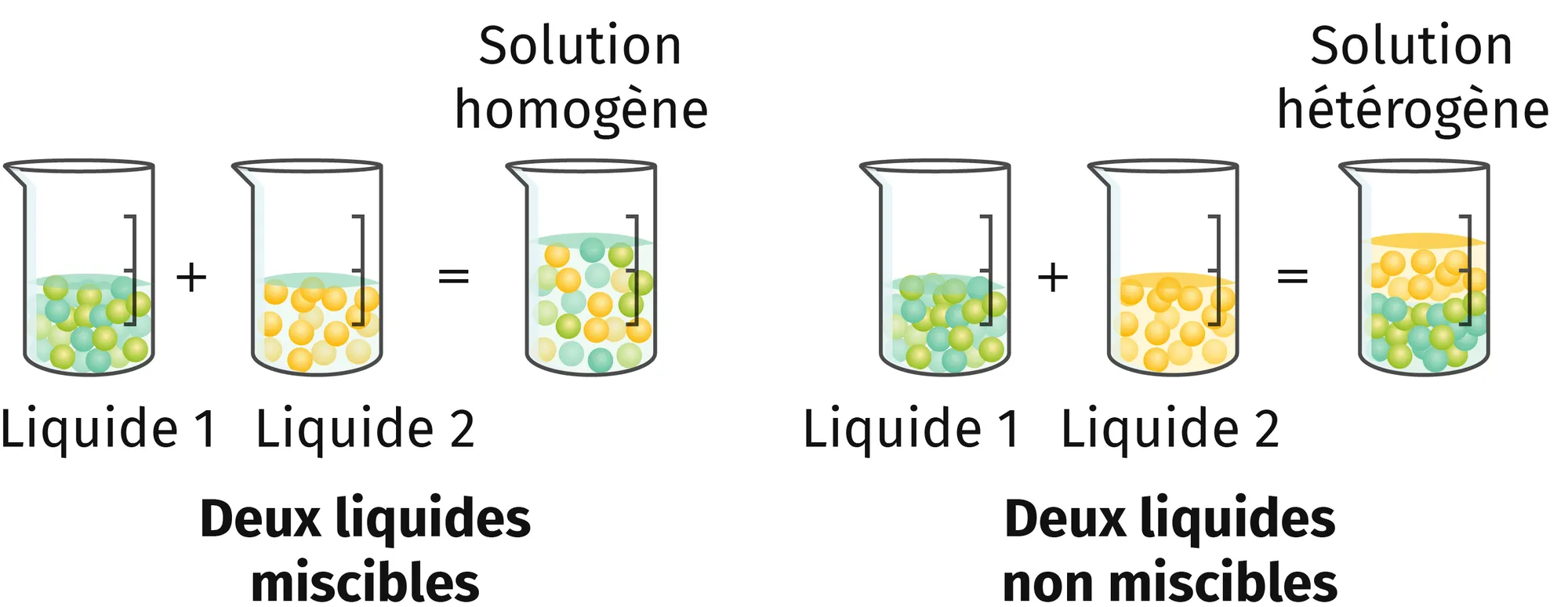
La solubilité traduit la capacité d'un soluté à se dissoudre dans un solvant. L'extraction par solvant est une technique expérimentale qui consiste à utiliser un solvant pour extraire une espèce dissoute dans un autre solvant en jouant sur les différences de solubilité.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Les éléments essentiels de la modélisation
La cohésion d'un solide est assurée par des interactions
électrostatiques :

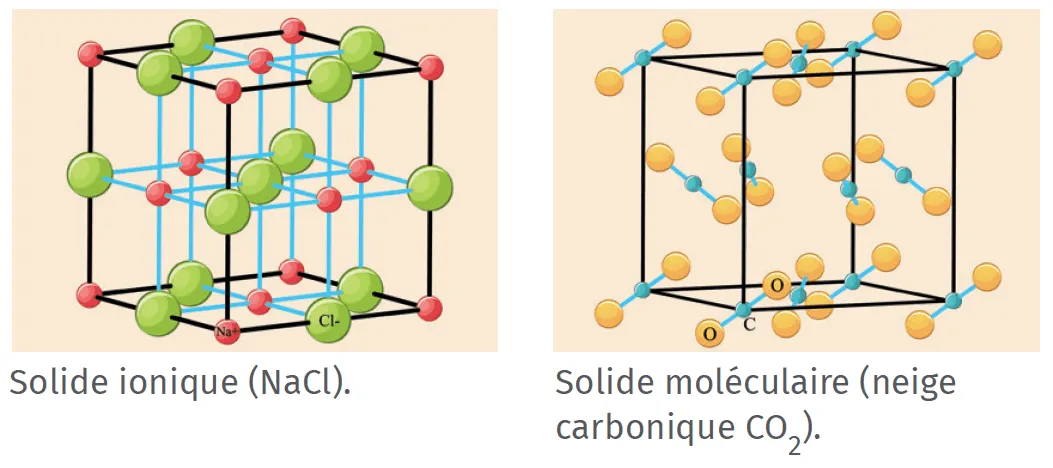
- pour le solide ionique, entre les cations et les anions ;
- pour le solide moléculaire, entre les molécules polaires ou entre les molécules apolaires (interactions de Van der Waals) et parfois avec des ponts hydrogène.



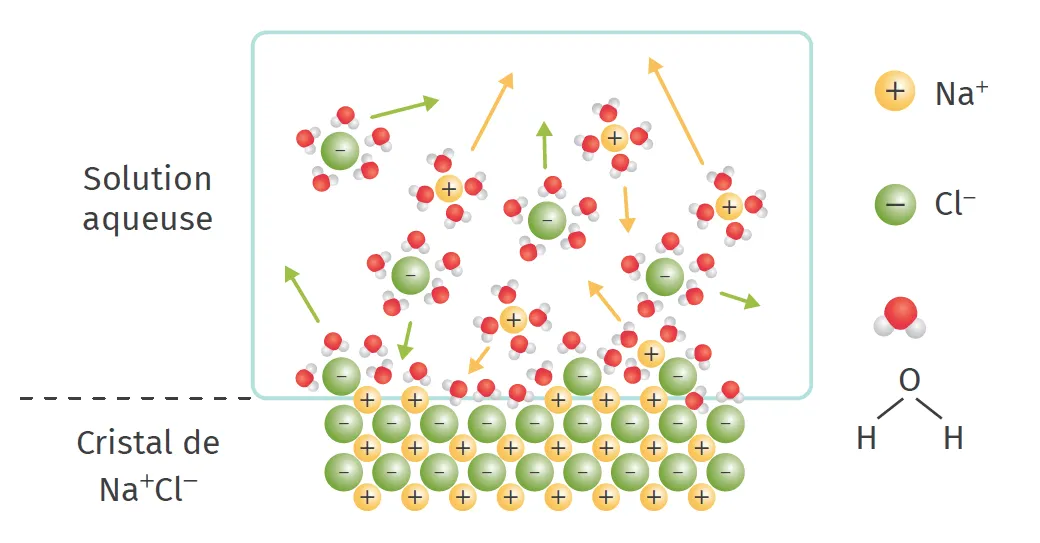
Au cours de la dissolution d'un solide ionique dans l'eau, le soluté se dissocie (les ions se séparent les uns des autres) et les ions s'entourent de molécules d'eau. La solubilité d'un soluté dans un solvant dépend des interactions entre le soluté et le solvant.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Les limites de la modélisation
Les techniques d'extraction liquide-liquide reposent
sur les différences de solubilité et de miscibilité entre
le soluté et les solvants.
Cependant, il n'est pas rare qu'un soluté soit soluble dans les deux solvants avec des valeurs de solubilité similaires : il faut alors procéder à plusieurs extractions successives.
Par ailleurs, si la concentration en soluté est très élevée, les interactions entre le soluté et le solvant sont trop importantes et on ne peut plus définir alors la concentration en soluté par la simple relation c = \dfrac{n}{V} .
Pour cette raison, les concentrations usuelles en soluté apporté dépassent rarement 1 mol·L-1.
Cependant, il n'est pas rare qu'un soluté soit soluble dans les deux solvants avec des valeurs de solubilité similaires : il faut alors procéder à plusieurs extractions successives.
Par ailleurs, si la concentration en soluté est très élevée, les interactions entre le soluté et le solvant sont trop importantes et on ne peut plus définir alors la concentration en soluté par la simple relation c = \dfrac{n}{V} .
Pour cette raison, les concentrations usuelles en soluté apporté dépassent rarement 1 mol·L-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Rendez-vous sur pour faire une carte mentale et reprendre les principales notions du chapitre !
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

