Chapitre 10
Exercices
Pour s'entraîner
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22Synthèse peptidique au laboratoire
✔ RAI/ANA : Justifier un protocole
Les chimistes sont capables de reconstituer en laboratoire les familles de longues chaînes biologiques indispensables au fonctionnement de la cellule. Pour cela, ils réalisent des enchaînements d'acides aminés à l'aide d'une réaction nommée synthèse peptidique dont l'équation générale est donnée ci-dessous :

1. Préciser le nombre de dipeptides différents pouvant être obtenus par cette réaction.
Un dipeptide obtenu est nommé à partir de l'abréviation des deux acides aminés ayant permis de l'obtenir.
2. Écrire l'équation de la synthèse du dipeptide Leu-Ile en indiquant les groupes à protéger pour obtenir ce seul dipeptide.
3. Expliquer en quelques lignes pourquoi réaliser au laboratoire la synthèse d'une protéine (de plus de 50 acides aminés) reste un défi industriel.

1. Préciser le nombre de dipeptides différents pouvant être obtenus par cette réaction.
Un dipeptide obtenu est nommé à partir de l'abréviation des deux acides aminés ayant permis de l'obtenir.
2. Écrire l'équation de la synthèse du dipeptide Leu-Ile en indiquant les groupes à protéger pour obtenir ce seul dipeptide.
3. Expliquer en quelques lignes pourquoi réaliser au laboratoire la synthèse d'une protéine (de plus de 50 acides aminés) reste un défi industriel.
Doc.
Des acides aminés



Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23Nylon 6-6
✔ APP : Maîtriser le vocabulaire du cours
D'après le sujet Bac S, Polynésie 2008.
Le nylon 6‑6 est le produit de la réaction de polycondensation entre l'hexane-1,6-diamine et l'acide hexanedioïque.

1. Cette polymérisation est une polycondensation. Déterminer quelle petite molécule est éliminée lors de la réaction.
2. Justifier la dénomination 6‑6 de ce nylon.
3. Calculer la masse molaire du motif du polymère.
Au laboratoire, le dichlorure d'hexanedioyle est utilisé à la place de l'acide. Pour cela, 10 mL d'une solution de dichlorure d'hexanedioyle en solution à 5 % en masse sont versés avec précaution dans un bécher contenant du dichlorométhane.
La solution aqueuse d'hexane‑1,6‑diamine est ensuite versée le long d'un agitateur en verre. Il se forme deux phases.
On rajoute quelques gouttes de phénolphtaléine. À l'aide d'un crochet, on tire une fibre que l'on enroule autour d'un agitateur. Un fil rose est obtenu, lavé à l'eau, puis mis à l'étuve.
4. Expliquer pourquoi les deux solutions ne sont pas miscibles et justifier l'ordre dans lequel sont versées les deux solutions.
5. Expliquer la couleur du fil de nylon.
2. Justifier la dénomination 6‑6 de ce nylon.
3. Calculer la masse molaire du motif du polymère.
Au laboratoire, le dichlorure d'hexanedioyle est utilisé à la place de l'acide. Pour cela, 10 mL d'une solution de dichlorure d'hexanedioyle en solution à 5 % en masse sont versés avec précaution dans un bécher contenant du dichlorométhane.
La solution aqueuse d'hexane‑1,6‑diamine est ensuite versée le long d'un agitateur en verre. Il se forme deux phases.
On rajoute quelques gouttes de phénolphtaléine. À l'aide d'un crochet, on tire une fibre que l'on enroule autour d'un agitateur. Un fil rose est obtenu, lavé à l'eau, puis mis à l'étuve.
| Espèces chimiques | Solubilité dans l'eau | Densité |
|---|---|---|
| Dichlorure d'hexanedioyle | Insoluble | 1,1 |
| Hexane-1,6-diamine | Soluble | 0,9 |
| Dichlorométhane | Insoluble | 1,3 |
4. Expliquer pourquoi les deux solutions ne sont pas miscibles et justifier l'ordre dans lequel sont versées les deux solutions.
5. Expliquer la couleur du fil de nylon.
Données
- Zone de virage de la phénolphtaléine : \text {pH} \in \text {[8,2 ; 10,0]}
- Couleurs de la phénolphtaléine : incolore sous sa forme acide, rose sous sa forme basique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24Vanilline, une molécule polyfonctionnelle
✔ APP : Maîtriser le vocabulaire du cours
La vanilline est une molécule polyfonctionnelle qui présente un grand intérêt en synthèse organique.
1. Préciser les groupes caractéristiques présents dans la molécule de vanilline.
2. Indiquer la catégorie à laquelle appartient chacune des réactions de synthèse conduisant aux molécules du doc. ci‑dessous
3. Indiquer si la réaction conduisant à l'acide vanillique constitue une modification de chaîne ou de groupe caractéristique.
Une élève souhaite réaliser la synthèse de l'acide vanillique à partir de la vanilline. Elle n'est pas sûre que l'oxydant \text{Ag}_6\text{O} soit sélectif et craint d'oxyder les deux fonctions alcool et aldéhyde lors de cette étape.
2. Indiquer la catégorie à laquelle appartient chacune des réactions de synthèse conduisant aux molécules du doc. ci‑dessous
3. Indiquer si la réaction conduisant à l'acide vanillique constitue une modification de chaîne ou de groupe caractéristique.
Une élève souhaite réaliser la synthèse de l'acide vanillique à partir de la vanilline. Elle n'est pas sûre que l'oxydant \text{Ag}_6\text{O} soit sélectif et craint d'oxyder les deux fonctions alcool et aldéhyde lors de cette étape.
4. Détailler la stratégie à mettre en place pour s'assurer de n'oxyder que la fonction aldéhyde.
Protéger une fonction alcool est possible en la transformant en une fonction ester. Pour cela, l'alcool est mis à réagir avec un acide carboxylique. Déprotéger une fonction alcool lorsqu'elle a été estérifiée consiste à l'hydrolyser en milieu acide.
5. Écrire l'équation de la réaction de l'éthanol avec l'acide méthanoïque conduisant au méthanoate d'éthyle et préciser le nom de la seconde molécule produite lors de cette estérification.
6. Proposer une suite de réactions permettant de synthétiser l'acide vanillique à partir de la vanilline.
Protéger une fonction alcool est possible en la transformant en une fonction ester. Pour cela, l'alcool est mis à réagir avec un acide carboxylique. Déprotéger une fonction alcool lorsqu'elle a été estérifiée consiste à l'hydrolyser en milieu acide.
5. Écrire l'équation de la réaction de l'éthanol avec l'acide méthanoïque conduisant au méthanoate d'éthyle et préciser le nom de la seconde molécule produite lors de cette estérification.
6. Proposer une suite de réactions permettant de synthétiser l'acide vanillique à partir de la vanilline.
Doc.
Vanilline, intermédiaire de synthèse

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25Synthèse d'un arôme
✔ RAI/ANA : Construire un raisonnement
Doc.
Gousse de vanille avant la récolte


La note dominante du parfum de la vanille est due à la molécule de vanilline. Sa synthèse peut se faire en trois étapes à partir de l'isoeugénol. Ces trois étapes sont proposées ci‑dessous dans un ordre aléatoire :

1. Proposer l'ordre chronologique des trois étapes de la synthèse de la vanilline.
2. Donner un nom à chacune de ces trois étapes.
Détails du barème
2. Donner un nom à chacune de ces trois étapes.
Détails du barème
TOTAL /3 pts
0,5 pt
1. Identifier le réactif de départ.1 pt
Proposer un ordre cohérent pour l'enchaînement des trois étapes.1,5 pt
2. Identifier les étapes de synthèse, de protection et de déprotection.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26Synthèse de l'ocytocine
✔ RAI/ANA : Construire un raisonnement
D'après le sujet Bac S, France métropolitaine, 2015.
L'ocytocine est un polypeptide constitué à partir de neuf acides \alpha‑aminés.
Sa formule est la suivante :
\text{H}_2\text{N} - \text{Cys} - \text{Tyr} - \text{Ile} - \text{Gln} - \text{Asn} - \text{Cys} - \text{Pro} - \text{Leu} - \text{Gly} - \text{COOH}
1. Rechercher sur Internet la formule générale d'un acide \alpha-aminé.
2. Lors de la synthèse d'un dipeptide à partir de deux acides \alpha-aminés, préciser la problématique rencontrée par le chimiste et la stratégie à mettre en place pour ne synthétiser que le dipeptide recherché.
La première étape de la synthèse consiste au couplage de deux premiers acides \alpha-aminés, à savoir la leucine et la glycine, pour former le dipeptide Leu - Gly.
3. Proposer la stratégie à adopter pour effectuer la suite de la synthèse en précisant le nombre d'étapes à prévoir pour ne synthétiser que l'ocytocine.
4. Dans le corps humain, la synthèse de l'ocytocine se fait en un nombre d'étapes bien plus faible. Proposer une explication.
4. Dans le corps humain, la synthèse de l'ocytocine se fait en un nombre d'étapes bien plus faible. Proposer une explication.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27Voies de synthèse de l'ibuprofène
✔ Voies de synthèse de l'ibuprofène
D'après le sujet Bac S, Antilles Guyane, 2013.

Dans les années 1960, les laboratoires Boots développent la molécule d'ibuprofène de formule brute \text{C}_{13}\text{H}_{18}\text{O}_{2} et proposent une voie de synthèse en six étapes. Dans les années 1990, la société BHC met au point un procédé reposant sur les principes de la chimie verte.
La nouvelle voie de synthèse ne met en jeu que trois étapes. Ainsi, la quantité de sous-produits est considérablement réduite, de plus l'unique sous-produit formé est valorisé.
1. L'étape 1 des procédés Boots et BHC est identique. Il y a formation du composé représenté sur le , et d'acide éthanoïque, non représenté. Préciser le type de réaction.
2. Le procédé BHC utilise les espèces \text{Ni} et \text{Pd} (qui ne sont pas des réactifs). Préciser leur rôle.
3. Préciser la catégorie de réactions de du procédé Boots.
4. L'économie d'atomes du procédé des laboratoires Boots est EA_1 = 0{,}40. On montre que l'économie d'atomes EA_2 du procédé de la société BHC vaut environ 77 \%. Conclure.
5. Faire l'inventaire des raisons pour lesquelles le procédé BHC s'insère dans les principes de la chimie verte.
2. Le procédé BHC utilise les espèces \text{Ni} et \text{Pd} (qui ne sont pas des réactifs). Préciser leur rôle.
3. Préciser la catégorie de réactions de du procédé Boots.
4. L'économie d'atomes du procédé des laboratoires Boots est EA_1 = 0{,}40. On montre que l'économie d'atomes EA_2 du procédé de la société BHC vaut environ 77 \%. Conclure.
5. Faire l'inventaire des raisons pour lesquelles le procédé BHC s'insère dans les principes de la chimie verte.
Doc. 1
Procédés Boots et BHC

Doc. 2
Détails des étapes 2 à 6 du procédés Boots

Données
- Expression de l'économie d'atomes :
-
EA=\frac{\sum_\text{i} \text{a}_\text{i} \cdot \text{M}_\text{i}}{\sum_\text{j} \text{b}_\text{j} \cdot \text{M}_\text{j}}
EA : économie d'atomes
\text{a}_\text{i} : coefficients stœchiométriques des produits désirés
\text{M}_\text{i} : masses molaires des produits désirés (g⋅mol-1)
\text{b}_\text{j} : coefficients stœchiométriques des réactifs
\text{M}_\text{j} : masses molaires des réactifs (g⋅mol-1)
\text{a}_\text{i} : coefficients stœchiométriques des produits désirés
\text{M}_\text{i} : masses molaires des produits désirés (g⋅mol-1)
\text{b}_\text{j} : coefficients stœchiométriques des réactifs
\text{M}_\text{j} : masses molaires des réactifs (g⋅mol-1)
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
28Plusieurs voies de synthèse du phénol
✔ RAI/ANA : Choisir un protocole
D'après le sujet Bac S, France métropolitaine, 2014.

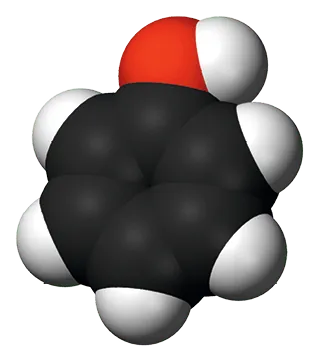
Le phénol, de formule brute \text{C}_{6}\text{H}_{5}\text{OH}, est un composé d'une grande importance dans l'industrie chimique, car il est l'un des intermédiaires de nombreuses réactions comme celle de la synthèse de l'aspirine par exemple.
| Pictogramme de sécurité | |
|---|---|
| Propanone |
  |
| Propène |
  |
1. Préciser la valeur maximale de l'économie d'atomes EA pouvant être atteinte. Justifier simplement.
2. Écrire l'équation-bilan qui modélise la synthèse du phénol pour chacun de deux procédés proposés dans les doc. , et .
3. Calculer la valeur de l'économie d'atomes dans le cas de la mise en oeuvre du procédé n° 2.
4. Préciser quelles informations sont nécessaires pour indiquer lequel des deux procédés semble le plus respectueux des principes de la chimie verte.
Doc. 1
Économie d'atomes
L'économie d'atomes (EA) d'une synthèse est définie comme le rapport de la somme des masses molaires du (ou des) produit(s) recherché(s) sur la somme des masses molaires de tous les réactifs en tenant compte des coefficients stœchiométriques :
EA=\frac{\sum_\text{i} \text{a}_\text{i} \cdot \text{M}_\text{i}}{\sum_\text{j} \text{b}_\text{j} \cdot \text{M}_\text{j}}
EA : économie d'atomes
\text{a}_\text{i} : coefficients stœchiométriques des produits désirés
\text{M}_\text{i} : masses molaires des produits désirés (g⋅mol-1)
\text{b}_\text{b} : coefficients stœchiométriques des réactifs
\text{M}_\text{j} : masses molaires des réactifs (g⋅mol-1)
\text{a}_\text{i} : coefficients stœchiométriques des produits désirés
\text{M}_\text{i} : masses molaires des produits désirés (g⋅mol-1)
\text{b}_\text{b} : coefficients stœchiométriques des réactifs
\text{M}_\text{j} : masses molaires des réactifs (g⋅mol-1)
Doc. 2
Procédé n° 1 mis en œuvre par la firme Mitsubishi Chemical
Étape 1 : acétoxylation du benzène en présence d'air et d'acide éthanoïque, étape catalysée par du palladium et réalisée à environ 200 °C.

Étape 2 : hydrolyse du produit obtenu réalisée à 600 °C.

Doc. 3
Procédé n° 2 dit au cumène
Ce procédé en trois étapes fut découvert en 1944 par les chimistes Hock et Lang et est à l'heure actuelle le plus utilisé puisqu'il est à l'origine de plus de 85 % de la production mondiale de phénol.
Étape 1 : réalisée à une température de 190 °C, sous une pression de 34 bar, en présence d'un catalyseur acide.

Étape 2 : réalisée à une température de 110 °C sous une pression de 5 à 10 bar en milieu basique.

Étape 3 : réalisée à 50 °C en milieu légèrement acide.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AChangement de couleur lors d'une polymérisation
✔ APP : Maîtriser le vocabulaire du cours
Exemples : Les deux liaisons double du butadiène et les trois liaisons double du benzène sont conjuguées.


Contre‑exemple : Dans le penta‑1,4‑diène, les deux liaisons doubles ne sont pas conjuguées.

Plus le nombre de doubles liaisons conjuguées est important et plus la longueur d'onde du maximum d'absorption augmente. Ainsi, s'il y a peu de liaisons doubles conjuguées, l'absorption sera dans l'ultraviolet et la molécule sera incolore, mais s'il y a beaucoup de liaisons doubles conjuguées, alors l'absorption sera dans le visible et la molécule sera colorée.
En milieu basique, deux aldéhydes peuvent réagir ensemble suivant la réaction :

1. Justifier que cette réaction permet de synthétiser des polymères.
2. De quel type de polymérisation s'agit‑il ?

1. Justifier que cette réaction permet de synthétiser des polymères.
2. De quel type de polymérisation s'agit‑il ?
3. Représenter le polymère obtenu à l'aide de la notation \text { () }_{n}.
Cliquez pour accéder à une zone de dessin
4. Représenter la formule topologique de ce polymère pour n = 4.
Cliquez pour accéder à une zone de dessin
5. Les doubles liaisons double \mathrm{C}\mathrm{=}\mathrm{C} dans ce polymère sont‑elles toutes conjuguées ?
6. Justifier les observations expérimentales lorsque l'on verse de la soude concentrée dans l'éthanal.
6. Justifier les observations expérimentales lorsque l'on verse de la soude concentrée dans l'éthanal.
Doc. 1
Liaisons doubles conjuguées
Deux liaisons doubles sont conjuguées si elles sont séparées par une et une seule liaison simple.
Exemples : Les deux liaisons double du butadiène et les trois liaisons double du benzène sont conjuguées.


Contre‑exemple : Dans le penta‑1,4‑diène, les deux liaisons doubles ne sont pas conjuguées.

Doc. 2
Liaisons conjuguées et absorption de la lumière
Il existe un lien entre la structure d'une molécule et sa couleur. Un des principaux facteurs est la présence d'un grand nombre de liaisons doubles conjuguées.
Plus le nombre de doubles liaisons conjuguées est important et plus la longueur d'onde du maximum d'absorption augmente. Ainsi, s'il y a peu de liaisons doubles conjuguées, l'absorption sera dans l'ultraviolet et la molécule sera incolore, mais s'il y a beaucoup de liaisons doubles conjuguées, alors l'absorption sera dans le visible et la molécule sera colorée.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

