Chapitre 1
Activité 1 - Activité d'exploration
Couple acide-base
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Objectif : Identifier les couples acide-base et établir l'équation d'une réaction acide‑base.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
Les couples oxydant-réducteur ont été étudiés en classe de 1re pour expliquer un type de transformation. Il existe également une autre grande famille de couples : les couples acide-base.
Comment définir et déterminer un couple acide-base ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Solution d'acide chlorhydrique
Dans un premier temps, on synthétise du chlorure d'hydrogène gazeux \text{HCl(g)}. Le gaz produit est ensuite guidé dans un ballon puis dissous dans l'eau.
Découvrez la vidéo de cette expérience :
Découvrez la vidéo de cette expérience :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Couleurs de l'hélianthine

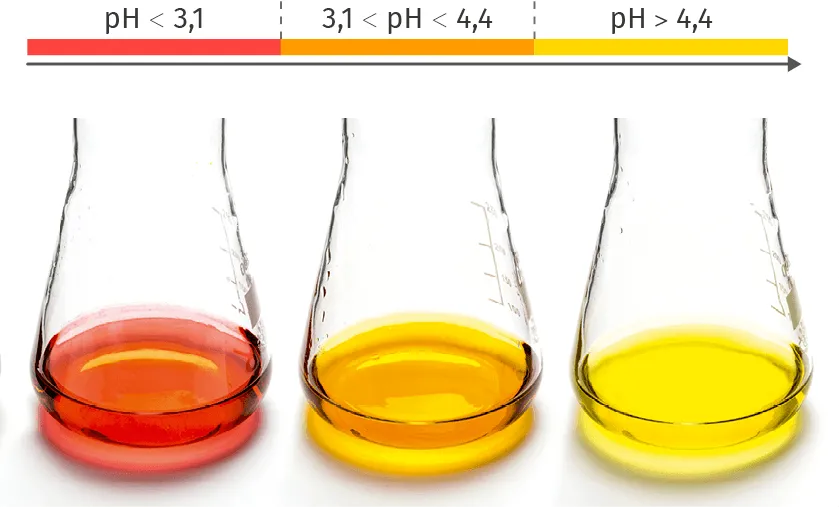
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Définition d'un acide
La première définition d'acide est apparemment d'origine organoleptique*, comme en témoigne le monde gréco-romain avec l'adjectif latin ăcǐdus, signifiant « aigre, piquant, et donc acide » et déjà au sens figuré, « acide, désagréable ». [...]
La première « théorie » de l'acidité est due à Lavoisier [...]. L'acidité fut ensuite définie par Arrhenius à la fin du XIXe siècle : un acide est un composé chimique pouvant céder des protons, ou ions \text{H}^+, en solution aqueuse et une base un composé chimique pouvant libérer des ions hydroxyde \text{HO}^- en solution aqueuse. Mais cette définition n'était pas assez générale et n'expliquait pas la basicité de certains composés chimiques ne libérant pas d'ion \text{HO}^- en solution aqueuse. [...]
Selon la théorie de Brönsted-Lowry, énoncée en 1923, un acide est une espèce qui peut libérer un proton, et une base toute espèce qui peut capter un proton.
La première « théorie » de l'acidité est due à Lavoisier [...]. L'acidité fut ensuite définie par Arrhenius à la fin du XIXe siècle : un acide est un composé chimique pouvant céder des protons, ou ions \text{H}^+, en solution aqueuse et une base un composé chimique pouvant libérer des ions hydroxyde \text{HO}^- en solution aqueuse. Mais cette définition n'était pas assez générale et n'expliquait pas la basicité de certains composés chimiques ne libérant pas d'ion \text{HO}^- en solution aqueuse. [...]
Selon la théorie de Brönsted-Lowry, énoncée en 1923, un acide est une espèce qui peut libérer un proton, et une base toute espèce qui peut capter un proton.
*Organoleptique : qui affecte les organes des sens.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
APP : Extraire l'information utile
RAI/ANA : Utiliser et interpréter des documents
RAI/ANA : Utiliser et interpréter des documents
1. Préciser quels sont les ions mis en évidence par l'hélianthine et le nitrate d'argent. En déduire l'équation de la réaction qui a eu lieu lorsque \text{HCl(g)} se dissout.
2. Justifier l'appellation d'« acide » du chlorure d'hydrogène.
3. En réalité, les ions hydrogène \text{H}^+\text{(aq)} n'existent pas seuls en solution. Ils s'associent avec l'eau \text{H}_2\text{O(l)} au cours d'une réaction. Écrire l'équation de cette association.
4. Préciser si l'eau \text{H}_2\text{O(l)} présente ici un caractère acide ou basique.
5. En faisant le bilan des questions 1. et 3., écrire l'équation de la réaction globale. On parle de couple acide-base \text{AH(aq)}/ \text{A}^-\text{(aq)} avec \text{AH(aq)}, l'acide, et \text{A}^-\text{(aq)}, la base, si on peut écrire la demi-équation acide-base suivante : \text{AH(aq)} \rightleftarrows \text{A}^-\text{(aq)} + \text{H}^+\text{(aq)}
6. Identifier les deux couples acide-base mis en jeu dans l'expérience.
7. Avec ces couples, montrer que la définition d'Arrhenius n'est pas satisfaisante.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
Expliquer en quelques mots comment reconnaître un couple acide-base.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

