Chapitre 1
Exercices
Pour s'échauffer - Pour commencer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour s'échauffer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5Couple acide-base (1)
Justifier que \text{CH}_3\text{COOH (aq)/CH}_3\text{COO}^-\text{(aq)} est un couple acide-base en écrivant la demi-équation associée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6Couple acide-base (2)
Justifier que \text{NH}^+_4\text{(aq)/NH}_3\text{(aq)} est un couple acide‑base en écrivant la demi‑équation associée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7Groupe caractéristique
1. Préciser si l'éthanal, contenu dans certaines plantes comme le tabac, le coton ou les fruits mûrs, peut être acide. Justifier.



2. Justifier que l'éthanal ne fait pas partie de la famille des acides carboxyliques.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8Représentation de Lewis (1)
Représenter les schémas de Lewis de l'ion ammonium \text{NH}^+_4 et de l'ammoniac \text{NH}_3.
Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9Représentation de Lewis (2)
Représenter le schéma de Lewis de l'ion éthanoate \text{CH}_3\text{COO}^-.
Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10\textbf{pH} et acidité
Le \text{pH} d'une eau gazeuse est de 5,5.1. Préciser si cette eau gazeuse est acide, neutre ou basique.
2. Calculer la concentration en ion oxonium \text{H}_3\text{O}^+\text{(aq)} de cette eau.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11Préparation des ECE
1. Préciser l'utilité d'un pH-mètre.
2. Expliciter le terme « étalonner » dans le cas du pH-mètre.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AModélisation des transformations acide‑base
✔ REA : appliquer une formule
Déterminer le pH d'une solution dont la concentration en ion oxonium est égale à \left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=4,0 \times 10^{-4} mol·L-1.
Déterminer le pH d'une solution dont la concentration en ion oxonium est égale à \left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=4,0 \times 10^{-4} mol·L-1.
Données
Relation entre les concentrations dans l'eau à 25 °C : \frac{\left[\mathrm{HO}^{-}\right] \cdot\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]}{c^{2}}=K_{e}
Conductivités molaires ioniques à 25°C : \lambda\left(\mathrm{HO}^{-}\right)=19{,}8 mS·m2·mol-1 et \lambda\left(\mathrm{H}_{3} \mathrm{O}^{+}\right)=35{,}0 mS·m2·mol-1
Produit ionique de l'eau : K_{e}=10^{14}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour commencer
Couples acide‑base
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12Identification de couples acide-base (1)
✔ REA : Utiliser un modèle
Identifier les couples acide-base parmi les couples suivants en écrivant les demi-équations associées :
a. \text{H}_3\text{O}^+\text{(aq)/H}_2\text{O(l)}.
b. \text{Fe}^{3+}\text{(aq)/Fe}^{2+}\text{(aq)}.
a. \text{H}_3\text{O}^+\text{(aq)/H}_2\text{O(l)}.
b. \text{Fe}^{3+}\text{(aq)/Fe}^{2+}\text{(aq)}.
c. \text{HgO(s)/Hg(l)}.
d. \text{H}^+\text{(aq)/H}_2\text{(g)}.
e. \text{HNO}_3\text{(aq)/NO}^-_3\text{(aq)}.
d. \text{H}^+\text{(aq)/H}_2\text{(g)}.
e. \text{HNO}_3\text{(aq)/NO}^-_3\text{(aq)}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13Identification de couples acide-base (2)
✔ REA : Utiliser un modèle
Identifier les couples acide-base parmi les couples suivants et écrire leur demi-équation :
a. \text{O}_2\text{(g)/H}_2\text{O}_2\text{(aq)}.
b. \text{H}_2\text{O}_2\text{(aq)/H}_2\text{O(l)}.
a. \text{O}_2\text{(g)/H}_2\text{O}_2\text{(aq)}.
b. \text{H}_2\text{O}_2\text{(aq)/H}_2\text{O(l)}.
c. \text{H}_2\text{O}\text{(l)/HO}^-\text{(aq)}.
d. \text{CH}_3\text{CHO(aq)/C}_2\text{H}_5\text{OH(aq)}.
e. (\text{CO}_2, \text{H}_2\text{O})(\text{aq})\text{/HCO}^-_3\text{(aq)}.
d. \text{CH}_3\text{CHO(aq)/C}_2\text{H}_5\text{OH(aq)}.
e. (\text{CO}_2, \text{H}_2\text{O})(\text{aq})\text{/HCO}^-_3\text{(aq)}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14Espèce conjuguée
✔ REA : Utiliser un modèle
Compléter les couples acide-base suivants :
a. \text{HF(aq)/}\dots
b. \dots/\text{CH}_3\text{COO}^-\text{(aq)}.
b. \dots/\text{CH}_3\text{COO}^-\text{(aq)}.
c. \text{(CO}_2, \text{H}_2\text{O)(aq)}/\dots
d. \dots/\text{SO}^{2-}_3\text{(aq)}.
d. \dots/\text{SO}^{2-}_3\text{(aq)}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15Réaction acide-base
✔ REA : Utiliser un modèle
En mettant de l'aspirine dans de l'eau, la réaction suivante se produit :
\text{C}_9\text{H}_8\text{O}_4\text{(aq)}+ \text{H}_2\text{O(l)} \leftrightarrows \text{C}_9\text{H}_7\text{O}_4^-\text{(aq)} + \text{H}_3\text{O}^+\text{(aq)}
1. Identifier les deux couples acide-base impliqués.
2. Préciser si l'eau joue le rôle d'un acide ou d'une base.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BAcide phosphorique
✔ REA : Utiliser un modèle
L'acide phosphorique a pour formule \text{H}_3\text{PO}_4.
L'acide phosphorique a pour formule \text{H}_3\text{PO}_4.
1. Sachant que l'atome de phosphore est lié aux quatre atomes d'oxygène \text{O}, donner sa représentation de Lewis.
2. Quelle est la géométrie autour de l'atome de phosphore ?
2. Quelle est la géométrie autour de l'atome de phosphore ?
3. Justifier que l'acide phosphorique est un triacide.
4. Donner la formule brute des bases conjuguées de l'acide phosphorique. Lesquelles peuvent être qualifiées d'amphotères ?
4. Donner la formule brute des bases conjuguées de l'acide phosphorique. Lesquelles peuvent être qualifiées d'amphotères ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Structure et propriétés
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16Pyridine
✔ REA : Utiliser un modèle
✔ RAI/ANA : Construire un raisonnement
La pyridine, contenant un cycle à cinq atomes de carbone et un atome d'azote, a une odeur rappelant celle du poisson. Elle est utilisée comme précurseur en pharmacie ainsi que pour la fabrication d'insecticides.
✔ RAI/ANA : Construire un raisonnement
La pyridine, contenant un cycle à cinq atomes de carbone et un atome d'azote, a une odeur rappelant celle du poisson. Elle est utilisée comme précurseur en pharmacie ainsi que pour la fabrication d'insecticides.

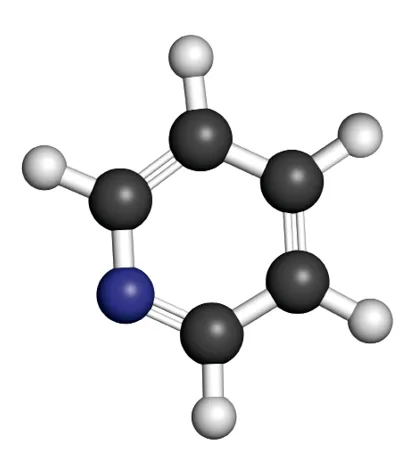
1. Représenter le schéma de Lewis de la pyridine.
2. Préciser si la pyridine peut avoir un caractère acide. Justifier.
Cliquez pour accéder à une zone de dessin
2. Préciser si la pyridine peut avoir un caractère acide. Justifier.
3. Même question pour le caractère basique.
4. Représenter le schéma de Lewis de l'acide conjugué ou de la base conjuguée de la pyridine.
5. Écrire le couple acide-base de la pyridine.
4. Représenter le schéma de Lewis de l'acide conjugué ou de la base conjuguée de la pyridine.
Cliquez pour accéder à une zone de dessin
5. Écrire le couple acide-base de la pyridine.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Acide dans l'huile
✔ RAI/ANA : Construire un raisonnement
L'acide palmitique (ou acide hexadécanoïque) est contenu dans l'huile de palme. Sa formule est
\text{CH}_3(\text{CH}_2)_{14}\text{COOH}.
1. Justifier sa dénomination d'« acide ».
2. Identifier l'atome d'hydrogène responsable du caractère acide.
3. Représenter le schéma de Lewis de sa base conjuguée.
1. Justifier sa dénomination d'« acide ».
2. Identifier l'atome d'hydrogène responsable du caractère acide.
3. Représenter le schéma de Lewis de sa base conjuguée.
Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18Alanine
✔ REA : Utiliser un modèle✔ RAI/ANA : Construire un raisonnement

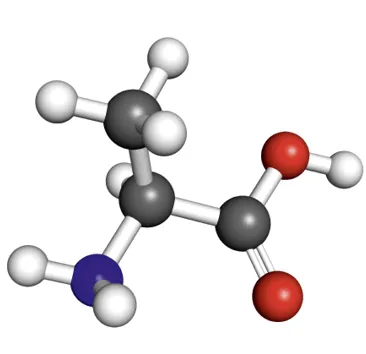
1. L'alanine est l'un des acides aminés les plus fréquents dans les protéines. À l'aide du modèle moléculaire ci-contre, déterminer le schéma de Lewis de l'alanine.
Cliquez pour accéder à une zone de dessin
2. Identifier les groupes caractéristiques de l'alanine.
Ce composé existe en solution aqueuse sous la forme d'un amphion ou ion dipolaire de formule chimique :
3. Justifier le caractère amphotère de l'alanine.
Ce composé existe en solution aqueuse sous la forme d'un amphion ou ion dipolaire de formule chimique :
\text{CH}_3\text{CH}(\text{NH}^+_3)\text{COO}^-\text{(aq)}
3. Justifier le caractère amphotère de l'alanine.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
\textbf{pH} et acidité
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19\textbf{pH} et concentration
✔ REA : Appliquer une formule
✔ VAL : Identifier et évaluer les sources d'erreurs
Camille mesure le \text{pH} d'une eau minérale. Le \text{pH} mesuré est de (7{,}4 \pm 0{,}2). L'étiquette indique qu'elle contient notamment 468 mg·L-1 d'ions calcium \text{Ca}^{2+}\text{(aq)}.
1. Relever l'incertitude de cette mesure. Commenter.
2. Donner un encadrement de la concentration en (mol·L-1) en ion oxonium \text{H}_3\text{O}^+\text{(aq)}. Commenter.
✔ VAL : Identifier et évaluer les sources d'erreurs
Camille mesure le \text{pH} d'une eau minérale. Le \text{pH} mesuré est de (7{,}4 \pm 0{,}2). L'étiquette indique qu'elle contient notamment 468 mg·L-1 d'ions calcium \text{Ca}^{2+}\text{(aq)}.
1. Relever l'incertitude de cette mesure. Commenter.
2. Donner un encadrement de la concentration en (mol·L-1) en ion oxonium \text{H}_3\text{O}^+\text{(aq)}. Commenter.
3. Déterminer la concentration en ion oxonium \text{H}_3\text{O}^+\text{(aq)} en (g·L-1).
4. Comparer les concentrations en ion oxonium \text{H}_3\text{O}^+\text{(aq)} et calcium \text{Ca}^{2+}\text{(aq)}.
Masses molaires atomiques : M(\text{H)} = 1{,}0 g·mol-1, M(\text{O}) = 16{,}0 g·mol-1 et M(\text{Ca}) = 40{,}1 g·mol-1
4. Comparer les concentrations en ion oxonium \text{H}_3\text{O}^+\text{(aq)} et calcium \text{Ca}^{2+}\text{(aq)}.
Données
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20Acide sulfurique dilué
✔ REA : Appliquer une formule✔ RAI/ANA : Construire un raisonnement
Une solution d'acide sulfurique de concentration 8{,}0 \times 10^{-2} mol·L-1 en acide apporté doit être diluée 5 fois afin d'effectuer une expérience. Il est nécessaire de préparer 200{,}0 mL d'acide dilué. L'acide sulfurique réagit totalement avec l'eau selon l'équation :
2\text{H}_2\text{O(l)} + \text{H}_2\text{SO}_4\text{(l)}\longrightarrow 2\text{H}_3\text{O}^ + \text{(aq)} +\text{SO}^{2-}_4\text{(aq)}
1. Déterminer le \text{pH} de la solution mère.
2. Indiquer la verrerie nécessaire à la dilution.
2. Indiquer la verrerie nécessaire à la dilution.
3. Déterminer la concentration en ion oxonium \text{H}_3\text{O}^+\text{(aq)} de la solution diluée.
4. En déduire le \text{pH} de la solution diluée.
4. En déduire le \text{pH} de la solution diluée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21Préparation d'acide nitrique
✔ REA : Appliquer une formule
L'acide nitrique \text{HNO}_3\text{(l)} réagit totalement avec l'eau. On prépare 50{,}0 mL d'une solution aqueuse d'un volume de solution mère contenant 1{,}0 g d'acide nitrique.
1. Déterminer le \text{pH} de la solution réalisée.
2. Prévoir la valeur du \text{pH} si on doublait la quantité d'acide apporté.
L'acide nitrique \text{HNO}_3\text{(l)} réagit totalement avec l'eau. On prépare 50{,}0 mL d'une solution aqueuse d'un volume de solution mère contenant 1{,}0 g d'acide nitrique.
1. Déterminer le \text{pH} de la solution réalisée.
2. Prévoir la valeur du \text{pH} si on doublait la quantité d'acide apporté.
Données
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Vue d'ensemble
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22Ion oxonium
✔ RAI/ANA : Construire un raisonnement
1. Représenter le schéma de Lewis de l'ion oxonium \text{H}_3\text{O}^+ et de l'eau \text{H}_2\text{O}.
2. Justifier qu'ils forment un couple acide-base.
Cliquez pour accéder à une zone de dessin
2. Justifier qu'ils forment un couple acide-base.
3. Préciser la particularité que possède le schéma de Lewis de l'ion oxonium.

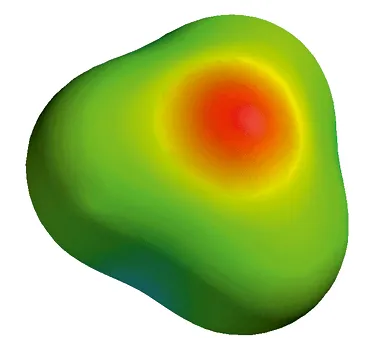
Modélisation du nuage électronique de l'ion oxonium


Modélisation du nuage électronique de l'ion oxonium
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23Acidité du lait
✔ REA : Appliquer une formule
1. Préciser quel est le groupe caractéristique de l'acide lactique.
2. Sachant qu'il possède un groupe hydroxyle (- \: \text{OH}) sur l'atome de carbone intermédiaire, représenter le schéma de Lewis de cet acide.
Cliquez pour accéder à une zone de dessin
3. Le \text{pH} du lait de vache est d'environ 6{,}5. Déterminer la concentration en ion oxonium \text{H}_3\text{O}^+\text{(aq)}.
4. La fermentation du lait diminue la valeur du \text{pH} de la solution. Préciser comment évolue la concentration en ion oxonium \text{H}_3\text{O}^+\text{(aq)}.
5. L'acide réagit avec l'eau et forme l'ion lactate. Représenter le schéma de Lewis de cet ion.
Cliquez pour accéder à une zone de dessin
6. Écrire l'équation de la réaction entre cet acide et l'eau.
Doc.
Acide lactique
L'acide lactique a été isolé du lait aigre en 1780 par C. W. Scheele. En 1808, J. J. Berzelius constate que l'acide lactique est également produit dans des muscles pendant l'effort. En 1856, L. Pasteur découvre le lactobacille et son rôle dans la fabrication de l'acide lactique. L'acide lactique a commencé à être produit commercialement par l'entreprise Boehringer Ingelheim dès 1895. La structure de l'acide lactique a été établie par Wislicenus en 1873. C'est un acide carboxylique de formule brute \text{C}_3\text{H}_6\text{O}_3.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24Molécule putride
✔ REA : Utiliser un modèle
La putrescine, de formule \text{NH}_2(\text{CH}_2)_4\text{NH}_2, est produite lors de la décomposition des corps mais contribue aussi à la mauvaise haleine.
1. Repérer le groupe caractéristique de la putrescine.
1. Repérer le groupe caractéristique de la putrescine.
2. Justifier son (ou ses) caractère(s) acide-base.
3. Écrire la réaction de la putrescine avec l'eau. On considérera la réaction avec une seule molécule d'eau.
3. Écrire la réaction de la putrescine avec l'eau. On considérera la réaction avec une seule molécule d'eau.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25Réaction limitée ou totale ? (1)
✔ RAI/MOD : Modéliser une transformation
Le \text{pH} d'une solution de 100 mL d'acide éthanoïque \text{C}_2\text{H}_4\text{O}_2\text{(aq)}, de concentration en soluté apporté c_\text{A} = 1{,}0 \times 10^{-2} mol·L-1, est égal à 2{,}8.
1. Écrire l'équation de la réaction entre l'acide et l'eau.
2. Établir le tableau d'avancement de cette réaction et déterminer la quantité de matière initiale d'acide.
| Avancement | + | \rightarrow | + | |||||
| État initial | x=0 mol | |||||||
| État final réel | x_\text{f} | |||||||
| État final théorique | x_\text{max} | |||||||
3. En déduire la concentration maximale [\text{H}_3\text{O}^+]_{\text{max}} et calculer le \text{pH} théorique.
4. Conclure quant au caractère total de la réaction.
Données
- Couples acide-base : \text{HCl(aq)}/\text{Cl}^-\text{(aq)},\text{C}_2\text{H}_4\text{O}_2\text{(aq)/C}_2\text{H}_3\text{O}_2^-\text{(aq)}, \text{H}_3\text{O}^+\text{(aq)/H}_2\text{O(l)} et \text{H}_2\text{O(l)/HO}^-\text{(aq)}
- Volume molaire à 20 °C : V_\text{m} = 24{,}0 L·mol-1
- Masses molaires atomiques : M(\text{H}) = 1{,}0 g·mol-1, M(\text{C}) = 12{,}0 g·mol-1 et M(\text{O}) = 16{,}0 g·mol-1
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26Réaction limitée ou totale ? (2)
✔ RAI/MOD : Modéliser une transformation
On prépare 100{,}0 mL de solution en dissolvant 2{,}2 mL de \text{HCl(g)} dans l'eau. Le gaz réagit avec l'eau et le \text{pH} de la solution obtenue est de 3{,}0.
1. Établir le tableau d'avancement de la réaction entre le gaz et l'eau.
| Avancement | + | \rightleftarrows | + | |||||
| État initial | x=0 mol | |||||||
| État final réel | x_\text{f} | |||||||
| État final théorique | x_\text{max} | |||||||
2. En déduire la concentration maximale [\text{H}_3\text{O}^+]_\text{max}.
3. Vérifier que la réaction est totale.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27Réaction limitée ou totale ? (3)
✔ RAI/MOD : Modéliser une transformation
On prépare 250 mL de solution aqueuse en dissolvant dans l'eau pure 500 mg d'acide ascorbique (vitamine C) \text{C}_6\text{H}_8\text{O}_6\text{(s)} en poudre. Le \text{pH} de cette solution vaut 3{,}6.
En le justifiant, conclure quant au caractère total de la réaction entre l'acide ascorbique et l'eau.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

