Chapitre 4
Activité 2 - Activité expérimentale
90 min
Suivi cinétique d'une réaction
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Objectif : Suivre l'évolution temporelle d'une concentration.
Justifier le choix d'un capteur de suivi temporel.
Justifier le choix d'un capteur de suivi temporel.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
Pour étudier une vitesse de réaction, il faut effectuer le suivi de la concentration d'au moins une des espèces chimiques présentes dans l'équation‑bilan.
Comment suivre une transformation impliquant une espèce colorée ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Conditions expérimentales
Les ions peroxodisulfate \text{S}_2\text{O}_8^{2-}(\text{aq}) et les ions iodure \text{I}^-(\text{aq}) réagissent selon l'équation de réaction suivante :
Pour étudier cette réaction, on se propose de suivre la concentration en diiode \text{I}_2(\text{aq}) formé, seule espèce chimique colorée.
Lors de cette expérience, la concentration en iodure de potassium (\text{K}^+(\text{aq}) ; \text{I}^-(\text{aq})) apporté est égale à 5,0 \times 10^{-1} mol·L-1 et celle du peroxodisulfate de potassium (2 \ \text{K}^+(\text{aq}) ; \text{S}_2\text{O}_8^{2-} (\text{aq})) à 5,0 \times 10^{-3} mol·L-1.
\text{S}_2\text{O}_8^{2-}(\text{aq}) + 2 \ \text{I}^-(\text{aq})\rightarrow \ 2\ \text{S}\text{O}_4^{2-}(\text{aq}) + \text{I}_2(\text{aq})
Pour étudier cette réaction, on se propose de suivre la concentration en diiode \text{I}_2(\text{aq}) formé, seule espèce chimique colorée.
Lors de cette expérience, la concentration en iodure de potassium (\text{K}^+(\text{aq}) ; \text{I}^-(\text{aq})) apporté est égale à 5,0 \times 10^{-1} mol·L-1 et celle du peroxodisulfate de potassium (2 \ \text{K}^+(\text{aq}) ; \text{S}_2\text{O}_8^{2-} (\text{aq})) à 5,0 \times 10^{-3} mol·L-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Protocole expérimental
- Verser 10{,}0 mL de solution d'iodure de potassium (\text{K}^+(\text{aq}) ; \text{I}^-(\text{aq})) dans un bécher.
- Prélever avec précision, puis placer dans un second bécher 10,0 mL de solution de peroxodisulfate de potassium (2 \ \text{K}^+(\text{aq}) ; \text{S}_2\text{O}_8^{2-} (\text{aq})).
- Verser le contenu du premier bécher dans le second en déclenchant le chronomètre.
- Agiter pour homogénéiser.
- Remplir rapidement une cuve avec ce mélange et l'introduire dans le spectrophotomètre.
- À l'aide d'une interface, suivre l'absorbance A de la solution en fonction du temps t (200 points de mesure sur une durée totale de 40 min).
- En l'absence d'interface d'acquisition, réaliser la mesure d'absorbance toutes les minutes.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Spectre d'absorption du diiode

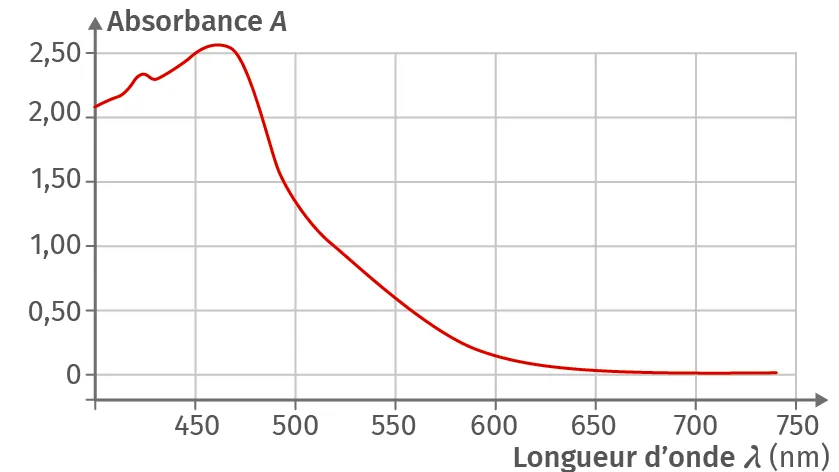
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Temps de demi-réaction
Temps de demi-réaction : pour une réaction totale, il s'agit de la durée, notée t_{1/2}, durant laquelle la concentration du réactif limitant a diminué de moitié. Il peut également être défini comme la durée au bout de laquelle l'avancement de la réaction est passée à la moitié de sa valeur finale.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
REA : Effectuer des mesures avec des capteurs
VAL : Analyser des résultats
VAL : Analyser des résultats
2. Déterminer la longueur d'onde pour le réglage du spectrophotomètre. Effectuer le blanc et les réglages nécessaires.
3. À l'aide d'un tableau d'avancement, déterminer la concentration finale attendue c_{\text{f}} en diiode \text{I}_2 (\text{aq}).
| Avancement | + | \rightarrow | + | |||||
|---|---|---|---|---|---|---|---|---|
| État initial | x=0 mol | |||||||
| État final | x_\text{max} | |||||||
4. Exprimer la concentration [\text{I}_2] en fonction de l'absorbance du milieu réactionnel A, de l'absorbance finale A_\text{f} et de la concentration finale c_{\text{f}}.
5. Tracer l'évolution de la concentration en diiode \text{I}_2(\text{aq}) en fonction du temps t et déterminer le temps de demi-réaction t_{1/2}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
Reprendre l'étude en utilisant des solutions refroidies à l'aide d'un bain de glace. Conclure quant à l'influence de la température sur le temps de demi-réaction.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

