Chapitre 9
Exercices
Pour s'entraîner
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19Calcul du nombre d'insaturations
✔ APP : Extraire l'information utile
L'alizarine est un colorant rouge d'origine végétale, extrait de la racine de la garance des teinturiers, une plante vivace autrefois largement cultivée pour la teinture qu'elle fournissait. L'infanterie métropolitaine française l'a utilisée de 1829 à la Première Guerre mondiale (turban, képi, collets, pantalon). Elle a également la particularité de changer de couleur selon le \text{pH} et peut donc servir d'indicateur coloré dans les réactions acide-base. Elle passe d'une forme rouge à une forme violette. Toutefois, compte tenu de sa zone de virage basique (de 11{,}0 à 12{,}4), elle reste peu employée.



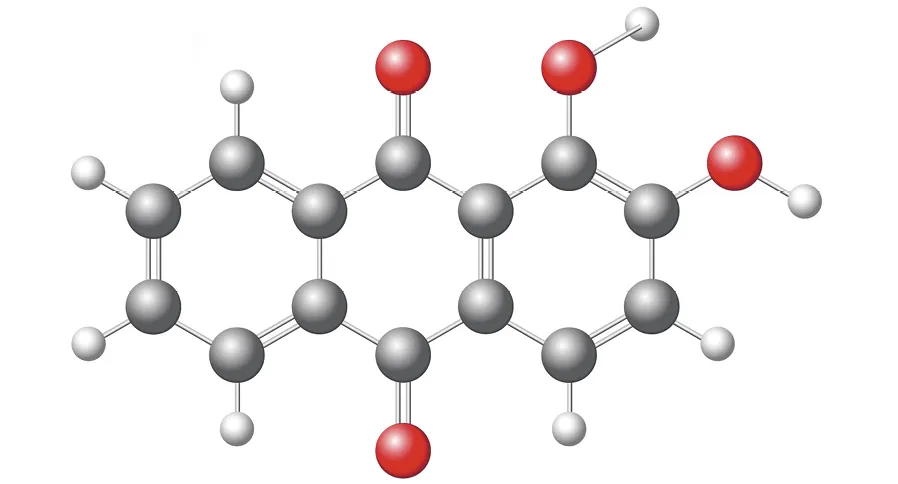
Doc.
Nombre d'insaturationsLe nombre d'insaturations d'une molécule peut se calculer à partir de la formule brute de la molécule par la relation suivante :
N_{\mathrm{i}}=\dfrac{2 N_{\mathrm{C}}+2-N_{\mathrm{H}}+N_{\mathrm{N}}-N_{\mathrm{X}}}{2}
N_\text{i} : nombre d'insaturations
N_\text{C} : nombre d'atomes de carbone
N_\text{H} : nombre d'atomes d'hydrogène
N_\text{N} : nombre d'atomes d'azote
N_\text{X} : nombre d'atomes halogènes
N_\text{C} : nombre d'atomes de carbone
N_\text{H} : nombre d'atomes d'hydrogène
N_\text{N} : nombre d'atomes d'azote
N_\text{X} : nombre d'atomes halogènes
1. Déterminer la formule brute de l'alizarine.
2. Calculer le nombre d'insaturations de cette molécule.
3. Vérifier la cohérence avec le modèle moléculaire en comptant les nombres de cycles et de liaisons multiples
2. Calculer le nombre d'insaturations de cette molécule.
3. Vérifier la cohérence avec le modèle moléculaire en comptant les nombres de cycles et de liaisons multiples
4. Représenter la formule topologique de l'alizarine.
5. Entourer et nommer ses groupes caractéristiques.
Cliquez pour accéder à une zone de dessin
5. Entourer et nommer ses groupes caractéristiques.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20Synthèse de l'éthanoate de linalyle
✔ REA : Respecter les règles de sécurité


L'éthanoate de linalyle est un des composés présents dans l'huile essentielle de lavande. Il peut être extrait directement de la lavande ou synthétisé par estérification entre l'acide éthanoïque et le linalol à l'aide d'un chauffage à reflux.
On utilisera pour cet exercice les règles de nomenclature.
➜
On utilisera pour cet exercice les règles de nomenclature.
➜
1. Représenter la formule topologique de l'acide éthanoïque.
2. Reproduire la formule topologique du linalol et entourer en les nommant ses groupes caractéristiques.
3. Justifier le nom officiel du linalol : 3,7-diméthylocta-1,6-dièn-3-ol.
Cliquez pour accéder à une zone de dessin
2. Reproduire la formule topologique du linalol et entourer en les nommant ses groupes caractéristiques.
Cliquez pour accéder à une zone de dessin
3. Justifier le nom officiel du linalol : 3,7-diméthylocta-1,6-dièn-3-ol.
4. Écrire l'équation-bilan équilibrée de cette estérification.
5. Justifier l'intérêt d'un montage à reflux pour cette synthèse.
Une autre possibilité de synthèse de l'éthanoate de linalyle est de faire réagir le linalol avec l'anhydride éthanoïque \text{C}_4\text{H}_6\text{O}_3\text{(l)} selon l'équation des réactions :
\text{C}_{10} \text{H}_{18} \text{O}\text{(l)}+\text{C}_{4} \text{H}_{6} \text{O}_{3}\text{(l)} \rightarrow \text{C}_{12} \text{H}_{20} \text{O}_{2}\text{(l)}+\text{C}_{2} \text{H}_{4} \text{O}_{2}\text{(l)}
6. Proposer des méthodes d'optimisation de cette synthèse.
7. Préciser les dangers de cette synthèse.
8. Trouver des arguments permettant d'expliquer pourquoi cette transformation est tout de même privilégiée par rapport à l'estérification avec l'acide éthanoïque.
5. Justifier l'intérêt d'un montage à reflux pour cette synthèse.
Une autre possibilité de synthèse de l'éthanoate de linalyle est de faire réagir le linalol avec l'anhydride éthanoïque \text{C}_4\text{H}_6\text{O}_3\text{(l)} selon l'équation des réactions :
\text{C}_{10} \text{H}_{18} \text{O}\text{(l)}+\text{C}_{4} \text{H}_{6} \text{O}_{3}\text{(l)} \rightarrow \text{C}_{12} \text{H}_{20} \text{O}_{2}\text{(l)}+\text{C}_{2} \text{H}_{4} \text{O}_{2}\text{(l)}
6. Proposer des méthodes d'optimisation de cette synthèse.
7. Préciser les dangers de cette synthèse.
8. Trouver des arguments permettant d'expliquer pourquoi cette transformation est tout de même privilégiée par rapport à l'estérification avec l'acide éthanoïque.
Données

| Espèce chimique | Éthanoate de linalyle | Linalol | Acide éthanoïque | Anhydride éthanoïque |
| Sécurité |   |   |     |       |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21Synthèse de l'éthanoate de tert-butyle
✔ RAI/ANA : Construire un raisonnement
L'éthanoate de tert-butyle \text{C}_6\text{H}_{12}\text{O}_2 peut être synthétisé par différentes voies. Par estérification entre l'acide éthanoïque et le 2-méthylpropan-2-ol, le rendement de la transformation est faible (r_1 = 5{,}0 %). Une autre possibilité est de remplacer l'acide éthanoïque par l'anhydride éthanoïque pour un rendement supérieur. Il se forme également, dans ce cas, de l'acide éthanoïque.
1. Calculer la masse m_1 d'éthanoate de tert-butyle synthétisé par estérification par la voie 1.
2. Par la seconde voie de synthèse, il se forme une masse d'ester de 16{,}6 g. Calculer le rendement r_2.
Données
- Masses molaires : M\text{(C)} = 12{,}0 g⋅mol-1, M\text{(H)} = 1{,}0 g⋅mol-1 et M\text{(O)} = 16{,}0 g⋅mol-1
| Espèce chimique | Formule brute | Masse volumique (g⋅mL-1) | Volume initial (mL) | Sécurité |
|---|---|---|---|---|
| Acide éthanoïque | \text{C}_2\text{H}_4\text{O}_2 | 1,05 | 15 |
    |
| 2-méthylpropan-2-ol | \text{C}_4\text{H}_{10}\text{O} | 0,790 | 25 |
    |
| Anhydride éthanoïque | \text{C}_4\text{H}_6\text{O}_3 | 1,08 | 15 |
    |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22Polycaprolactame
✔ APP : Extraire l'information utile
Les lactames sont une famille de composés organiques caractérisés par un groupe caractéristique amide inclus dans un cycle carboné. Le caprolactame fait partie de cette famille. Cette molécule artificielle comprend sept atomes dans son cycle, sans double liaison et sans autre groupe caractéristique. Par ouverture du cycle au niveau du groupement amide, puis par polycondensation, le caprolactame est polymérisé en chaîne à une température de 269 °C et sous atmosphère inerte de diazote. On obtient alors le polycaprolactame.
1. Représenter la formule topologique du monomère dont est issu le polycaprolactame.
Cliquez pour accéder à une zone de dessin
2. Représenter la formule topologique du motif du
polycaprolactame.
Cliquez pour accéder à une zone de dessin
3. Donner des moyens d'optimiser cette polymérisation.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23Réaction de saponification
✔ APP : Maîtriser le vocabulaire du cours
La saponification est une réaction totale mais cinétiquement lente. Au cours de cette réaction, des triglycérides (graisses ou huiles) sont hydrolysés en milieu basique, à une température comprise entre 80 °C et 100 °C selon l'équation-bilan suivante :


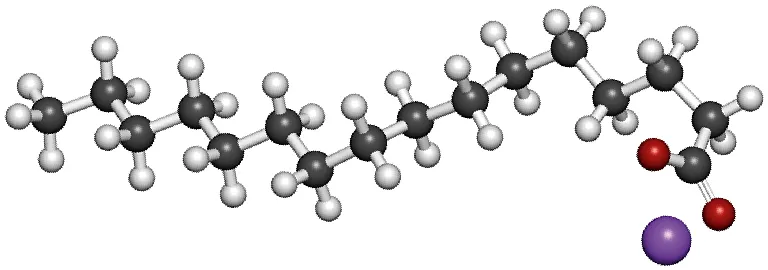
Doc.
\text{R} désigne une suite d'atomes.

Doc.
Palmitate de sodium.


1. Schématiser et légender le montage utilisé pour réaliser la saponification.
2. Justifier le fait que le triglycéride est un triester.
Cliquez pour accéder à une zone de dessin
2. Justifier le fait que le triglycéride est un triester.
3. Représenter la formule topologique du triglycéride permettant d'obtenir l'ion palmitate.
4. Justifier le nom du propane-1,2,3-triol également obtenu à partir des règles de nomenclature.
5. Expliquer pourquoi le mélange est chauffé.
6. Proposer des méthodes d'optimisation de la saponification.
Cliquez pour accéder à une zone de dessin
4. Justifier le nom du propane-1,2,3-triol également obtenu à partir des règles de nomenclature.
5. Expliquer pourquoi le mélange est chauffé.
6. Proposer des méthodes d'optimisation de la saponification.
Détails du barèmeTOTAL / 6,5 pts
2 pts
1. Faire un schéma propre et légendé du montage.0,5 pt
2. Justifier de manière argumentée.1 pt
3. Écrire la formule topologique.1 pt
4. Utiliser les règles de nomenclature pour justifier le nom du trialcool.1 pt
5. Justifier le chauffage du mélange réactionnel.1 pt
6. Lister des méthodes.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24
Copie d'élève à commenter
Proposer une justification pour chaque erreur relevée par le correcteur.
L'aspartame est un édulcorant artificiel découvert en 1965. Il a un pouvoir sucrant environ deux cents fois supérieur à celui du saccharose et est utilisé pour édulcorer les boissons et aliments à faible apport calorique, ainsi que les médicaments. Cet additif alimentaire est autorisé dans de nombreux pays, il est référencé dans l'Union européenne par le code E951. Sa formule topologique est :

1. Déterminer la formule brute de l'aspartame.
2. Préciser si le saccharose de formule brute \text{C}_{12}\text{H}_{22}\text{O}_{12} est un isomère de constitution de l'aspartame.
L'aspartame est un édulcorant artificiel découvert en 1965. Il a un pouvoir sucrant environ deux cents fois supérieur à celui du saccharose et est utilisé pour édulcorer les boissons et aliments à faible apport calorique, ainsi que les médicaments. Cet additif alimentaire est autorisé dans de nombreux pays, il est référencé dans l'Union européenne par le code E951. Sa formule topologique est :

1. Déterminer la formule brute de l'aspartame.
La formule brute de l'aspartame est
\text{C}_{14}\text{N}_2\text{O}_2. Incomplet !
2. Préciser si le saccharose de formule brute \text{C}_{12}\text{H}_{22}\text{O}_{12} est un isomère de constitution de l'aspartame.
Le saccharose est un isomère de l'aspartame, car ils ont les mêmes propriétés chimiques. Non
3. Reproduire la formule topologique, entourer et nommer les groupes caractéristiques de cette molécule.



Cliquez pour accéder à une zone de dessin


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25Kevlar
✔ REA : Appliquer une formule
Le kevlar est une fibre synthétique appartenant à la famille des aramides. Sa formule topologique condensée est :

Sa résistance mécanique et à la chaleur est supérieure à celle du nylon et même à celle de l'acier, mais inférieure tout de même à celle des fibres de carbone. Cela est dû au fait qu'il possède une structure cristalline. En effet, grâce aux nombreux ponts hydrogène, les chaînes polymères sont bien alignées, régulières et orientées.


1. Citer une application du kevlar.
2. Rappeler ce qu'est un pont hydrogène.
3. Justifier la résistance du kevlar.
4. Représenter la formule semi-développée du motif.
2. Rappeler ce qu'est un pont hydrogène.
3. Justifier la résistance du kevlar.
4. Représenter la formule semi-développée du motif.
Cliquez pour accéder à une zone de dessin
5. Calculer la masse molaire du motif de kevlar.
6. Des mesures de masses molaires moléculaires d'un échantillon de kevlar ont été effectuées et regroupées dans un tableau (). Calculer le degré de polymérisation moyen de cet échantillon.
6. Des mesures de masses molaires moléculaires d'un échantillon de kevlar ont été effectuées et regroupées dans un tableau (). Calculer le degré de polymérisation moyen de cet échantillon.
Doc. 1
Degré de polymérisation
Le degré de polymérisation DP d'un polymère correspond au nombre de motifs constitutifs. Il traduit, en quelque sorte, la longueur du polymère.
Toutefois, un matériau en polymère est rarement constitué de macromolécules de même degré de polymérisation. En effet, ce degré varie très fortement d'un polymère à l'autre. On utilise donc plutôt la notion de degré de polymérisation moyen, noté DP_\text{m}, qui correspond au rapport entre la masse molaire moyenne M_\text{m} du polymère et la masse molaire du motif M_0 :
D P_{m}=\dfrac{M_{m}}{M_{0}}
À titre d'information, les masses molaires de la plupart des polymères synthétisés varient entre 10^4 et 10^6 g·mol-1.
D'après Wikipedia.org.
Doc. 2
Résultats expérimentaux
| Mesure | 1 | 2 | 3 | 4 | 5 | 6 |
| Masse molaire \bm M (\bold{\times 10^3} g·mol‑1) | 19,0 | 17,9 | 18,6 | 19,8 | 19,5 | 18,8 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26Choix d'une isolation
✔ APP : Extraire l'information utile
L'isolation thermique est devenue une priorité afin d'économiser de l'énergie et éviter les pertes d'énergie thermique vers le milieu extérieur. Plusieurs types de matériaux sont utilisés avec un impact plus ou moins important sur l'environnement.
Les isolants à base de textiles recyclés sont composés d'environ 70 % de coton, 15 % de textiles synthétiques (polyamide, polyester, etc.), auxquels on ajoute 15 % de liant sous forme de fibres polyester. Ces isolants ont un fort impact positif sur l'environnement. Le textile recyclé permet une isolation thermique et phonique efficace des bâtiments.
Les isolants à base de textiles recyclés sont composés d'environ 70 % de coton, 15 % de textiles synthétiques (polyamide, polyester, etc.), auxquels on ajoute 15 % de liant sous forme de fibres polyester. Ces isolants ont un fort impact positif sur l'environnement. Le textile recyclé permet une isolation thermique et phonique efficace des bâtiments.
D'après « Isolation polystyrène », CrépiCentre.fr.


Les produits d'isolation en plastiques alvéolaires sont d'origine organique et synthétique. La fabrication du polystyrène expansé est effectuée par expansion à la vapeur d'eau des billes de polystyrène pour former un isolant à structure cellulaire fermée et remplie de pentane résultant de l'expansion de la bille. La fabrication du polystyrène extrudé est effectuée à partir de billes de monomère styrène mélangées et extrudées avec un agent gonflant.


1. Le textile recyclé est constitué en partie de polyamide et de polyester. Représenter les groupes caractéristiques constituant ces molécules.
La formule topologique du styrène, monomère du polystyrène, est la suivante :

2. Préciser si le styrène possède des groupes caractéristiques.
3. Représenter la formule semi-développée du styrène. En déduire sa formule brute.
Cliquez pour accéder à une zone de dessin
La formule topologique du styrène, monomère du polystyrène, est la suivante :

2. Préciser si le styrène possède des groupes caractéristiques.
3. Représenter la formule semi-développée du styrène. En déduire sa formule brute.
Cliquez pour accéder à une zone de dessin
4. Représenter un isomère de constitution du styrène.
5. Expliquer pour quelles raisons il faut rapporter les vêtements qui ne sont plus portés dans des bennes de récupération de textiles.
6. Proposer un argumentaire mettant en avant les avantages d'une isolation à partir de textiles recyclés par rapport à une isolation au polystyrène.
Cliquez pour accéder à une zone de dessin
5. Expliquer pour quelles raisons il faut rapporter les vêtements qui ne sont plus portés dans des bennes de récupération de textiles.
6. Proposer un argumentaire mettant en avant les avantages d'une isolation à partir de textiles recyclés par rapport à une isolation au polystyrène.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27Incertitude sur le rendement
✔ VAL : Évaluer les incertitudes
L'acétate d'isoamyle est un ester synthétisé à partir de l'acide acétique et de l'alcool isoamylique. Il possède une odeur de banane. Il est présent dans les pommes mûres. Il est utilisé dans la fabrication de peintures ou comme agent de saveur. C'est aussi la phéromone d'alarme de l'abeille. L'équation-bilan de la transformation est :

Cette transformation chimique est lente, équilibrée et athermique.
On introduit dans un ballon 15 mL d'acide acétique et 20 mL d'alcool isoamylique. On ajoute des grains de pierre ponce et quelques gouttes d'acide sulfurique concentré. L'ensemble est porté à une température de 50 °C. Après 30 min, on isole le mélange réactionnel et on récupère 20 mL d'acétate d'isoamyle à l'aide d'une éprouvette graduée.
1. Nommer l'acide acétique, l'alcool isoamylique et l'acétate d'isoamyle selon les règles de nomenclature.
2. Calculer le rendement de la transformation chimique.
3. Calculer l'incertitude-type de ce rendement.
4. Préciser les méthodes utilisées pour optimiser la synthèse.
Données
- Densités : d(\text{C}_2\text{H}_4\text{O}_2) = 1{,}05, d(\text{C}_5\text{H}_{12}\text{O}) = 0{,}810 et d(\text{C}_7\text{H}_{14}\text{O}_2) = 0{,}870
- Masses molaires : M\text{(C)} = 12{,}0 g⋅mol-1, M\text{(H)} = 1{,}0 g⋅mol-1 et M\text{(O)} = 16{,}0 g⋅mol-1
- Incertitude de l'éprouvette graduée \bold{50} mL : \pm 1 mL
- Formule de l'incertitude-type du rendement : \frac{u(r)}{r}=\sqrt{\left(\frac{u\left(V_{\mathrm{alcool}}\right)}{V_{\mathrm{alcool}}}\right)^{2}+\left(\frac{u\left(V_{\mathrm{ester}}\right)}{V_{\mathrm{ester}}}\right)^{2}}
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

