Chapitre 8
Exercices
Objectif Bac
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30Électrolyse du chlorure de magnésium
✔ RAI/ANA : Communiquer sur les étapes de résolution
✔ COM : Rédiger un compte-rendu scientifiquement rigoureux
✔ COM : Rédiger un compte-rendu scientifiquement rigoureux
Le magnésium est un métal très utilisé dans le domaine de l'automobile. Sa production au début du XXe siècle est décrite de la façon suivante dans la revue Le mois chimique et électrochimique :
« Le bain [électrolyte] est composé d'un mélange de chlorure de magnésium (\text{Mg}^{2+}(\text{l}) \; ; \; 2\; \text{Cl}^-(\text{l})) et de chlorure de potassium (\text{K}^+(\text{l}) \; ; \; \text{Cl}^-(\text{l})) fondu à une température d'environ 700 °C. La cathode est en graphite, elle forme aussi le creuset (récipient) de l'électrolyse et l'anode est une tige verticale, elle aussi en graphite. Le courant utilisé est d'intensité 150 A et la tension est de 30 V. Ce courant permet de garder le mélange en fusion, le magnésium métallique formé est sous forme liquide et surnage dans le creuset. Un dégagement gazeux de dichlore est aussi obtenu. »
1. Écrire les demi-équations aux électrodes.
« Le bain [électrolyte] est composé d'un mélange de chlorure de magnésium (\text{Mg}^{2+}(\text{l}) \; ; \; 2\; \text{Cl}^-(\text{l})) et de chlorure de potassium (\text{K}^+(\text{l}) \; ; \; \text{Cl}^-(\text{l})) fondu à une température d'environ 700 °C. La cathode est en graphite, elle forme aussi le creuset (récipient) de l'électrolyse et l'anode est une tige verticale, elle aussi en graphite. Le courant utilisé est d'intensité 150 A et la tension est de 30 V. Ce courant permet de garder le mélange en fusion, le magnésium métallique formé est sous forme liquide et surnage dans le creuset. Un dégagement gazeux de dichlore est aussi obtenu. »
1. Écrire les demi-équations aux électrodes.
2. En déduire l'équation de la réaction d'électrolyse.
3. Calculer la durée de l'électrolyse nécessaire à la production de \text{1,00} kg de magnésium \text{Mg(l)}.
4. Sachant que le rendement de l'électrolyse dans ces conditions est de 60 %, préciser la masse de magnésium réellement obtenue.
3. Calculer la durée de l'électrolyse nécessaire à la production de \text{1,00} kg de magnésium \text{Mg(l)}.
4. Sachant que le rendement de l'électrolyse dans ces conditions est de 60 %, préciser la masse de magnésium réellement obtenue.
Données
- Couples d'oxydoréduction : \text{Mg}^{2+}\text{(l)/Mg(l)} et \text{Cl}_2 (\text{g})/\text{Cl}^-(\text{l})
- Masse molaire du magnésium : M(\text{Mg}) = 24{,}3 g·mol-1
- Masse volumique du magnésium : \rho(\text{Mg}) = 1{,}72 g·cm-3
- Constante de Faraday : : F = 9{,}65 \times 10^4 C·mol-1
Détails du barème
TOTAL / 6 pts
1 pt
1. Savoir écrire les demi-équations
électrochimiques aux électrodes.0,5 pt
1. Connaître la définition d'anode et de cathode.0,5 pt
2. Modéliser une réaction chimique par une
équation.1 pt
3. Calculer une quantité de matière.1 pt
3. Déterminer la quantité d'électrons échangés.1,5 pt
3. Calculer le temps de l'électrolyse.0,5 pt
4. Comprendre la notion de rendement.➜ Retrouvez plus d'exercices dans le
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31Affinage du cuivre dans l'industrie
✔ VAL : Faire preuve d'esprit critique
✔ VAL : Utiliser et interpréter des documents
La source la plus courante de minerai de cuivre est la chalcopyrite qui, par traitement, donne un métal contenant près de \text{99,0} % de cuivre et des traces de fer, de nickel, mais aussi d'argent.
Afin d'augmenter la teneur en cuivre jusqu'à \text{99,9} %, une électrolyse à anode soluble peut être effectuée en utilisant comme électrolyte une solution de sulfate de cuivre (\text{Cu}^{2+}(\text{aq}) \; ; \; \text{SO}_4^{2-}(\text{aq})) acidifiée. L'anode est constituée du métal impur qui se transforme en ion cuivre \text{Cu}^{2+}(\text{aq}) et la cathode d'une plaque fine de cuivre pur sur laquelle vient se déposer une couche supplémentaire de cuivre métallique. Les impuretés tombent au fond de l'électrolyseur : on les appelle des boues.
Dans une usine spécialisée, l'électrolyse s'effectue dans une très grande cuve contenant 24 anodes de cuivre impur reliées en série entre elles, 23 cathodes de cuivre pur elles-mêmes en série et un courant d'intensité \text{5 000} A est produit durant 14 jours non-stop.
Le rendement d'une telle électrolyse est d'environ 83 %, c'est-à-dire que la masse de cuivre pur obtenue ne représente que 83 % de la masse prévue par la théorie.
✔ VAL : Utiliser et interpréter des documents
La source la plus courante de minerai de cuivre est la chalcopyrite qui, par traitement, donne un métal contenant près de \text{99,0} % de cuivre et des traces de fer, de nickel, mais aussi d'argent.
Afin d'augmenter la teneur en cuivre jusqu'à \text{99,9} %, une électrolyse à anode soluble peut être effectuée en utilisant comme électrolyte une solution de sulfate de cuivre (\text{Cu}^{2+}(\text{aq}) \; ; \; \text{SO}_4^{2-}(\text{aq})) acidifiée. L'anode est constituée du métal impur qui se transforme en ion cuivre \text{Cu}^{2+}(\text{aq}) et la cathode d'une plaque fine de cuivre pur sur laquelle vient se déposer une couche supplémentaire de cuivre métallique. Les impuretés tombent au fond de l'électrolyseur : on les appelle des boues.
Dans une usine spécialisée, l'électrolyse s'effectue dans une très grande cuve contenant 24 anodes de cuivre impur reliées en série entre elles, 23 cathodes de cuivre pur elles-mêmes en série et un courant d'intensité \text{5 000} A est produit durant 14 jours non-stop.
Le rendement d'une telle électrolyse est d'environ 83 %, c'est-à-dire que la masse de cuivre pur obtenue ne représente que 83 % de la masse prévue par la théorie.
1. Schématiser une électrolyse simplifiée en ne représentant qu'une anode et une cathode, les bornes du générateur, le sens de déplacement des électrons et des ions et le nom des électrodes.
2. Écrire les demi-équations aux électrodes.
3. Justifier l'emploi des termes « anode soluble ».
Cliquez pour accéder à une zone de dessin
2. Écrire les demi-équations aux électrodes.
3. Justifier l'emploi des termes « anode soluble ».
4. Préciser comment évolue la concentration en ion \text{Cu}^{2+}(\text{aq}) de l'électrolyte.
5. Calculer la charge électrique circulant dans cette cuve lors d'une électrolyse complète.
6. En déduire la masse de cuivre pouvant théoriquement être obtenue.
7. Calculer la masse de cuivre réelle. Proposer une explication à cette différence.
5. Calculer la charge électrique circulant dans cette cuve lors d'une électrolyse complète.
6. En déduire la masse de cuivre pouvant théoriquement être obtenue.
7. Calculer la masse de cuivre réelle. Proposer une explication à cette différence.
Données
- Masse molaire du cuivre : M(\text{Cu}) = 63{,}5 g·mol-1
- Constante de Faraday : F = 9{,}65 × 10^4 C·mol-1
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
32Retour du disque vinyle
✔ RAI/ANA : Construire un raisonnement
✔ APP : Extraire l'information utile
✔ APP : Extraire l'information utile
Les disques vinyle font leur grand retour chez les amateurs de musique. Les fabricants, notamment français, ont dû relancer leur production et former du personnel.
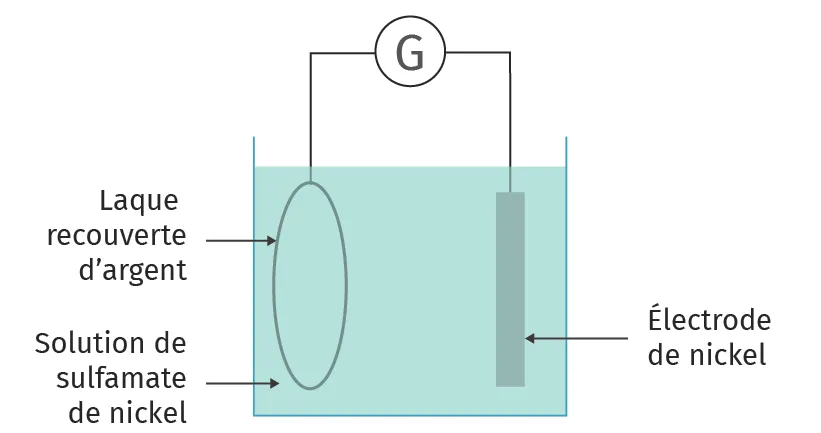
1. Compléter le schéma de galvanoplastie () en ajoutant les pôles du générateur, le sens de déplacement des porteurs de charge et le nom des électrodes.
1. Compléter le schéma de galvanoplastie () en ajoutant les pôles du générateur, le sens de déplacement des porteurs de charge et le nom des électrodes.
2. Écrire les demi-équations aux électrodes.
3. Vérifier par un calcul la masse de la matrice père en nickel obtenue.
4. En déduire la quantité de matière de nickel nécessaire pour former la matrice père.
5. Calculer l'intensité utilisée lors de cette galvanoplastie.
3. Vérifier par un calcul la masse de la matrice père en nickel obtenue.
4. En déduire la quantité de matière de nickel nécessaire pour former la matrice père.
5. Calculer l'intensité utilisée lors de cette galvanoplastie.
Doc. 1
Fabrication d'un disque vinyleLa musique est gravée sous forme de sillons sur un support appelé laque. Ce support est ensuite pulvérisé d'argent sur la face gravée pour le rendre conducteur d'électricité. Vient ensuite la galvanoplastie dans un bain de sulfamate de nickel (contenant des ions \text{Ni}^{2+}(\text{aq})) pendant une heure pour que la laque se couvre d'une couche de nickel métallique très fine : c'est ce que l'on appelle la matière père (négatif du moule, car les sillons sont en relief). La phase délicate est la séparation de la très fine couche de nickel de la laque : la moindre rayure, et tout est à refaire ! La même opération est réalisée sur le père pour obtenir un moule où le sillon est en creux : c'est la matrice mère permettant de refaire d'autres pères. Ensuite, la matrice père sert au pressage du disque.
Découvrez la fabrication d'un vinyle en vidéo en .
Doc. 2
Matrice pèreDiamètre de la matrice : D = 30{,}0 cm.
Masse de la matrice : m = 126 g.
Épaisseur de la matrice : e = 200 μm.
Doc. 3
Schéma de la galvanoplastie
Données
- Couple d'oxydoréduction : \text{Ni}^{2+}\text{(aq)/Ni(s)}
- Masse molaire du nickel : M(\text{Ni}) = 58{,}7 g·mol‑1
- Masse volumique du nickel : \rho(N\text{i}) = 8{,}90 g·cm‑3
- Constante de Faraday : F = 9{,}65 \times 10^4 C·mol‑1
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
33Traitement de l'eau d'une piscine
✔ COM : Rédiger correctement une résolution d'exercice
✔ APP : Faire des prévisions à l'aide d'un modèle


Une piscine au sel fonctionne sur le principe de l'électrolyse d'une solution de chlorure de sodium (\text{Na}^+(\text{aq}) \; ; \; \text{Cl}^-(\text{aq})). L'eau est pompée et envoyée dans l'électrolyseur. La réaction ayant lieu aux électrodes est modélisée par l'équation :
✔ APP : Faire des prévisions à l'aide d'un modèle
Doc. 1
Piscine au sel

Une piscine au sel fonctionne sur le principe de l'électrolyse d'une solution de chlorure de sodium (\text{Na}^+(\text{aq}) \; ; \; \text{Cl}^-(\text{aq})). L'eau est pompée et envoyée dans l'électrolyseur. La réaction ayant lieu aux électrodes est modélisée par l'équation :
2 \ \text{H}_2\text{O(l)} + 2\ \text{Cl}^-(\text{aq}) \rightarrow \text{H}_2(\text{g}) + \text{Cl}_2(\text{g}) + 2\ \text{HO}^-(\text{aq})
Les ions hydroxyde \text{HO}^-(\text{aq}) et le dichlore \text{Cl}_2(\text{g}) réagissent selon l'équation :
Les ions hypochlorite \text{ClO}^-(\text{aq}) ont une action désinfectante. Sous l'action du rayonnement solaire, la réaction chimique s'inverse et les ions hypochlorite \text{ClO}^-(\text{aq}) se transforment en ion chlorure \text{Cl}^-(\text{aq}). Ainsi, l'eau de ces piscines ne sent pas le chlore.
\text{Cl}_2(\text{g}) + 2\ \text{HO}^-(\text{aq}) \rightarrow \text{ClO}^-(\text{aq}) + \text{Cl}^-(\text{aq}) + \text{H}_2\text{O(l)}
Les ions hypochlorite \text{ClO}^-(\text{aq}) ont une action désinfectante. Sous l'action du rayonnement solaire, la réaction chimique s'inverse et les ions hypochlorite \text{ClO}^-(\text{aq}) se transforment en ion chlorure \text{Cl}^-(\text{aq}). Ainsi, l'eau de ces piscines ne sent pas le chlore.
Doc. 2
Données du fabricant
Tension d'alimentation : U = 230 V.
Température de fonctionnement : de -10 °C à 45 °C.
Volume d'eau de la piscine : V_\text{max} = 100 m3.
Température de fonctionnement : de -10 °C à 45 °C.
Volume d'eau de la piscine : V_\text{max} = 100 m3.
Production de dichlore \text{Cl}_2(\text{g}) actif : 30 g·h-1.
Intensité de fonctionnement : I = 22 A.
Les électrodes utilisées sont en titane.
Intensité de fonctionnement : I = 22 A.
Les électrodes utilisées sont en titane.
1. Écrire les demi-équations aux électrodes.
2. Schématiser cette électrolyse pouvant être réalisée au laboratoire. Indiquer les bornes du générateur, le nom des électrodes, les réactions électrochimiques, le sens de circulation des électrons.
Cliquez pour accéder à une zone de dessin
3. Vérifier le taux de dichlore \text{Cl}_2(\text{g}) produit par heure.
Données
- Masse molaire du chlore : M(\text{Cl}) = 35{,}5 g·mol-1
- Solubilité du dichlore dans l'eau à 20 °C : s = 7{,}3 g·L-1
- Constante de Faraday : F = 9{,}65 \times 10^4 C·mol-1
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

