Chapitre 8
Exercices
Pour s'échauffer - Pour commencer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour s'échauffer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5Réaction forcée
Une pile réalise la réaction d'équation suivante :
\text{Cd(s)} + \text{Cu}^{2+}(\text{aq}) \rightarrow \text{Cd}^{2+}(\text{aq}) + \text{Cu(s)}
Écrire l'équation de la réaction forcée entre les deux mêmes couples d'oxydoréduction.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6Équation de réaction d'électrolyse
Lors d'une électrolyse, les réactions électrochimiques aux électrodes sont\text{Ni(s)} \rightarrow \text{Ni}^{2+}(\text{aq}) + 2\ \text{e}^- et \text{Zn}^{2+}(\text{aq}) + 2\ \text{e}^- \rightarrow \text{Zn(s)}
Écrire l'équation de la réaction d'électrolyse.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7Équation d'électrolyse avec les couples
À l'état liquide, le chlorure de calcium \text{CaCl}_2(\text{l}) n'est constitué que d'ions faisant partie des couples \text{Ca}^{2+}(\text{l})/\text{Ca(s)} et \text{Cl}_2(\text{g})/\text{Cl}^-(\text{l}).
Écrire l'équation de la réaction d'électrolyse du chlorure de calcium liquide.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8Réactions aux électrodes
La réaction d'électrolyse d'une solution de chlorure de
fer (III) est :
2\ \text{Cl}^-(\text{aq}) + 2\ \text{Fe}^{3+}(\text{aq}) \rightarrow \text{Cl}_2(\text{g}) + 2\ \text{Fe}^{2+}(\text{aq})
Écrire les demi-équations électrochimiques aux électrodes et les couples d'oxydoréduction mis en jeu.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9Charge électrique
Calculer la charge électrique Q débitée durant l'électrolyse d'une solution de chlorure de sodium (\text{Na}^+(\text{aq}) \ ; \ \text{Cl}^-(\text{aq})) pendant 5 min avec un courant d'intensité 25 mA.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10Quantité d'électrons transférés
La demi-équation électrochimique à la cathode d'un électrolyseur est \text{Al}^{3+}(\text{aq}) + 3\ \text{e}^- \rightarrow \text{Al(s)}
Écrire la quantité d'électrons transférés n_\text{e} en fonction de la quantité de matière d'aluminium formé.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour commencer
Réactions aux électrodes
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11Demi-équations aux électrodes
✔ RAI/MOD : Modéliser une transformation




Une solution aqueuse de bromure de cuivre (II) (\text{Cu}^{2+}(\text{aq}) ; 2\ \text{Br}^-(\text{aq})) est électrolysée avec des électrodes en graphite. Le dibrome est orange en solution aqueuse.
1. Écrire les demi-équations des réactions aux électrodes.
2. Écrire l'équation de la réaction d'électrolyse.
3. Décrire les observations pouvant être faites au niveau des électrodes.
Couples d'oxydoréduction : \text{Cu}^{2+}\text{(aq)/Cu(s)} et \text{Br}_2
(\text{aq)/Br}^-(\text{aq})
1. Écrire les demi-équations des réactions aux électrodes.
2. Écrire l'équation de la réaction d'électrolyse.
3. Décrire les observations pouvant être faites au niveau des électrodes.
Donnée
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12Identification d'électrodes
✔ APP : Faire un schéma
L'électrolyse d'une solution aqueuse de sulfate de cuivre (\text{Cu}^{2+}(\text{aq}) \ ; \ \text{SO}_4^{2-}(\text{aq})) est réalisée dans un bécher avec deux électrodes en graphite ne réagissant pas. Après quelques minutes, l'une des électrodes se couvre d'une couche de cuivre métallique et à l'autre électrode est observé un dégagement gazeux de dioxygène.
1. Écrire les demi-équations électrochimiques aux électrodes, les ions sulfate étant spectateurs.
2. Faire un schéma du montage d'électrolyse en précisant les bornes du générateur, le sens des électrons dans les fils, le nom des électrodes et en représentant les transformations observées à leur surface.
Cliquez pour accéder à une zone de dessin
3. Écrire l'équation de la réaction d'électrolyse.
Donnée
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13Recharge d'un accumulateur \text{Ni-Cd}
✔ APP : Extraire l'information utile


Les accumulateurs nickel-cadmium ont été pendant longtemps les piles rechargeables les plus utilisées. Elles sont dorénavant interdites d'utilisation dans l'Union européenne.
Lorsque la pile se décharge, la réaction de fonctionnement est :
Le milieu interne de la pile rechargeable étant basique, la réaction à l'une des électrodes est alors :
Lorsque la pile se décharge, la réaction de fonctionnement est :
\text{Cd(s)} + 2\ \text{NiO(OH)(s)} + 2\ \text{H}_2\text{O(l)} \rightarrow \text{Cd(OH)}_2(\text{s}) + 2\ \text{Ni(OH)}_2(\text{s})
Le milieu interne de la pile rechargeable étant basique, la réaction à l'une des électrodes est alors :
\text{Cd(s)} + 2\ \text{HO}^-(\text{aq}) \rightarrow \text{Cd(OH)}_2(\text{s}) + 2\ \text{e}^-
1. Écrire les équations de réaction électrochimique aux deux électrodes lors de la recharge de l'accumulateur \text{Ni-Cd}.
2. En déduire les deux couples d'oxydoréduction mis en jeu.
2. En déduire les deux couples d'oxydoréduction mis en jeu.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Sens d'évolution
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14Évolution du quotient de réaction
✔ APP : Faire des prévisions à l'aide d'un modèle
On réalise le mélange suivant à volume égal :
- solution de sulfate de fer (II) (\text{Fe}^{2+}(\text{aq}) \ ; \ \text{SO}_4^{2-}(\text{aq})) de concentration en ion \text{Fe}^{2+}(\text{aq}) égale à [\text{Fe}^{2+}] = 1 \times 10^{-2} mol·L‑1 ;
- solution de sulfate de cérium (IV) (\text{Ce}^{4+}(\text{aq}) \ ; \ 2\ \text{SO}_4^{2-}(\text{aq})) de concentration en ion \text{Ce}^{4+} égale à [\text{Ce}^{4+}] = 1 \times 10^{-2} mol·L-1.
1. Écrire l'équation de réaction possible entre les ions \text{Fe}^{2+} et les ions \text{Ce}^{4+}.
2. Calculer le quotient de réaction initial Q_{\text{r,i}} de ce mélange.
3. Préciser le sens d'évolution spontané du système sachant que la constante d'équilibre est égale à K = 5 \times 10^{15}.
2. Calculer le quotient de réaction initial Q_{\text{r,i}} de ce mélange.
3. Préciser le sens d'évolution spontané du système sachant que la constante d'équilibre est égale à K = 5 \times 10^{15}.
On plonge dans le mélange deux électrodes inattaquables en graphite reliées à un générateur de courant continu.
4. a. Préciser le sens d'évolution du quotient de réaction Q_{\text{r}}.
b. Écrire l'équation de la réaction alors observée.
Couples d'oxydoréduction : \text{Fe}^{3+}\text{(aq)}/\text{Fe}^{2+}(\text{aq}) et \text{Ce}^{4+}(\text{aq})/\text{Ce}^{3+}(\text{aq})
4. a. Préciser le sens d'évolution du quotient de réaction Q_{\text{r}}.
b. Écrire l'équation de la réaction alors observée.
Donnée
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15Prévision du sens d'évolution
✔ RAI/ANA : Utiliser et interpréter des documents
On introduit dans un bécher 50 mL d'une solution bleue de sulfate de cuivre (II) à 0,20 mol·L‑1 en soluté apporté et 50 mL d'une solution de sulfate de zinc (II) de même concentration.
On y plonge alors une lame de zinc et une lame de cuivre :


1. À partir de vos observations, écrire l'équation de réaction associée à cette transformation.
2. Déterminer le quotient de réaction Q_{\text{r,i}} à l'état initial.
3. Montrer que les observations expérimentales
confirment le sens d'évolution spontané du système.
4. Un générateur de courant continu est branché entre les deux électrodes, la borne négative étant connectée à la lame de zinc. Préciser le sens d'évolution du système chimique.
Constante d'équilibre de la réaction : K = 10^{37}
4. Un générateur de courant continu est branché entre les deux électrodes, la borne négative étant connectée à la lame de zinc. Préciser le sens d'évolution du système chimique.
Donnée
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Variation de quantités de matière
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16Quantité d'électrons échangés
✔ VAL : Analyser des résultats
Pour déposer une couche d'argent métallique sur un objet, l'électrolyse d'une solution aqueuse de nitrate d'argent (\text{Ag}^+(\text{aq})\ ; \ \text{NO}^{3-}(\text{aq})) de concentration [\text{Ag}^+] = 2,0 \times 10^{-2} mol·L-1 peut être réalisée. L'objet à recouvrir est placé à la cathode, l'intensité du courant est maintenue constante à 120 mA durant 15 min.
1. Écrire la demi-équation de la transformation à la cathode.
2. Calculer la charge électrique parcourant l'électrolyseur durant l'expérience.
2. Calculer la charge électrique parcourant l'électrolyseur durant l'expérience.
3. En déduire la quantité d'électrons échangés à la cathode.
Couple d'oxydoréduction de l'argent : \text{Ag}^+(\text{aq})/\text{Ag(s)}
Constante de Faraday : F = 9{,}65 \times 10^4 C·mol‑1
Données
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Dégagement gazeux aux électrodes
✔ APP : Formuler des hypothèses
L'électrolyse d'une solution aqueuse de sulfate de sodium (2\ \text{Na}^+(\text{aq}) ; \text{SO}_4^{2-}(\text{aq})) de concentration en soluté 1,0 mol·L-1 est réalisée avec des électrodes en platine, le générateur délivrant un courant de \text{0,300} A durant \text{15} min. Deux tubes remplis de la même solution sont positionnés à l'envers sur chacune des électrodes, car des dégagements gazeux y sont observés. Quelques gouttes de phénolphtaléine sont versées vers l'électrode reliée à la borne négative et se colorent en rose en raison d'un \text{pH} supérieur à \text{10}.
1. Écrire les demi-équations possibles aux électrodes.
2. En identifiant l'un des produits générés, en déduire le sens des demi‑équations lors de l'électrolyse.
1. Écrire les demi-équations possibles aux électrodes.
2. En identifiant l'un des produits générés, en déduire le sens des demi‑équations lors de l'électrolyse.
3. En déduire l'équation de la réaction d'électrolyse en précisant quelle est l'espèce chimique qui est décomposée lors de cette expérience.
4. Déterminer la quantité d'électrons transférés à l'anode et en déduire la quantité de matière de gaz formé.
Couple d'oxydoréduction de l'argent : \text{Na}^+\text{(aq)/Na(s)}, \text{S}_2\text{O}_8^{2-}(\text{aq})/\text{SO}_4^{2-}(\text{aq}), \text{H}^+\text{(l)/H}_2(\text{g}) et \text{O}_2\text{(g)/H}_2\text{O(l)}
Constante de Faraday : F = 9{,}65 \times 10^4 C·mol‑1
4. Déterminer la quantité d'électrons transférés à l'anode et en déduire la quantité de matière de gaz formé.
Données
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Conversion d'énergie
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18Chaîne énergétique
✔ RAI/MOD : Utiliser avec rigueur le modèle de l'énergie
La première pile à combustible (PAC) fut créée par William R. Grove en 1839. Il montra qu'en recombinant du dihydrogène et du dioxygène, il était possible de créer simultanément de l'eau, de la chaleur et de l'électricité.
Doc.
Schéma de principe d'une PAC
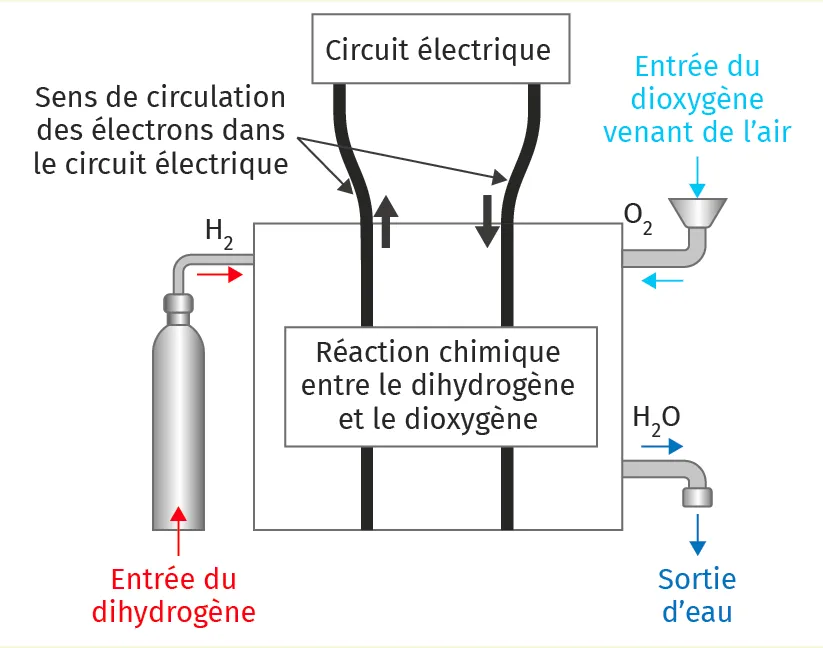
Représenter la chaîne énergétique de la pile à combustible.
Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19Légende d'un schéma
✔ APP : Maîtriser le vocabulaire du cours
Compléter le schéma de l'électrolyse du chlorure de calcium liquide en précisant la cathode, l'anode, les bornes du générateur et le sens des électrons. Pour cela, cliquer sur l'image et utiliser l'outil « dessin ».
Compléter le schéma de l'électrolyse du chlorure de calcium liquide en précisant la cathode, l'anode, les bornes du générateur et le sens des électrons. Pour cela, cliquer sur l'image et utiliser l'outil « dessin ».
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20Observations
✔ RAI/ANA : Utiliser et interpréter des documents
Un électrolyseur est constitué de deux électrodes en graphite et d'une solution aqueuse de nitrate d'argent (\text{Ag}^+(\text{aq}) \ ; \ \text{NO}^{-}_3(\text{aq})). Après déclenchement du générateur, l'une des électrodes se couvre d'une couche métallique grise et, autour de l'autre, on observe un dégagement gazeux.
Écrire les demi-équations électrochimiques des réactions réalisées aux électrodes et nommer ces électrodes.
Écrire les demi-équations électrochimiques des réactions réalisées aux électrodes et nommer ces électrodes.
Donnée
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21Schématisation d'une électrolyse
✔ RAI/ANA : Utiliser et interpréter des documents
Par électrolyse d'une solution aqueuse de sulfate de zinc (\text{Zn}^{2+}(\text{aq})\ ; \ \text{SO}_4^{2-}(\text{aq})) acidifiée, on obtient du zinc métallique. Les électrodes sont en graphite. La réaction observée pendant l'électrolyse est :
1. Écrire les demi-équations électrochimiques.
2. Faire un schéma légendé de l'expérience en précisant le nom des électrodes, les réactions qui s'y réalisent et les bornes du générateur.
Par électrolyse d'une solution aqueuse de sulfate de zinc (\text{Zn}^{2+}(\text{aq})\ ; \ \text{SO}_4^{2-}(\text{aq})) acidifiée, on obtient du zinc métallique. Les électrodes sont en graphite. La réaction observée pendant l'électrolyse est :
2\ \text{Zn}^{2+}(\text{aq}) +2\ \text{H}_2\text{O(l)} \rightarrow 2\ \text{Zn(s)} + \text{O}_2(\text{g}) + 4\ \text{H}^+(\text{aq})
1. Écrire les demi-équations électrochimiques.
2. Faire un schéma légendé de l'expérience en précisant le nom des électrodes, les réactions qui s'y réalisent et les bornes du générateur.
Cliquez pour accéder à une zone de dessin
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

