Chapitre 1
Exercices
Pour s'entraîner
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26Calculer une masse volumique
✔ COM : Associer les bonnes unités aux grandeurs physiques
On introduit 15 mL d'éthanol dans une éprouvette graduée placée sur une balance tarée. La masse de cet échantillon d'éthanol est de 12 g.
1. Exprimer littéralement puis calculer la masse volumique de l'éthanol en g·cm-3.
1. Exprimer littéralement puis calculer la masse volumique de l'éthanol en g·cm-3.
2.
Exprimer la masse d'éthanol en kilogramme, et le volume en m3. Rappel : 1 m3 = 1 \times 103 L.
3. En déduire la valeur de la masse volumique de l'éthanol en kg·m-3.
3. En déduire la valeur de la masse volumique de l'éthanol en kg·m-3.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BSavoir si une solution est saturée
✔ APP : Maîtriser le vocabulaire du cours
On prépare une solution en introduisant 50 g de chlorure de sodium (sel) dans un bécher contenant 100 mL d'eau.
1. Calculer la masse maximale de chlorure de sodium que l'on peut dissoudre dans V = 100 mL d'eau.
1. Calculer la masse maximale de chlorure de sodium que l'on peut dissoudre dans V = 100 mL d'eau.
2.
En déduire si la solution obtenue est saturée.
Solubilité du chlorure de sodium dans l'eau : s(NaCL) = 360 g·L-1 à 20 °C.
Données
Solubilité du chlorure de sodium dans l'eau : s(NaCL) = 360 g·L-1 à 20 °C.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27Déterminer l'état physique d'une espèce
chimique
✔ APP : Maîtriser le vocabulaire du coursEn utilisant le tableau des températures de changement d'état donné ci-dessous, indiquer, pour chaque espèce chimique, l'état dans lequel elle se trouve à la température ambiante (20 °C) et à la température de 120 °C.
a.
Éthanol.
b. Cyclohexane.
c. Méthane.
b. Cyclohexane.
c. Méthane.
d.
Eau.
e. Acétone.
f. Sel.
e. Acétone.
f. Sel.
Données
| Espèce chimique | Température de fusion (°C) | Température d'ébullition (°C) |
| Cyclohexane | 6,5 | 81 |
| Eau | 0 | 100 |
| Éthanol | -114 | 79 |
| Méthane | -182,5 | -161,5 |
| Acétone | -94,6 | 56 |
| Sel | 801 | 1465 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
28Cyclododécane
✔ APP : Maîtriser le vocabulaire du coursLe cyclododécane est un hydrocarbure d'aspect cireux, utilisé en archéologie pour protéger des objets de la poussière et de l'eau pendant leur manipulation. Cet hydrocarbure, insoluble dans l'eau et l'alcool, soluble dans le white spirit, a la propriété de se sublimer à température ambiante.


1.
Rappeler la définition du terme « sublimation ».
2. Expliquer en quelques lignes pourquoi le cyclododécane peut protéger un objet de l'eau.
2. Expliquer en quelques lignes pourquoi le cyclododécane peut protéger un objet de l'eau.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
29
Comprendre les attendusDéterminer expérimentalement la température de changement d'état
✔ APP : Faire un brouillon comprenant un schémaUn élève souhaite déterminer expérimentalement la température de fusion du glycérol.
1.
Faire le schéma légendé du montage qui permet de réaliser ces mesures.
2. Les mesures sont relevées dans ce tableau.
Cliquez pour accéder à une zone de dessin
2. Les mesures sont relevées dans ce tableau.
| t (s) | 0 | 30 | 60 | 90 | 120 | 150 | 180 | 210 | 240 |
| T (°C) | 5 | 8 | 11 | 14 | 17 | 18 | 18 | 18 | 21 |
Tracer la courbe d'évolution de la température en fonction du temps.
3. En déduire la température de fusion du glycérol.
Cliquez pour accéder à une zone de dessin
3. En déduire la température de fusion du glycérol.
Détails du barème
TOTAL /8 pts
2 pts
1.
Réaliser un schéma complet (système de chauffage, récipient, thermomètre, chronomètre), soigné et précis.1 pt
2.
Indiquer l'échelle clairement.1 pt
2.
Placer le temps t sur l'axe des abscisses et la température T sur l'axe des ordonnées.1 pt
2.
Positionner les points correctement, avec soin.1 pt
2.
Relier les points à la main (pas à la règle).1 pt
3.
Identifier la bonne température de fusion.1 pt
3.
Justifier le choix de la température de fusion.Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30Calculer une densité ou une masse volumique
✔ COM : Associer les bonnes unités aux grandeurs physiques

Le thermomètre de Galilée donne une indication de la température basée sur des différences de masse volumique.
1.
Compléter le tableau ci-dessous avec les valeurs qui conviennent en
détaillant tous les calculs.
2. Parmi les liquides, quels sont ceux qui sont plus denses que l'eau ? moins denses que l'eau ?
2. Parmi les liquides, quels sont ceux qui sont plus denses que l'eau ? moins denses que l'eau ?
| Espèce chimique | Masse (g) | Volume (cm3) | Masse volumique (g·L-1) | Densité |
| Eau | 20 | 20 | ||
| Éthanol | 39,5 | 50 | ||
| Éther | 25 | 0,71 | ||
| Eau salée | 40 | 1 025 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31L'eau iodée
✔ APP : Maîtriser le vocabulaire du coursLe diiode est constitué de molécules de formule \text{I}_{2}. L'iodure de potassium \text{KI} est constitué d'ions iodure \text{I}^{-} et d'ions potassium \text{K}^{+}. L'eau iodée, utilisée pour désinfecter les plaies, est un mélange d'eau, de diiode et d'iodure de potassium dissous.
1.
Le diiode est-il un corps pur simple, un corps pur composé moléculaire, atomique, ionique ou un mélange ? Même question pour l'iodure de potassium.
2. Dans quel état physique le diiode et l'iodure de potassium sont-ils à température ambiante (20 °C) ?
2. Dans quel état physique le diiode et l'iodure de potassium sont-ils à température ambiante (20 °C) ?
3.
L'eau iodée est-elle un corps pur ou un mélange ?
4. Quelle masse maximale de diiode et d'iodure de potassium peut-on dissoudre dans 25 mL d'eau ?
4. Quelle masse maximale de diiode et d'iodure de potassium peut-on dissoudre dans 25 mL d'eau ?
Données
| Espèce chimique | \bf{\theta_{t}}(°C) | \bf{\theta_{éb}}(°C) | Solubilité s(eau) |
| \bf{\text{I}_{2}} | 113,7 | 184,4 | 330 mg·L-1 |
| \bf{\text{KI}} | 686 | 1330 | 1 430 g·L-1 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
32
L'acétone en QCM
✔ APP : Maîtriser le vocabulaire du cours

Chloé introduit dans une éprouvette graduée 10 g d'acétone. Dire pour chacune des propositions suivantes si elle est vraie ou fausse, et justifier le choix.
1. Le volume d'acétone dans l'éprouvette est :
a. de 10 mL.
b. de 7,8 mL.
c. de 12,8 mL.
2.
Chloé ajoute maintenant 25 g d'eau dans l'éprouvette et agite le contenu. Le mélange obtenu est :
a. de nature homogène.
b. constitué de deux phases.
3. Chloé ajoute ensuite doucement 5 mL de cyclohexane. Après agitation :
a. on obtient un mélange homogène stable.
b. l'eau et l'acétone forment un mélange homogène, distinct du cyclohexane.
c. le cyclohexane se place au-dessus du mélange eauacétone.
a. de nature homogène.
b. constitué de deux phases.
3. Chloé ajoute ensuite doucement 5 mL de cyclohexane. Après agitation :
a. on obtient un mélange homogène stable.
b. l'eau et l'acétone forment un mélange homogène, distinct du cyclohexane.
c. le cyclohexane se place au-dessus du mélange eauacétone.
Données
- Masses volumiques à 20 °C :
\rho_{eau} = 1,0 g·cm-3 ;
\rho_{acétone} = 0,784 g·cm-3 ;
\rho_{cyclohexane} = 0,779 g·cm-3. - L'eau et l'acétone sont miscibles entre eux, mais ne sont pas miscibles avec le cyclohexane.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
33Solubilité d'une espèce chimique
✔ VAL : Appliquer une relation entre des grandeurs physiquesOn introduit dans un bécher 20 mL d'eau à 20 °C. On peut dissoudre au maximum 18 g de glucose dans ce volume d'eau. La température de fusion du glucose est de 146 °C.
1. Dans quel état le glucose se trouve-t-il à 20 °C ?
2. Calculer la solubilité du glucose dans l'eau à 20 °C.
3. Peut-on dissoudre 50 g de glucose dans 100 mL d'eau ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
34
Copie d'élève à commenter
Proposer une justification pour chaque erreur relevée par le correcteur.
1.
La température de fusion de cet acide étant de 8,3 °C, il est solide à 20 °C.
2. L'air est composé principalement devapeur d'eau et de dioxyde de carbone.
3. La solubilité de l'acide citrique étant de 592 g·L-1 dans l'eau, on peut en dissoudre jusqu'à10 g dans 10 mL d'eau.
4. La masse volumique de l'éthanol étant de 0,789 g·cm-3, le volume V = 15 mL a unemasse m = 19,0 g .
2. L'air est composé principalement de
3. La solubilité de l'acide citrique étant de 592 g·L-1 dans l'eau, on peut en dissoudre jusqu'à
4. La masse volumique de l'éthanol étant de 0,789 g·cm-3, le volume V = 15 mL a une
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
35Étalon
✔ MATH : Résoudre une équation
Le kilogramme est l'unité de base de la masse dans le système international. L'étalon, prototype du kilogramme, est conservé par le Bureau international des poids et mesures (BIPM). Surnommé le « grand K », ce prototype a été réalisé en platine iridié (90 % de platine et 10 % d'iridium en masse) et prend la forme d'un cylindre de 39,17 mm de hauteur.
Calculer le diamètre du prototype, et le comparer à la hauteur du grand K.
Calculer le diamètre du prototype, et le comparer à la hauteur du grand K.
Données
- Masses volumiques :
\rho_{\text{étalon}} = 21{,}19 g.cm-3 ;
\rho_{\text{platine}} = 21{,}5 g·cm-3 ;
\rho_{\text{iridium}} = 22{,}6 g·cm-3. - Volume d'un cylindre de rayon \bf{R} et de hauteur \bf{h} :
V = \pi R^{2} h
Histoire des sciences
Le premier étalon du kilogramme a été fabriqué en 1799. Comme la masse de l'étalon variait, la définition du kilogramme a été modifiée fin 2018. Depuis mai 2019, le kilogramme est défini par rapport à la constante de Planck h.




Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CDéterminer la masse volumique de l'air expérimentalement
✔ VAL : Précision et incertitude
✔ VAL : Évaluer les sources d'erreurs
✔ VAL : Évaluer les sources d'erreurs
Pendant une séance de travaux pratiques, les élèves doivent déterminer expérimentalement la masse volumique de l'air.
Enzo et Léa réalisent le montage suivant en binôme :

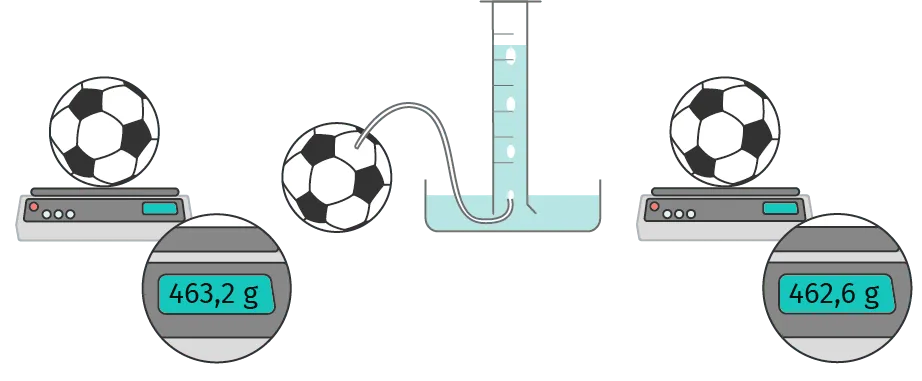 Montage du binôme 9 : Enzo et Léa
Montage du binôme 9 : Enzo et Léa
Dans un premier temps, ils gonflent un ballon de football. La pression atmosphérique est P = 1\,015 hPa. La masse du ballon au début de l'expérience est m = 463{,}2 g.
Ils retournent une grande éprouvette graduée de 500 mL remplie d'eau sur un cristallisoir rempli d'eau. Ensuite, ils laissent échapper l'air par un petit tube relié au ballon, qui est placé sous l'éprouvette graduée. Le volume total du ballon reste constant. Lorsque l'éprouvette graduée est pleine d'air, ils enlèvent le tube et mesurent précisément la masse du ballon ainsi que le volume de gaz échappé. Ils trouvent 462,6 g pour un volume 480 mL.


Dans un premier temps, ils gonflent un ballon de football. La pression atmosphérique est P = 1\,015 hPa. La masse du ballon au début de l'expérience est m = 463{,}2 g.
Ils retournent une grande éprouvette graduée de 500 mL remplie d'eau sur un cristallisoir rempli d'eau. Ensuite, ils laissent échapper l'air par un petit tube relié au ballon, qui est placé sous l'éprouvette graduée. Le volume total du ballon reste constant. Lorsque l'éprouvette graduée est pleine d'air, ils enlèvent le tube et mesurent précisément la masse du ballon ainsi que le volume de gaz échappé. Ils trouvent 462,6 g pour un volume 480 mL.
1. Déterminer la masse volumique de l'air.
2. Les autres binômes réalisent les mesures, et les résultats sont regroupés dans le tableau ci-dessous. Représenter l'histogramme associé à cette série de mesures à l'aide d'un tableur.
3. Déterminer la moyenne et l'écart-type de cette série de mesures indépendantes.
4. Discuter l'influence du protocole et de l'instrument de mesure sur les résultats.
2. Les autres binômes réalisent les mesures, et les résultats sont regroupés dans le tableau ci-dessous. Représenter l'histogramme associé à cette série de mesures à l'aide d'un tableur.
| Binôme | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
|---|---|---|---|---|---|---|---|---|---|
| ρ(g·L-1) | 1,24 | 1,23 | 1,25 | 1,24 | 1,65 | 1,25 | 1,3 | 1,24 |
3. Déterminer la moyenne et l'écart-type de cette série de mesures indépendantes.
4. Discuter l'influence du protocole et de l'instrument de mesure sur les résultats.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retrouvez les de ces nouveaux calculs de mesure.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

