Chapitre 6
Exercices
Pour s'échauffer - Pour commencer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
| Pour commencer | Différenciation | Pour s'entraîner | |
|---|---|---|---|
| Établir le lien entre stabilité chimique et configuration électronique de valence d'un gaz noble : | |||
| Déterminer la charge électrique d'ions monoatomiques à partir du tableau périodique : | |||
| Décrire et exploiter le schéma de Lewis d'une molécule pour justifier sa stabilité : | |||
| Associer l'énergie d'une liaison entre deux atomes à l'énergie nécessaire pour rompre cette liaison : |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour s'échauffer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5L'atome d'argon
L'atome d'argon a pour numéro atomique Z = 18.1. Préciser sa configuration électronique.
2. Celle-ci respecte-t-elle la règle de l'octet ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6Les gaz nobles
Justifier la grande stabilité des gaz nobles à partir de considérations électroniques.Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7L'ion sodium
L'atome de sodium a pour numéro atomique Z = 11. Prévoir la formule chimique de l'ion monoatomique issu de l'atome de sodium.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8 L'ion chlorure
L'atome de chlore a pour numéro atomique Z = 17. 1. Prévoir la formule chimique de l'ion monoatomique issu de cet atome.
2. De quel atome cet ion est-il isoélectronique ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9 La molécule d'ammoniac
La structure de Lewis de la molécule d'ammoniac est la suivante : 
1. Dénombrer les liaisons covalentes.
2. Justifier la stabilité des atomes de cette molécule.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AL'atome de Néon
L'atome de Néon a pour numéro atomique Z = 10.
1. Préciser sa configuration électronique.
2. Combien d'électrons de valence possède-t-il ?
1. Préciser sa configuration électronique.
2. Combien d'électrons de valence possède-t-il ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BLa molécule HCl
La structure de Lewis de la molécule de chlorure d'hydrogène est la suivante :


1. Combien y a-t-il de doublets non liants dans cette molécule ?
2. Justifier la stabilité des deux atomes présents dans cette molécule.
2. Justifier la stabilité des deux atomes présents dans cette molécule.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour commencer
Stabilité chimique des gaz nobles
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10Le krypton
✔ MOD : Connaître la structure du nuage électronique1. Donner la structure électronique du néon \text {Ne} et celle de l'argon \text { Ar }.
On écrit parfois la structure électronique de l'argon sous la forme : [\text {Ne}] 3s23p6.
2. Combien d'électrons l'atome de krypton a-t-il sur sa couche de valence ? Justifier.
Données
Numéro atomique des éléments :
\text {Ne} (Z = 10) ;
\text {Ar} (Z = 18) ;
\text {Kr} (Z = 36).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11Stabilité du néon et ions monoatomiques
✔ MOD : Connaître la structure du nuage électroniqueProposer la formule chimique de deux cations et de deux anions de même structure électronique que le néon.


Petites lampes à d'écharge au gaz néon.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Charge électrique des ions monoatomiques
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12L'ion mystère
✔ APP : Maîtriser le vocabulaire du coursProposer la formule du seul anion monoatomique qui respecte la règle du duet.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13Stabilité du néon et ions monoatomiques
✔ MOD : Connaître la structure du nuage électronique
Le sel de mer (doc. 1) est majoritairement composé de chlorure de sodium
(\mathrm{NaCl}). Il contient aussi du chlorure de magnésium de formule \mathrm{MgCl}_{2}.
1. Donner les structures électroniques des atomes \mathrm{Mg} et \mathrm{Cl}.
2. En déduire les charges des ions magnésium et chlorure.
3. Combien d'électrons ces ions possèdent-ils sur leurs couches externes ?
(\mathrm{NaCl}). Il contient aussi du chlorure de magnésium de formule \mathrm{MgCl}_{2}.
1. Donner les structures électroniques des atomes \mathrm{Mg} et \mathrm{Cl}.
2. En déduire les charges des ions magnésium et chlorure.
3. Combien d'électrons ces ions possèdent-ils sur leurs couches externes ?
Données
Numéro atomique des éléments :
\mathrm{Mg} (Z = 12) ;
\text {Na} (Z = 11) ;
\mathrm{Cl} (Z = 17).


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Schéma de Lewis et molécule
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14 L'urée, pas seulement un déchet
✔ MOD : Utiliser de façon rigoureuse le modèle de l'énergieL'urée est une molécule de formule \mathrm{CH}_{4} \mathrm{ON}_{2}. Cette molécule est naturellement éliminée par nos urines. C'est la première molécule naturelle à avoir été synthétisée en laboratoire (par Friedrich Wöhler en 1828).
1. Compléter le schéma ci‑dessous pour obtenir la formule de Lewis de l'urée.
2. Si l'on chauffe cette
molécule, elle se décompose et forme de l'ammoniac \mathrm{NH}_{3}. Expliquer pourquoi l'apport de chaleur permet
cette décomposition.
Culture scientifique
En appliquant une solution d'urée à un blanc d'œuf dur et en le centrifugeant, des scientifiques ont pu
rétablir la protéine appelée lysozyme [lors de la cuisson du blanc d'œuf, la géométrie de la protéine se modifie et elle perd ses propriétés]. [...] Ce procédé pourrait révolutionner la production industrielle
de protéines, et baisser les coûts de nombreux traitements, comme des anticancéreux.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15Retrouver la représentation de Lewis d'une molécule
✔ MOD : Connaître la structure du nuage électroniqueDoc. 1
Fourmi


Doc. 2
Plante d'ortie


L'acide méthanoïque est un liquide incolore à l'odeur pénétrante. Dans la nature, on trouve l'acide méthanoïque dans les glandes de plusieurs insectes comme les abeilles et les fourmis mais aussi sur les poils qui composent les feuilles des orties. Il a pour formule : \mathrm{HCOOH}.
1. Choisir la représentation de Lewis correcte pour l'acide
méthanoïque :
L'acide éthanoïque se trouve dans le vinaigre. Il a pour formule : \mathrm{CH}_{3} \mathrm{COOH}.
2. Déduire de la question précédente la représentation de Lewis de l'acide éthanoïque.
| Proposition 1 | Proposition 2 | Proposition 3 |
 |
 |
 |
L'acide éthanoïque se trouve dans le vinaigre. Il a pour formule : \mathrm{CH}_{3} \mathrm{COOH}.
2. Déduire de la question précédente la représentation de Lewis de l'acide éthanoïque.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CLes dihalogènes
✔ MOD : Comprendre l'écriture d'une formule de Lewis
Le chlore, comme le fluor, sont des halogènes. La formule de Lewis du difluor est la suivante :
Parmi les propositions suivantes, quelle structure de Lewis peut-on prévoir pour le dichlore ? Justifier.
a.
b.
c.
Le chlore, comme le fluor, sont des halogènes. La formule de Lewis du difluor est la suivante :

Parmi les propositions suivantes, quelle structure de Lewis peut-on prévoir pour le dichlore ? Justifier.
a.

b.

c.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Savoir-faire : Décrire et exploiter le schéma de Lewis d'une molécule
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16Stabilité des atomes dans l'aspirine
✔ MOD : Connaître la structure du nuage électroniqueLa molécule d'aspirine contient des atomes de carbone, d'hydrogène et d'oxygène.
1. Donner la structure électronique de ces trois atomes.
2. En déduire le nombre d'électrons nécessaire à chaque atome pour respecter la règle du duet ou de l'octet.
3. Sachant que l'atome d'oxygène possède deux doublets non liants, proposer la structure de Lewis de la molécule d'aspirine en s'aidant de son modèle moléculaire ci-dessous.

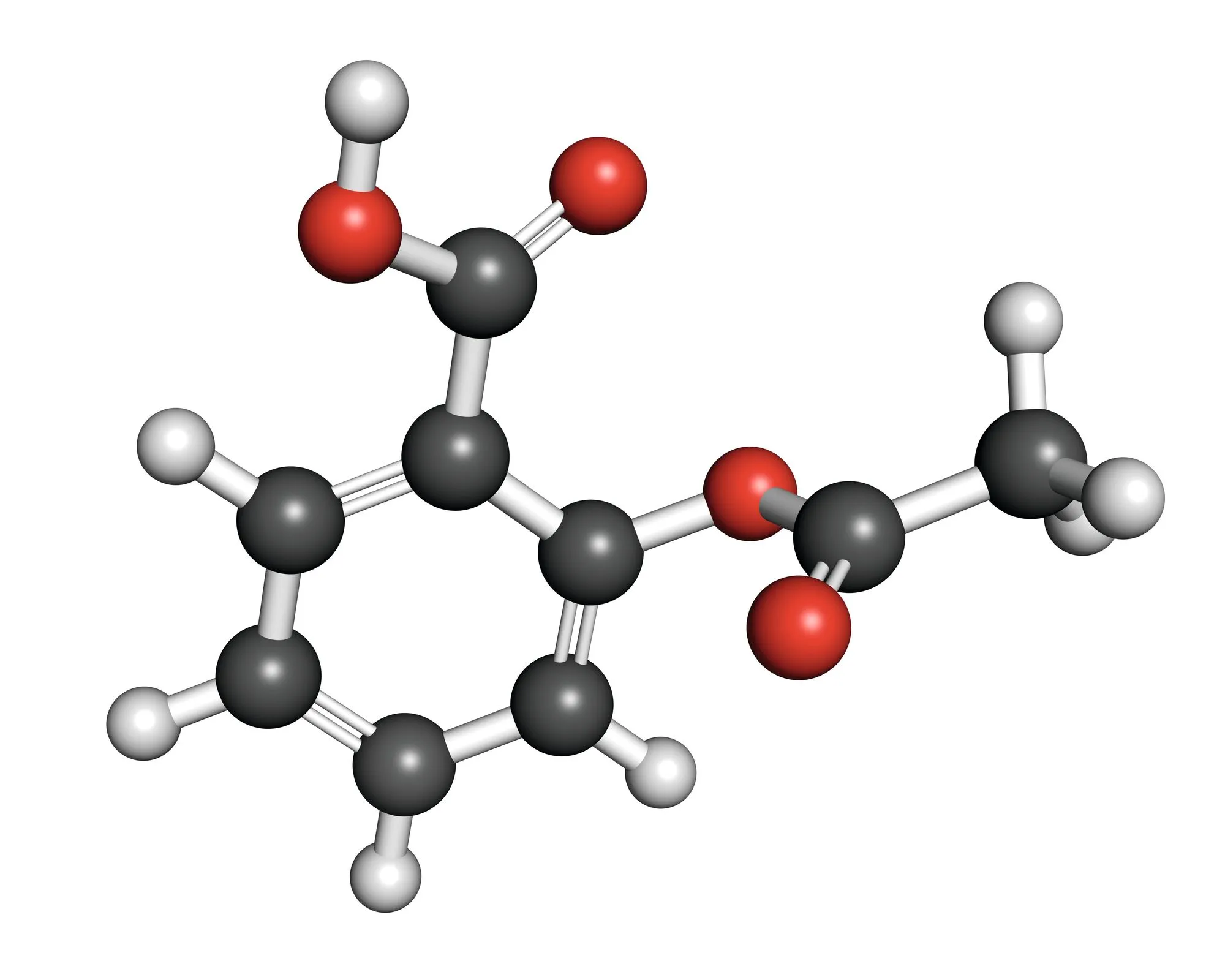
Modèle moléculaire de l'aspirine
Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Modèle moléculaire et formule de Lewis de l'aspirine
✔ APP : Extraire l'information utile de supports variés1. À l'aide du modèle moléculaire donné ci-après, proposer la structure de Lewis de l'aspirine.


Modèle moléculaire de l'aspirine
Cliquez pour accéder à une zone de dessin
2. Les atomes respectent-ils les règles du duet ou de l'octet au sein de cette molécule ?
Données
Numéro atomique des éléments :
\mathrm{H} (Z = 1) ;
\mathrm{O} (Z = 8) ;
\mathrm{C} (Z = 6).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18Un isomère de l'aspirine : l'acide caféique
✔ APP : Extraire l'information utile de supports variés
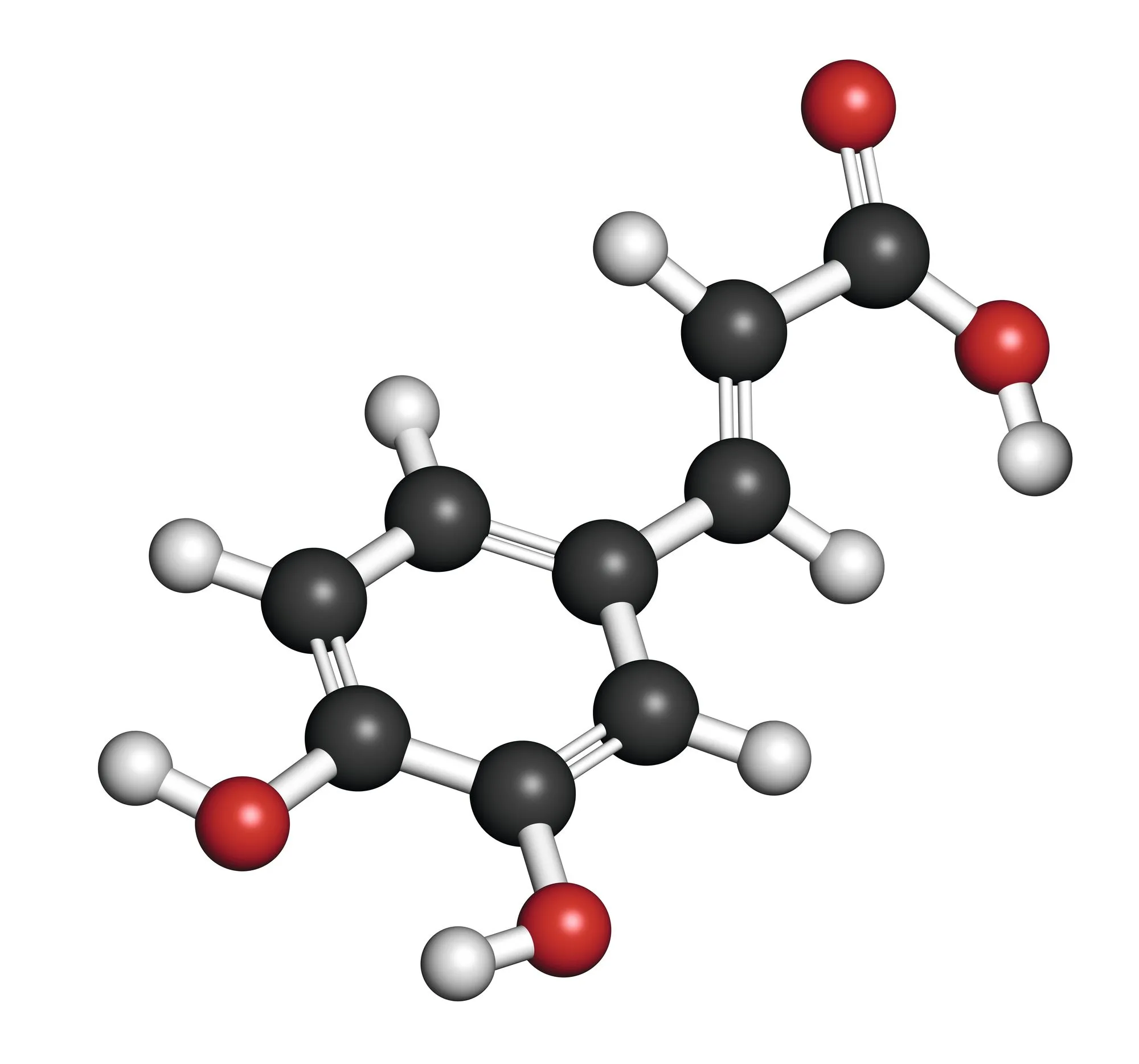
Modèle moléculaire de l'acide caféïque
Montrer que l'acide caféïque représenté ci-dessus est un isomère de l'aspirine (même formule brute) et proposer sa structure de Lewis.
Cliquez pour accéder à une zone de dessin
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

