Chapitre 6
Exercices
Pour s'entraîner
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour s'entraîner
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20Quelques molécules odorantes
✔ APP : Extraire l'information utile de supports variés Doc. 1
La vanilline

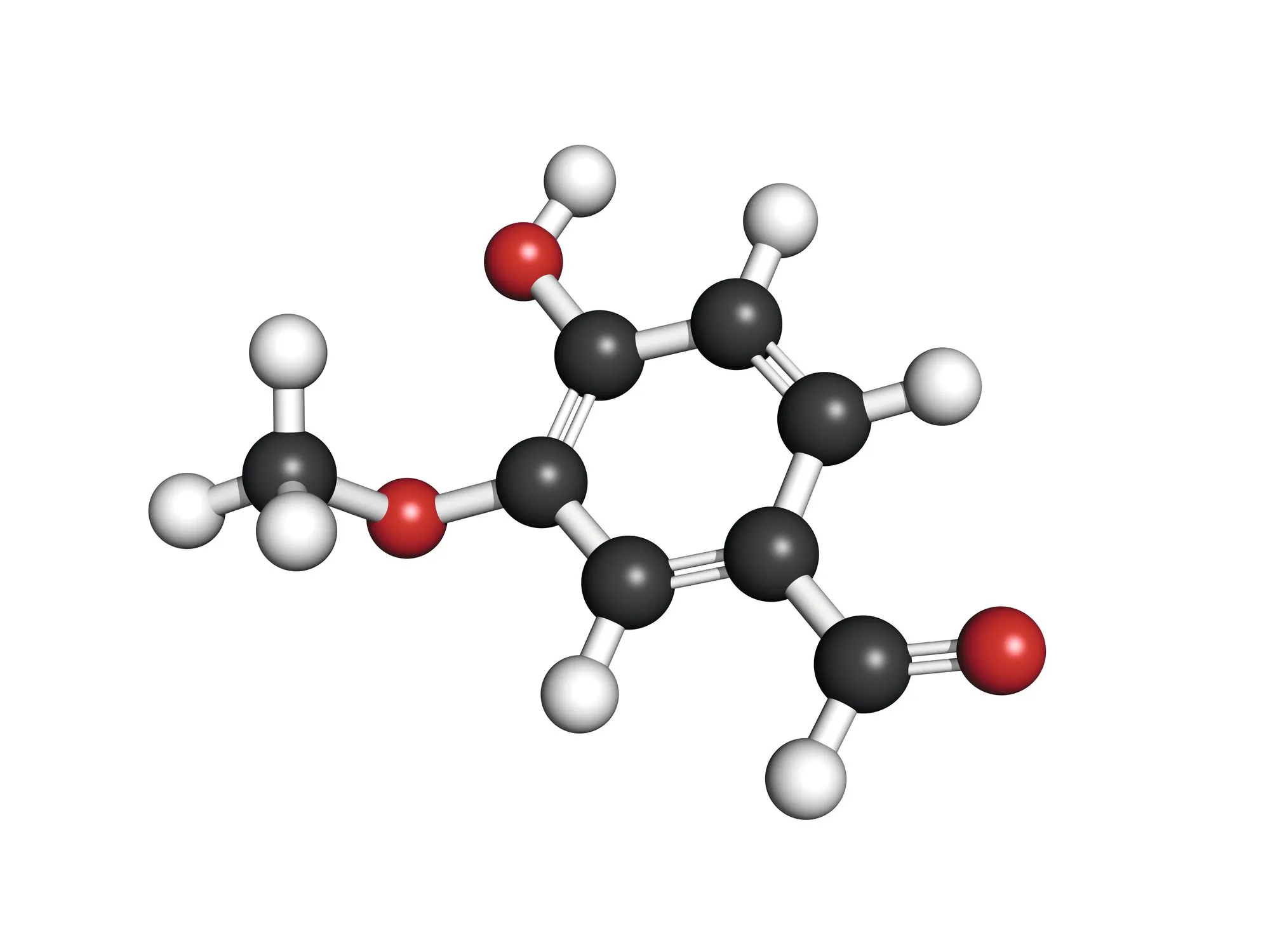
Doc. 2
L'acétate d'isoamyle



La vanilline est une des molécules responsables de l'odeur et du goût tant apprécié de la vanille.
1. À partir du modèle moléculaire du doc. 1, écrire la représentation de Lewis de la molécule de vanilline.
La molécule responsable de l'arôme de banane est l'acétate d'isoamyle. On peut la former à partir d'alcool isoamylique et d'acide éthanoïque.
2. Doc. 2 Reproduire et compléter la représentation de Lewis de la molécule d'acétate d'isoamyle.
1. À partir du modèle moléculaire du doc. 1, écrire la représentation de Lewis de la molécule de vanilline.
Cliquez pour accéder à une zone de dessin
La molécule responsable de l'arôme de banane est l'acétate d'isoamyle. On peut la former à partir d'alcool isoamylique et d'acide éthanoïque.
2. Doc. 2 Reproduire et compléter la représentation de Lewis de la molécule d'acétate d'isoamyle.
Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21Ammoniac ou ammoniaque ?
✔ MOD : Connaître la structure électroniqueL'ammoniac est un gaz incolore, irritant et très odorant. Il a pour formule \mathrm{NH}_{3}.
1. Donner la structure électronique d'un atome d'azote et d'un atome d'hydrogène. Combien d'électrons possèdent-ils sur leurs couches externes ?
2. Combien de liaisons covalentes l'atome d'hydrogène peut-il former ?
3. Sachant que l'atome d'azote possède un doublet non liant, déterminer le nombre de liaisons covalentes qu'il peut former.
4.
En déduire la représentation de Lewis de la molécule d'ammoniac.
Cliquez pour accéder à une zone de dessin
Culture scientifique
Ne pas confondre ammoniac et ammoniaque !
Lorsqu'on dissout du gaz ammoniac dans de l'eau, on obtient de l'hydroxyde d'ammonium, également appelé ammoniaque (la terminaison évoquant l'adjectif « aqueux »). La formule chimique de l'ammoniac est \mathrm{NH}_{3}, celle de l'ammoniaque est \mathrm{NH}_{4} \mathrm{OH}. L'ammoniac sert essentiellement à la fabrication d'engrais azotés. Mais il peut également être employé comme gaz réfrigérant ou pour la production de plastiques, d'explosifs ou d'autres produits chimiques.
Lorsqu'on dissout du gaz ammoniac dans de l'eau, on obtient de l'hydroxyde d'ammonium, également appelé ammoniaque (la terminaison évoquant l'adjectif « aqueux »). La formule chimique de l'ammoniac est \mathrm{NH}_{3}, celle de l'ammoniaque est \mathrm{NH}_{4} \mathrm{OH}. L'ammoniac sert essentiellement à la fabrication d'engrais azotés. Mais il peut également être employé comme gaz réfrigérant ou pour la production de plastiques, d'explosifs ou d'autres produits chimiques.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22Copie d'élève à commenter
Proposer une justification pour chaque erreur relevée par le correcteur.
1.
La structure électronique de l'aluminium est : 1s22s22p63s23p1. Pour se stabiliser, il peut donner un ion monoatomique en adoptant la configuration électronique du gaz noble le plus proche donc l'Argon.
2. Je propose la formule ci-dessous pour la dichlorométhane. Le carbone respecte la règle de l'octet avec 4 liaisons covalentes.Le chlore et l'hydrogène respectent la règle du duet avec 2 électrons.
2. Je propose la formule ci-dessous pour la dichlorométhane. Le carbone respecte la règle de l'octet avec 4 liaisons covalentes.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23De l'alcool dans le sang
✔ APP : Maîtriser le vocabulaire du coursUn prélèvement sanguin permet de dépister une consommation d'éthanol récente. L'éthanol est l'alcool comestible de formule chimique : \mathrm{C}_{2} \mathrm{H}_{5} \mathrm{OH}.
1.
L'atome d'hydrogène donne un anion monoatomique stable. Lequel ? Justifier.
2. L'atome d'oxygène peut donner un anion monoatomique stable. Lequel ? Justifier.
3. Pour se stabiliser, les atomes peuvent également s'assembler sous forme de molécule. Dans la formule de l'éthanol ci-contre, préciser si le modèle de Lewis est respecté et proposer des modifications si besoin :

2. L'atome d'oxygène peut donner un anion monoatomique stable. Lequel ? Justifier.
3. Pour se stabiliser, les atomes peuvent également s'assembler sous forme de molécule. Dans la formule de l'éthanol ci-contre, préciser si le modèle de Lewis est respecté et proposer des modifications si besoin :

Détails du barème
TOTAL /5,5 pts
0,5 pt
1.
Écrire la configuration électronique de \mathrm{H}.0,5 pt
1.
Savoir qu'un anion correspond à un gain d'électrons.1,5 pt
1.
Identifier le gaz noble le plus proche et proposer l'espèce chimique attendue. 1 pt
2.
Identifier le gaz noble le plus proche et proposer l'espèce chimique attendue.1 pt
3.
S'assurer du respect des règles du duet et de l'octet.1 pt
3.
Proposer la présence de deux doublets non liants.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

