Chapitre 10
Problèmes et tâches complexes
Modélisation des transformations nucléaires
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31 La guerre de Troie a‑t‑elle eu lieu ?
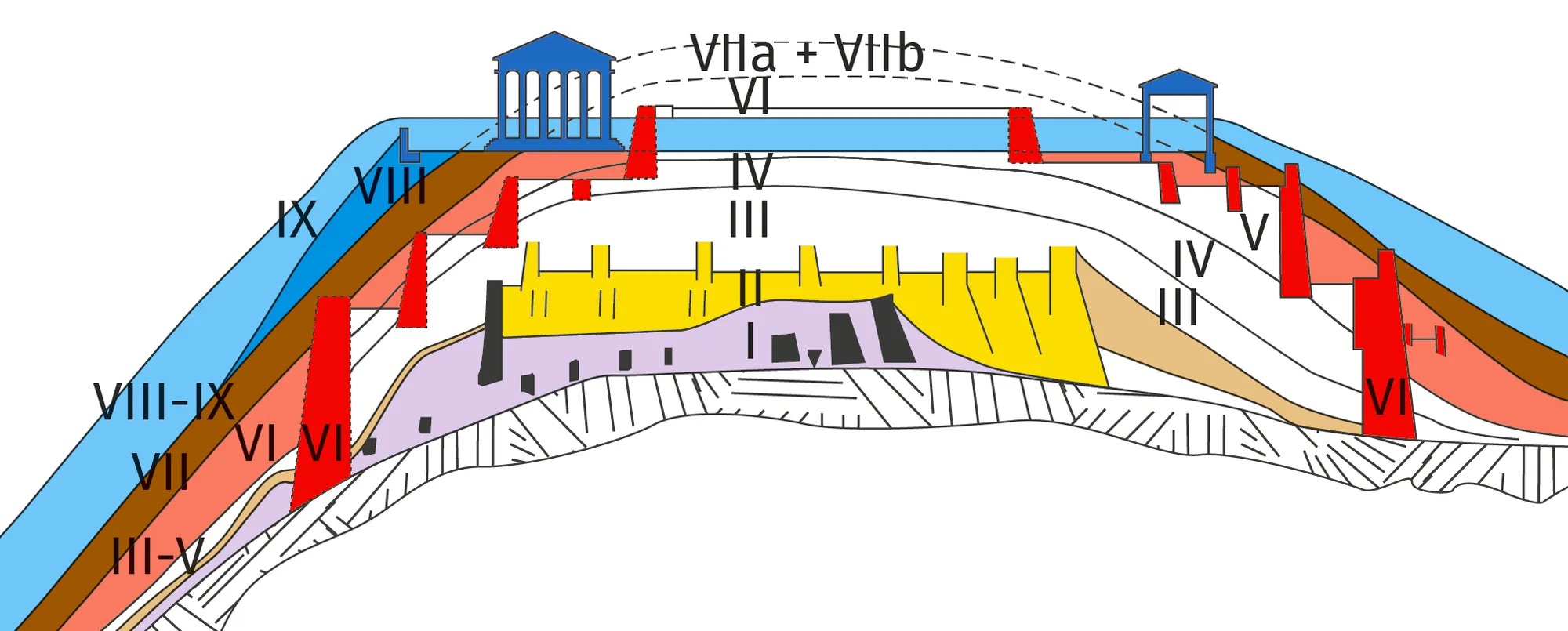
✔ APP : Faire un brouillonLe site archéologique de la colline d'Hissarlik a mis à jour la superposition de neuf villes différentes. Les différentes couches de ruines correspondent à différentes époques de la ville de Troie qui sont numérotées de I à IX (doc. 2). En 2009, un archéologue découvre des squelettes d'hommes portant des marques de mort violente et des armes de combat au niveau de la ville de Troie VII. Il se demande si celle-ci correspond à la ville de Troie évoquée par Homère dans l'Iliade. D'après les historiens, la guerre de Troie homérique se serait déroulée entre 1 350 et 1 150 avant J.-C. La technique de datation au carbone 14 est utilisée pour dater les vestiges à partir d'un échantillon prélevé sur le site.
Troie VII est-elle la ville décrite par Homère ?
Doc. 1
Datation au carbone 14
Le carbone 14 est le seul isotope du carbone qui se
transforme spontanément selon un processus radioactif
\beta^{-}. Il est créé en permanence en haute atmosphère
par la capture d'un neutron par les noyaux d'azote. Il
est ensuite oxydé pour donner du dioxyde de carbone
^{14}\text{CO}_2.
La quantité de carbone 14 présent dans un être vivant est constante car il y a un équilibre entre la quantité absorbée via le dioxyde de carbone et la quantité qui se désintègre au cours du temps.
Quand un être vivant meurt, il n'y a plus de régénération du carbone 14 par absorption de ^{14}\text{CO}_2 et sa quantité diminue au cours du temps. Cette diminution suit une loi de décroissance que l'on peut observer sur le doc. 3. Ainsi la mesure de l'activité d'un morceau de bois mort permet par comparaison avec l'activité actuelle de déterminer la date de sa mort.
La quantité de carbone 14 présent dans un être vivant est constante car il y a un équilibre entre la quantité absorbée via le dioxyde de carbone et la quantité qui se désintègre au cours du temps.
Quand un être vivant meurt, il n'y a plus de régénération du carbone 14 par absorption de ^{14}\text{CO}_2 et sa quantité diminue au cours du temps. Cette diminution suit une loi de décroissance que l'on peut observer sur le doc. 3. Ainsi la mesure de l'activité d'un morceau de bois mort permet par comparaison avec l'activité actuelle de déterminer la date de sa mort.
Doc. 2
Schéma du site archéologique de Troie
Doc. 3
Courbe de désintégration du carbone 14
Doc. 4
Analyse chimique et radioactive de l'échantillon
Un échantillon de bois calciné est prélevé. Son activité est de 93 désintégrations par minute pour 10,0 g de carbone.


Le Roman de Troie, vers 1330 (BNF, Paris).


Le Roman de Troie, vers 1330 (BNF, Paris).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retour sur la problématique du chapitre
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
32 Fusion thermonucléaire et besoins énergétiques
✔ MATH : Pratiquer un calcul numérique
La réaction de fusion étudiée sur différents projets
est la réaction entre le deutérium et le tritium. En
théorie, 2,5 g de combustible dégagent une énergie
de 20 t.e.p. Le deutérium, _{1}^{2}\text{H},
est présent dans l'eau
naturellement. En effet, 103 kg d'eau contiennent
environ 33 g de deutérium.
Le tritium, ^{3}_{1}\text{H}, quant à lui, est très rare sur Terre, mais il peut être produit en laboratoire.
Le tritium, ^{3}_{1}\text{H}, quant à lui, est très rare sur Terre, mais il peut être produit en laboratoire.
Données
2. Comparer avec les réserves d'eau disponibles sur Terre dont la valeur est 1,4 \times 1021 kg. Conclure sur l'intérêt de cette source d'énergie.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

