Chapitre 18
Cours
Modèles ondulatoire et particulaire de la lumière
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Le modèle ondulatoire de la lumière
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
A Le rayonnement et l'onde électromagnétique
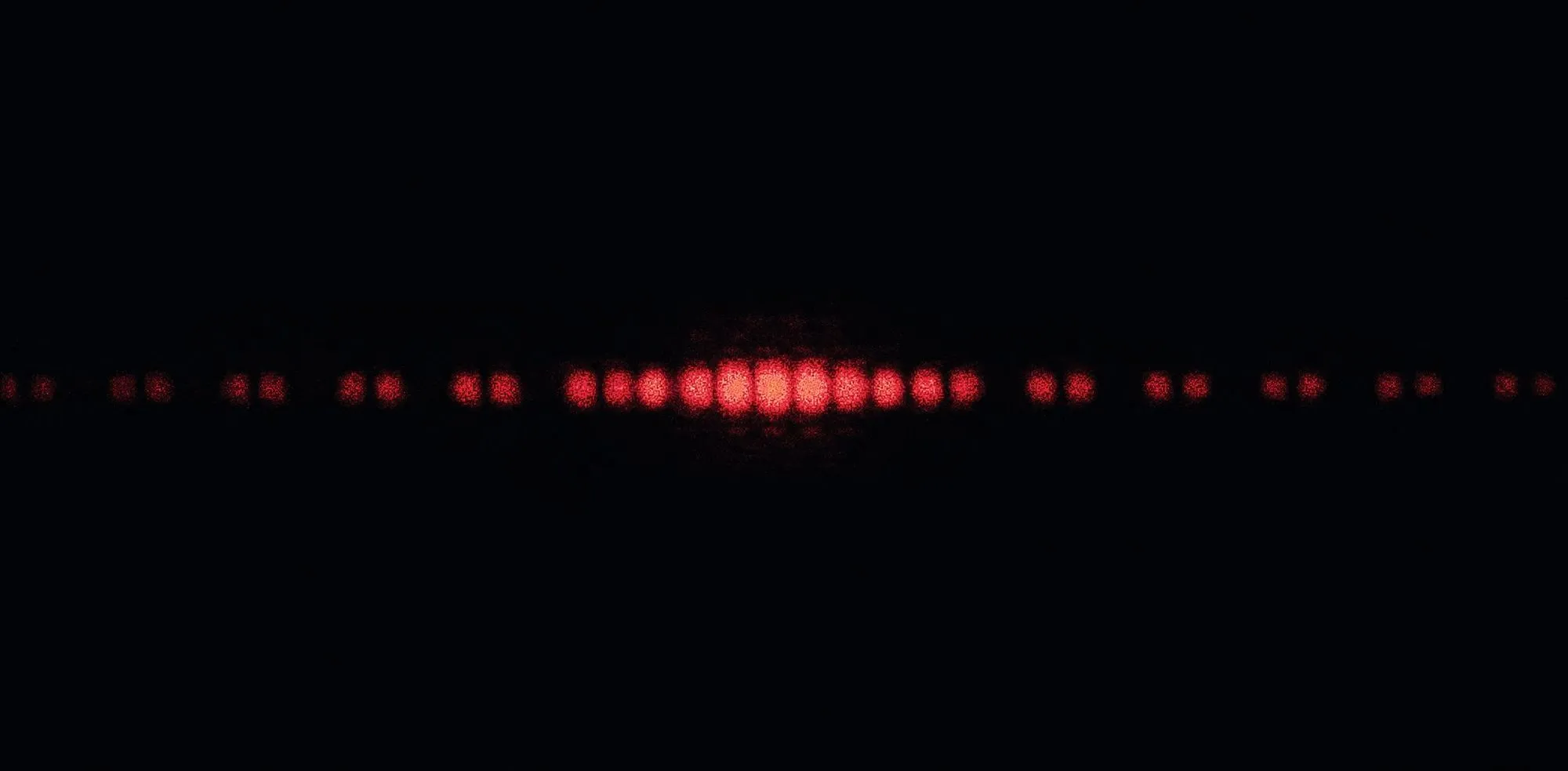
Les phénomènes de diffraction et d'interférences observés lors de la propagation d'énergie lumineuse au travers d'obstacle(s) ou d'orifice(s) sont les premiers phénomènes dont l'explication fait appel à la nature ondulatoire de la lumière (doc. 1). Initiée par Christian Huygens (1678), la théorie ondulatoire n'a cessé d'être améliorée (Thomas Young, 1802 ; Augustin Fresnel, 1815). En 1865, James Maxwell finalise le modèle et prédit l'existence et la célérité de l'onde électromagnétique.
Une onde électromagnétique (OEM) :
Une onde électromagnétique (OEM) :
- est un phénomène vibratoire qui se propage dans le vide et de nombreux milieux (transparents ou non) ;
- est constituée d'un champ électrique et d'un champ magnétique oscillants, orthogonaux entre eux, et orthogonaux à la direction de propagation ;
- se propage dans le vide à la célérité c=3\text{,}00 \times 10^{8} m·s-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 Observations expérimentales
a) Figure de diffraction d'un faisceau laser par une fente simple.




b) Figure d'interférence d'un faisceau laser par une double fente.



Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B Les caractéristiques d'une OEM
Une onde électromagnétique monochromatique est caractérisée
par :
- sa longueur d'onde, notée \lambda (lambda), qui correspond à sa période spatiale. Elle s'exprime en mètre (m) (doc. 2) ;
- sa fréquence, notée \nu (nu) ou f, correspond à l'inverse de la période temporelle T. Elle s'exprime en hertz (Hz).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Représentation d'une OEM

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
C Le spectre électromagnétique
Chaque être vivant s'approprie le monde dans lequel il vit à l'aide de ses sens, en particulier la vue. Cependant, l'être humain a pris conscience que les informations qu'il perçoit visuellement de son environnement peuvent être limitées.
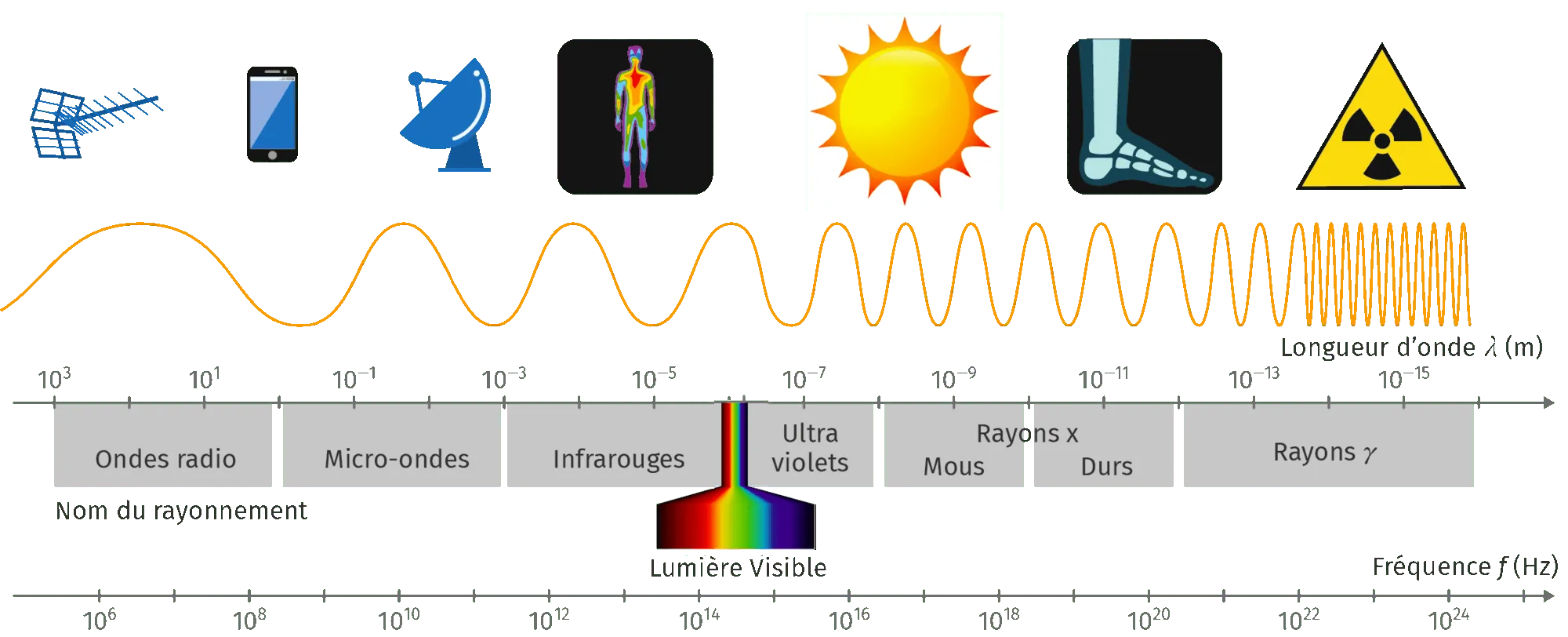
Le domaine visible (400 nm \lt\lambda\lt 800 nm) n'est qu'une infime partie des ondes électromagnétiques.
À l'aide de la longueur d'onde ou de la fréquence, on classe le spectre électromagnétique en sept sous-domaines principaux selon leur découverte ou leur utilisation. Dans l'ordre croissant des longueurs d'onde, on rencontre : les rayons \gamma, les rayons \text{X}, les ultraviolets, le visible, les infrarouges (proches et lointains), les micro-ondes et les ondes radio (voir doc. 3).
Le domaine visible (400 nm \lt\lambda\lt 800 nm) n'est qu'une infime partie des ondes électromagnétiques.
À l'aide de la longueur d'onde ou de la fréquence, on classe le spectre électromagnétique en sept sous-domaines principaux selon leur découverte ou leur utilisation. Dans l'ordre croissant des longueurs d'onde, on rencontre : les rayons \gamma, les rayons \text{X}, les ultraviolets, le visible, les infrarouges (proches et lointains), les micro-ondes et les ondes radio (voir doc. 3).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Qu'est-ce qu'une onde électromagnétique ? Retrouvez toutes les informations .
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- La fréquence ne dépend pas du milieu de propagation contrairement à la longueur d'onde.
- Aucun objet matériel connu ne peut se déplacer plus rapidement que la lumière.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Le spectre électromagnétique simplifié

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Fréquence : nombre de périodes ou de vibrations par seconde.
- Longueur d'onde : distance \lambda parcourue par l'onde pendant la durée d'une période T.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Le modèle particulaire de la lumière
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
A L'imperfection du modèle ondulatoire
Bien que les lois de l'électromagnétisme formulées par Maxwell au cours du XIXe siècle expliquent de nombreuses observations expérimentales, elles ne permettent pas d'interpréter le rayonnement émis par des corps chauffés et l'effet photoélectrique.
Le modèle ondulatoire explique la propagation de la lumière (OEM) et la formation des images mais est inopérant pour expliquer les interactions d'énergies avec la matière.
Le modèle ondulatoire explique la propagation de la lumière (OEM) et la formation des images mais est inopérant pour expliquer les interactions d'énergies avec la matière.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Les modèles ondulatoire et particulaire de la lumière modélisent les différentes manifestations de l'interaction de cette dernière avec son environnement.
- L'existence simultanée des deux modèles, à première vue contradictoires, illustre la dualité onde-corpuscule de la lumière.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B Le photon et son énergie
Afin de modéliser les interactions entre la matière et le rayonnement en coïncidence avec l'observation d'un corps noir, Planck propose en 1900 de quantifier l'énergie de l'onde à l'aide d'un paquet d'énergie indivisible : le quantum. Tout échange d'énergie avec la
matière est un multiple entier de ce minimum d'énergie : la théorie des quanta est née.
Remarque : L'énergie d'un photon est d'autant plus grande que sa fréquence est élevée (et que sa longueur d'onde est faible).
- Pour expliquer l'effet photoélectrique, Einstein associe en 1905 cette idée de quantum à une structure particulaire de la lumière, le photon.
- Chaque rayonnement est par conséquent constitué d'un nombre entier de photons possédant chacun une énergie minimale égale au quantum d'énergie E_{\text {photon}}=h \cdot \nu.
E_{\text {photon}} s'exprime en joule (J) et la fréquence \nu en hertz (Hz). h est la constante de Planck : h=6\text{,}63 \times 10^{-34} J·s. - Le photon est une particule de masse et de charge électrique nulles se déplaçant, dans le vide, à la vitesse de la lumière.
Remarque : L'énergie d'un photon est d'autant plus grande que sa fréquence est élevée (et que sa longueur d'onde est faible).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4L'effet photoélectrique
Il s'agit de l'émission d'un courant électrique par un métal en présence de lumière. La vitesse des électrons arrachés ne dépend pas du flux lumineux mais uniquement de la longueur d'onde.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Corpuscule : synonyme de particule.
- Radiation : déplacement de photons.
- Quantum : mot latin signifiant la plus petite quantité d'énergie indivisible transportée par une radiation. Le centime est à la monnaie ce que le quantum est à la quantité d'énergie d'un atome.
- Photon : particule élémentaire qui transporte le quantum d'énergie lumineuse.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Application
Calculer l'énergie du photon le plus énergétique du domaine
visible.
Corrigé
- Avec un domaine visible compris entre 400 nm et 800 nm, la radiation la plus énergétique est celle de plus courte longueur d'onde, soit 400 nm (à la limite de l'UV).
- On peut déterminer successivement la fréquence de la radiation \nu=\dfrac{c}{\lambda} puis l'énergie E égale à E=h \cdot \nu soit directement E=\dfrac{h \cdot c}{\lambda}.
- Numériquement E=\dfrac{6\text{,}63 \times 10^{-34} \times 3\text{,}00 \times 10^{8}}{400 \times 10^{-9}} donc E=4\text{,}97 \times 10^{-19} J soit E=3\text{,}11 eV.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- h=6\text{,}63 \times 10^{-34} J·s ;
- 1 eV =1\text{,}60 \times 10^{-19} J ;
- c=3\text{,}00 \times 10^{8} m·s-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- L'énergie d'un photon est toujours positive :
E_{\text {photon}}>0. - L'unité légale de l'énergie est le joule. Cependant,
les énergies échangées lors des interactions entre la lumière et la matière sont si faibles qu'on utilise
le plus souvent l'électron-volt (eV) :
1 eV =1\text{,}60 \times 10^{-19} J.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3La quantification des niveaux d'énergie d'un atome
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
A Le diagramme d'énergie d'un atome
Chaque atome possède une structure électronique de couches et
sous-couches (1s, 2s, 2p, etc.) sur lesquelles se répartissent tous les électrons. Ces couches existent même si elles ne sont pas occupées.
Chaque sous-couche associée à une orbite possède sa propre énergie, qui est d'autant plus faible qu'elle est proche du noyau.
On utilise un diagramme énergétique pour représenter les différents niveaux d'énergie intrinsèques à l'atome.
Chaque niveau d'énergie est modélisé par une ligne horizontale. On reporte leur valeur d'énergie sur un axe vertical, le plus souvent exprimé en électron-volt (eV).
L'énergie de l'atome correspond à la somme des énergies de chaque électron. À chaque niveau correspond un état.
On distingue deux types d'états : l'état fondamental, souvent noté E_{1}, et les états supérieurs, dits excités. L'état ionisé étant l'état (limite) pour lequel l'électron a quitté l'atome (doc. 5). L'état ionisé correspond au niveau d'énergie E_{\infty}=0 eV, tous les autres niveaux ont une énergie négative.
D'après Niels Bohr (1913), l'atome n'est stable que pour certaines valeurs d'énergie discrètes bien définies. Son énergie est quantifiée.
Chaque sous-couche associée à une orbite possède sa propre énergie, qui est d'autant plus faible qu'elle est proche du noyau.
On utilise un diagramme énergétique pour représenter les différents niveaux d'énergie intrinsèques à l'atome.
Chaque niveau d'énergie est modélisé par une ligne horizontale. On reporte leur valeur d'énergie sur un axe vertical, le plus souvent exprimé en électron-volt (eV).
L'énergie de l'atome correspond à la somme des énergies de chaque électron. À chaque niveau correspond un état.
On distingue deux types d'états : l'état fondamental, souvent noté E_{1}, et les états supérieurs, dits excités. L'état ionisé étant l'état (limite) pour lequel l'électron a quitté l'atome (doc. 5). L'état ionisé correspond au niveau d'énergie E_{\infty}=0 eV, tous les autres niveaux ont une énergie négative.
D'après Niels Bohr (1913), l'atome n'est stable que pour certaines valeurs d'énergie discrètes bien définies. Son énergie est quantifiée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Attention à la conversion entre le joule (J) et l'électron- volt (eV).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 5L'effet photoélectrique

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Transition : passage d'un électron d'un niveau d'énergie à un autre. Elle est représentée par une flèche.
- État fondamental : état stable de plus faible énergie de l'atome.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B L'émission et l'absorption d'un photon
Lors d'une transition entre deux niveaux d'énergie, notés E_{\mathrm{n}} et E_{\mathrm{m}} :
- l'énergie d'un atome augmente ou diminue, respectivement en absorbant ou en émettant un photon ;
- l'énergie échangée |\Delta E| (absorbée/émise) par l'atome possède exactement une valeur égale à la différence des niveaux d'énergie |\Delta E_{\text {atome}}|=|E_{\mathrm{n}}-E_{\mathrm{m}}| ;
- la variation d'énergie de l'atome est égale à l'énergie d'un photon.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Lors d'une transition, un photon ne peut être absorbé ou émis par l'atome que si : E_{\text {photon}}=|\Delta E_{\text {atome}}|.
- Une variation \Delta E\lt0 correspond à l'émission d'un photon, \Delta E>0 une absorption d'un photon.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

