Chapitre 5
Activité 1 - Activité d'exploration
Histoire d'un modèle, le modèle de l'atome
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
Pour expliquer le monde qui nous entoure, les scientifiques font appel à des modèles. Ces derniers permettent de décrire un phénomène. Un modèle n'est donc pas la réalité mais une image de celle-ci. Tant qu'aucune observation expérimentale ne contredit le modèle, on le considère comme pertinent.
Comment le modèle de l'atome a-t-il évolué au cours des siècles ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Avant de commencer, je dessine ma propre vision d'un atome.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 Quelques modèles de l'atome


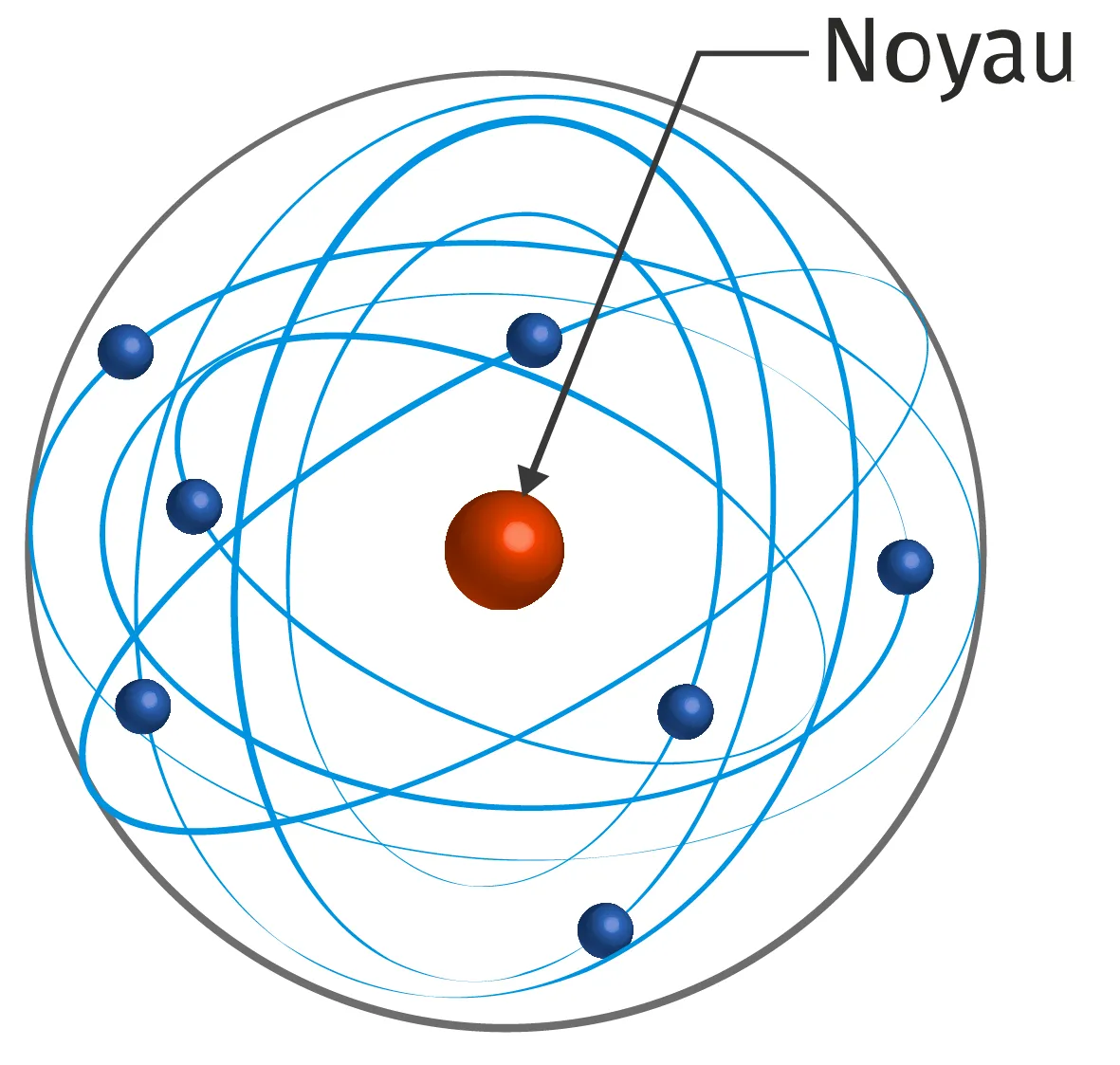

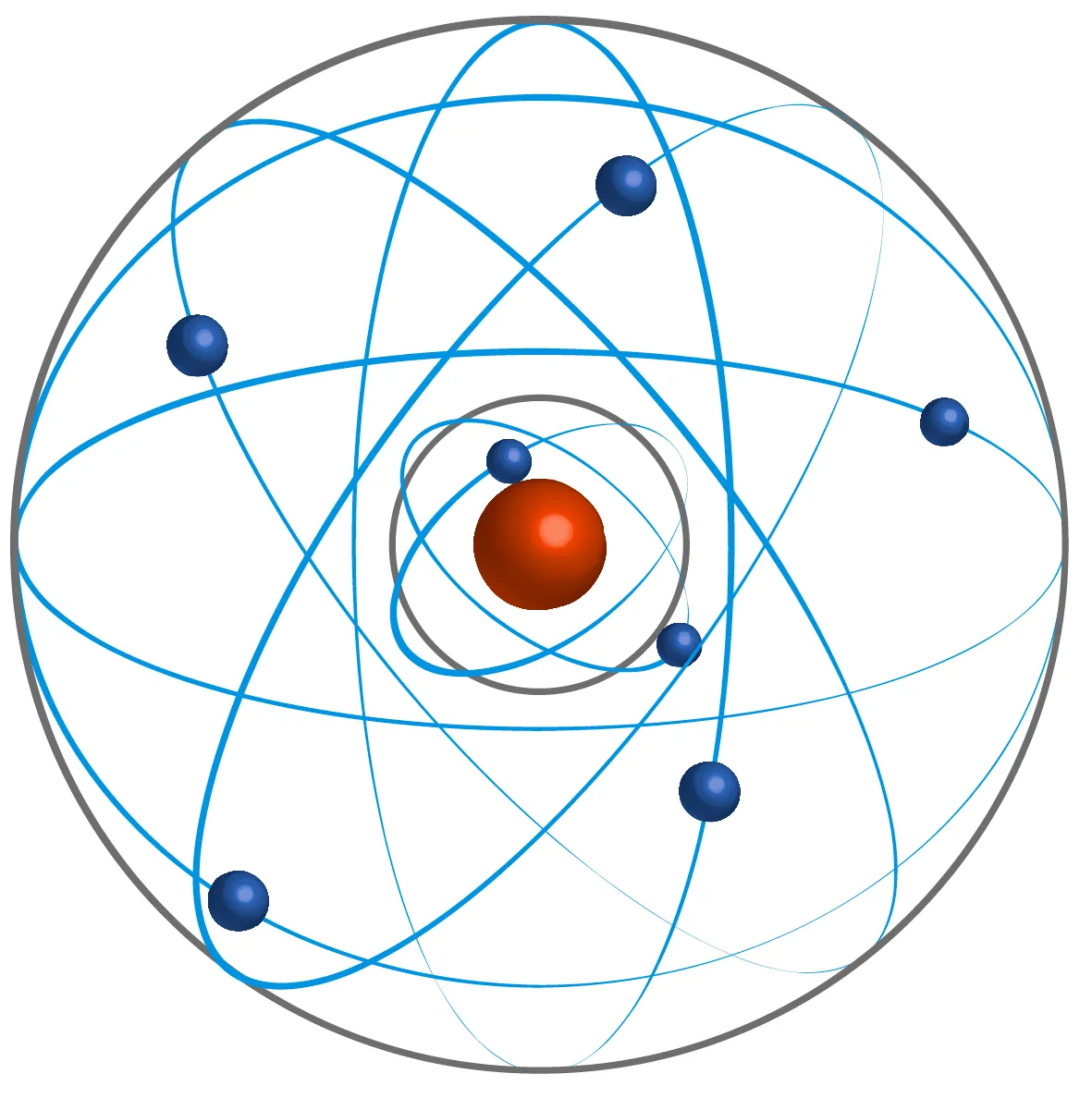

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Des faits expérimentaux
• 1804 : En étudiant le comportement des gaz, John Dalton reprend une idée de la Grèce antique longtemps abandonnée : la matière est composée de petits grains insécables appelés alors atomos.
• 1897 : Découverte de l'électron qui est une particule chargée négativement par John Thomson. Il propose pour l'atome un modèle de sphère de structure positive parsemée d'électrons.
• 1900 : Max Planck étudie la quantification des échanges d'énergie dans la matière qui laisse supposer que les électrons ne peuvent pas être à n'importe quelle distance du noyau.
• 1897 : Découverte de l'électron qui est une particule chargée négativement par John Thomson. Il propose pour l'atome un modèle de sphère de structure positive parsemée d'électrons.
• 1900 : Max Planck étudie la quantification des échanges d'énergie dans la matière qui laisse supposer que les électrons ne peuvent pas être à n'importe quelle distance du noyau.
• 1911 : Découverte du noyau atomique chargé positivement et beaucoup plus petit que l'atome par Rutherford. Il propose un modèle où les électrons sont répartis dans un nuage autour du noyau mais à distance de celui-ci.
• 1913 : Unification des théories de Max Planck et Ernest Rutherford par Niels Bohr. Il propose un modèle de répartition des électrons en couches.
• 1914 : Confirmation de la quantification des échanges d'énergie dans la matière par James Franck et Gustav Hertz.
• 1913 : Unification des théories de Max Planck et Ernest Rutherford par Niels Bohr. Il propose un modèle de répartition des électrons en couches.
• 1914 : Confirmation de la quantification des échanges d'énergie dans la matière par James Franck et Gustav Hertz.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retrouver l'histoire des atomes dans la première partie de cette (jusqu'à 3'30").
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
MOD : Connaître la structure de l'atome
1. a. Doc. 1 et 2 Associer chaque modèle à son inventeur en justifiant son choix.
b. Faire une frise chronologique sur laquelle apparaît chaque modèle et le nom de son (ou ses) inventeur(s). Vous pouvez utiliser l'application gratuite .
2. Doc. 2 Identifier la raison qui a poussé John Thomson à remettre en cause le modèle antique (Leucippe et Démocrite) et de John Dalton.
3. Pourquoi le modèle de Bohr a-t-il été préféré à celui de Rutherford ?
4. Rappeler les étapes de la démarche scientifique. En quoi l'évolution du modèle de l'atome en est un exemple ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
Comment se répartissent les électrons dans un atome d'après le modèle de Bohr ?
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

